腫瘤免疫微環境及腫瘤精準治療進展
徐媛媛 崔瀛書 龍 珊 文慶蓮 李曉松
(1.西南醫科大學附屬醫院腫瘤科,四川 瀘州,646099;2.中國人民解放軍總醫院第五醫學中心腫瘤醫學部,北京,100039;3.中國人民解放軍醫學院,北京,100853;4.南開大學醫學院,天津,300074)
腫瘤微環境是有利于腫瘤生長繁殖的局部穩態環境,由腫瘤細胞和其他基質細胞(如免疫細胞、炎性細胞和成纖維細胞等)組成[1]。研究發現,由免疫細胞、細胞表面受體和相關細胞因子構建的腫瘤免疫微環境可阻止機體免疫對腫瘤細胞的特異性識別,使其發生免疫逃逸,從而加速機體腫瘤的生長、增殖、復發和轉移[2-3]。因此,靶向腫瘤免疫微環境的精準療法應運而生,在抗腫瘤臨床應用中取得一定療效,成為繼手術、放化療后治療腫瘤的有效手段。本文將介紹腫瘤免疫微環境的組成及其對腫瘤生長的影響,闡述以腫瘤免疫微環境為治療靶點的精準療法的臨床應用。
1 腫瘤免疫微環境的組成及對腫瘤細胞生長繁殖的影響
抗腫瘤免疫微環境和腫瘤免疫抑制性微環境共同存在,兩者之間的制衡力量決定了腫瘤微環境中的血管重塑速度和腫瘤細胞生長、繁殖、轉移、復發等生物學特性,見圖1。
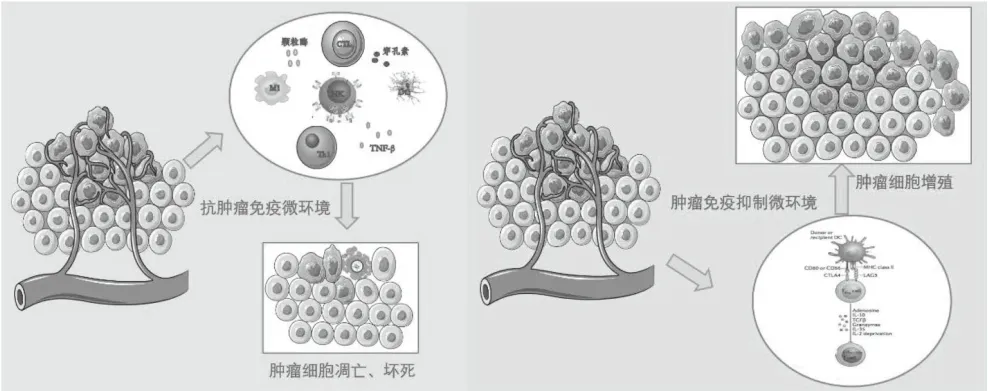
圖1 腫瘤免疫微環境影響腫瘤細胞生物學特性
1.1 抗腫瘤免疫微環境
抗腫瘤免疫應答包括細胞免疫和體液免疫,其中主要應答方式為細胞免疫,“主力軍”是細胞毒性T細胞,其可特異性地識別腫瘤細胞表面抗原決定簇主要組織相容性復合體(MHC)Ⅰ類復合物轉化為效應T細胞。效應T細胞可分泌顆粒酶、穿孔素等分子促使腫瘤細胞死亡;另一方面可分泌腫瘤壞死因子(TNF)-β,表達細胞凋亡相關分子,從而誘導腫瘤細胞的凋亡[4-6]。
固有免疫是機體抗腫瘤免疫的天然免疫系統,可抑制腫瘤細胞生長繁殖,在清除腫瘤過程中發揮重要作用:(1)自然殺傷細胞(NK細胞)是機體殺傷腫瘤細胞的重要屏障,可通過多種方式發揮抗腫瘤作用。NK細胞可分泌TGF-α、IFNγ等趨化因子介導細胞毒性;當NK細胞表面激活性受體表達信號高于抑制性受體表達信號時,可釋放顆粒酶、穿孔素等介質殺傷腫瘤細胞;另外,NK細胞還通過表達FAS配體(FasL)和TNF相關凋亡誘導配體(TRAIL)這些配體與相應受體FAS和DR4/DR5結合,將使腫瘤細胞啟動死亡受體介導的細胞凋亡[7-8]。(2)抗原呈遞細胞(DC細胞)具有強大的提呈抗原能力,未成熟的DC細胞則高表達MHC-Ⅰ/Ⅱ、C3b受體及TLR2/TLR9等Toll樣受體,遷移能力強,可攝取、處理加工抗原,在刺激因素下轉化為成熟DC細胞;成熟的DC細胞高表達MHC-Ⅱ/Ⅰ和B7、CD40等共刺激分子,呈遞腫瘤抗原來激活T細胞,啟動免疫應答;在特定內環境下,DC細胞可分泌趨化因子,趨化初始T細胞;且DC細胞和T細胞結合后分泌白細胞介素(IL)-2、IL-8、IL-12等細胞因子,從而進一步激活T細胞的增殖,增強機體清除腫瘤的能力[9-10]。(3)M1型腫瘤相關巨噬細胞在機體免疫環境穩態或腫瘤生長早期數量較多,發揮一定的抗腫瘤免疫效應[11]。(4)固有淋巴樣細胞(ILCs細胞)是參與腫瘤固有免疫監視的淋巴細胞群。ILC1可依賴于RORγt并能夠分泌顆粒酶、IFNγ等殺死腫瘤細胞。ILC2可促使M2型巨噬細胞的轉化并聚集髓源性抑制細胞(MDSC),協助腫瘤參與免疫逃逸,促進腫瘤的進展。ILC3對于腫瘤發生發展具有抗癌抑癌雙向作用,其過分泌IL-22,促進癌癥的發生和生長,但亦有研究表明其可在IL-12和IL-15的誘導下轉化為NK樣細胞,從而特異性識別腫瘤表面相關配體殺傷腫瘤細胞[12-13]。
1.2 腫瘤免疫抑制性微環境
腫瘤免疫抑制性微環境較復雜且動態變化,協助腫瘤細胞免疫逃逸,其中免疫抑制性細胞發揮主力作用,包括Treg細胞、骨髓來源的抑制性細胞及腫瘤相關巨噬細胞等。此外,免疫相關抑制性細胞因子和由腫瘤細胞產生的免疫相關抑制分子也參與了免疫抑制性微環境的構建,交互復雜的網絡共同調控著腫瘤細胞的生長繁殖、遷移、侵襲和轉移。
1.2.1 免疫抑制性細胞
調節性T細胞多為CD4+CD25+T細胞亞群,是腫瘤患者自身免疫負反饋的主要細胞之一。活化后的Treg細胞可通過分泌抑制性細胞因子或代謝競爭物抑制DC細胞、效應T細胞和NK細胞等的殺傷能力。此外,其可上調免疫檢查點抑制劑[如LAG-3、CTLA-4及細胞程序性死亡配體(PD-L1)等],從而抑制機體免疫[7,14]。在腫瘤微環境中,相關巨噬細胞由M1型轉變為M2型,可激活PI3Kγ信號通路,抑制效應T細胞的活化[15-16]。MDSCs是來源于非正常機體骨髓的抑制性細胞,在免疫微環境中干擾T細胞的活力和遷移,競爭性的攝取T細胞所需的營養物質,從而抑制效應T細胞的數量和質量[17-18]。
1.2.2 免疫相關抑制性細胞因子
免疫相關抑制性細胞因子由免疫抑制性細胞激活產生,交互作用于抗腫瘤免疫細胞和腫瘤抑制性免疫細胞,幫助腫瘤免疫逃逸,促使腫瘤血管生成,從而促進腫瘤的發生和進展。缺氧的腫瘤微環境可促使巨噬細胞分泌促血管生成因子[如表皮生長因子(VEGR)、IL-8和PGE2等以及血管外基質(如MMP-9和μPA等),使得腫瘤血管快速生成,在加速腫瘤生長繁殖過程中發揮重要作用[19-20]。研究發現IL-10可下調表面呈遞抗原決定簇MHCⅡ類分子,抑制CD80、CD86的表達從而抑制CD4+T細胞的功能[21-23]。IL-17具有雙重免疫效應,可抑制MDSCs的增殖能力,同時能促進炎癥細胞因子IL-6、IL-12、TNF-α等的分泌,激活效應T細胞和NK細胞的抗腫瘤免疫效應[24]。
1.2.3 免疫相關抑制分子
腫瘤細胞分泌或腫瘤細胞表面存在一些負性調節分子,如細胞程序性死亡受體(PD-1)以及PD-L1、GAL-3、CTLA-4、LAG-3、TIM3等[25-26]。近年來,精準靶向此類分子治療使患者受益匪淺,在靶向免疫微環境的精準醫療中具有里程碑意義。
2 腫瘤免疫逃逸
免疫系統可監視機體識別并殺滅腫瘤細胞,但腫瘤細胞的修飾可使免疫抑制細胞因子和基質細胞動態變化,將抑制腫瘤生長的微環境轉變為促進腫瘤生長的微環境,從而介導其逃避機體免疫的監視。腫瘤細胞表面抗原的缺失、MHC Ⅰ類分子的降低及其正性共刺激分子表達下降,使其免疫原性弱且提呈抗原的能力弱,減弱T細胞增殖和活化的第二信號,此時抗腫瘤免疫微環境無法誘導機體產生免疫應答。研究表明,腫瘤細胞負性共刺激分子和免疫抑制性分子表達的升高是其逃避免疫監視的重要原因[27-28]。隨著對腫瘤免疫逃逸的深入研究,靶向免疫微環境的抗腫瘤治療應運而生,為腫瘤個體化治療和精準治療模式提供重要依據。
3 靶向免疫微環境的精準醫療
3.1 免疫檢查點抑制劑(immune checkpoint inhibitor,ICI)療法
ICI是針對阻斷免疫檢查點的腫瘤免疫治療,近年來通過了多種腫瘤治療的臨床試驗,是目前臨床應用最廣的腫瘤免疫治療之一。2011年,第一個靶向免疫檢查點CTLA-4的抑制劑——單抗藥物伊匹單抗(ipilimumab)獲得FDA批準上市,應用于晚期黑色素瘤的免疫治療。2014年,全球首個PD-1抑制劑——Nivolumab于日本上市,同年Keytruda(靶向免疫檢查點PD-1)被FDA批準上市,幾年時間被批準黑色素瘤、復發性頭頸癌、晚期非小細胞肺癌等至少15種癌癥的免疫治療,開創了腫瘤免疫治療新紀元[29-32]。P D-L1抑制劑也廣泛應用于臨床,2019年Durvalumab成為在國內首個成功上市的適用于治療進展的Ⅲ期非小細胞肺癌;2020年阿替利珠單抗注射液Atezolizumab在國內上市,批準于小細胞肺癌的一線治療;2021年全球首個皮下注射PD-L1抑制劑——恩沃利單抗在國內批準用于實體瘤患者的治療,避免了靜脈輸液不耐受的患者無法用藥的情況,注射劑量較靜脈輸液少,減少了免疫相關副反應的發生;2022年,Upadhaya等統計報告,全球以PD-1/PD-L1 抑制劑進行單藥治療或聯合治療的正在進行的臨床試驗有5683項,是抗腫瘤治療中最具曙光的領域之一[33-34]。
3.2 免疫細胞治療
通過基因改造嵌入抗原受體的T細胞可特異性地識別腫瘤相關表面抗原,避免腫瘤細胞免疫逃逸,促進T細胞殺死癌細胞。2017年Kymriah、Yescarta被FDA批準上市,開啟了血液腫瘤免疫治療的先河[35-36]。目前,其他CAR-T治療血液腫瘤和實體腫瘤的臨床試驗在廣泛開展中,迎來了免疫細胞治療的曙光。
3.3 免疫性放療
放療與免疫檢查點抑制劑、免疫佐劑、CAR-T等免疫療法聯合應用,在腫瘤免疫調節方面實現了共贏。低劑量放療可改善T細胞的歸巢,聯合免疫細胞療法提高了免疫細胞浸潤水平。韓松辰團隊[37]、藍清華團隊[38]研究發現兩者聯合改善腫瘤免疫微環境,使T細胞的浸潤水平達到最佳。研究表明,大分割放療使腫瘤相關抗原表達增多,發揮腫瘤疫苗效應,聯合免疫檢查點抑制劑和免疫佐劑可提高腫瘤患者全身免疫效應,延長患者無進展生存期和壽命[39]。
3.4 腫瘤疫苗治療
腫瘤疫苗的制備近幾年發展迅速,研究者旨在將滅活的腫瘤細胞、表達腫瘤相關抗原的基因等導入腫瘤患者體內,增強或誘導機體免疫應答,逆轉腫瘤免疫抑制微環境,從而達到精準激活免疫系統,促使T淋巴細胞活化并加強細胞免疫因子的釋放,控制腫瘤生長繁殖。目前,腫瘤疫苗可分為預防性抗腫瘤疫苗和治療性抗腫瘤疫苗。宮頸癌疫苗和乙肝疫苗的廣泛應用,可控制宮頸癌和肝癌的發生。治療性抗腫瘤疫苗可激活T細胞數目,主要用于術后輔助治療。過去十年里,用于前列腺癌、膀胱癌及黑色素瘤等疫苗被批準應用于臨床,并延長了患者的生存期[40]。
3.5 腫瘤代謝調節療法
精準調節腫瘤代謝改善腫瘤免疫抑制微環境也取得了顯著的效果。IDO抑制劑epacadostat和ndoximod臨床試驗表現出良好的安全性和有效性[41]。epacadostat和pembrolizumab(抗PD-1抗體)的聯合應用延長了晚期癌癥患者的無癥狀進展期和壽命[42]。谷氨酰胺酶抑制劑CB-839、單羧酸轉運蛋白抑制劑AZD3965等系列臨床試驗也在招募中。
3.6 其他精準免疫療法
免疫調節劑可調節免疫細胞功能,如干擾素-α、IL-2應用于白血病、晚期惡性黑色素瘤等腫瘤患者,具有一定的療效。ICI聯合抗血管生成藥,ICI聯合化療可阻斷腫瘤血管生成通路,促使腫瘤微環境短暫的正常化,增強其免疫原性,在未來個體化治療腫瘤道路上發揮不可替代的作用[43-44]。
3 小結
腫瘤免疫微環境的異常與腫瘤的發展聯系密切,因此,精準其組成成分、重塑健康穩定的免疫微環境是實現腫瘤個體化治療的戰略革新,是腫瘤精準醫療的重要力量。自21世紀以來,精準免疫療法取得了突飛猛進的成果,成為治療腫瘤的核心手段之一。但免疫療法的穩定性、安全性和有效性在既往研究和臨床應用中也不盡人意,而精準免疫療法與分子靶向藥物、放療、化療等多模式聯合治療更有利于發揮抗腫瘤的功能,成為人類消滅腫瘤細胞的新型武器。

