聯合敲減eIF4E和YB1基因對人宮頸癌細胞增殖、侵襲和遷移能力的影響
王曉露 成瑩 沐超 胡新榮
宮頸癌是常見的婦科惡性腫瘤,其病因多樣。每年因宮頸癌死亡的女性超過50萬人[1],盡管接種人乳頭瘤病毒(human papillomavirus,HPV)疫苗使得宮頸癌的發病率和死亡率都有所下降,但疫苗接種并不能完全阻止宮頸癌的發生,且對已患宮頸癌的女性也無治愈作用[2]。現階段,治療宮頸癌的原則仍以手術為主并輔以放化療等方式[3],這些手段對中晚期宮頸癌患者的效果并不十分理想[4,5]。因此,臨床上需要更有效、更具有針對性的治療手段。細胞翻譯功能將攜帶遺傳信息的信使RNA轉化為具有功能活性的蛋白質,保證細胞存活的同時行使特定細胞功能活動[6]。腫瘤細胞的惡性生物學行為是翻譯功能將細胞紊亂的遺傳信息傳遞出來的一種外在表象。通過抑制腫瘤細胞的翻譯功能來抑制細胞表型已被證實可行[7],由此猜想聯合敲減翻譯相關基因是否可以大幅抑制宮頸癌細胞惡性生物學行為?真核細胞翻譯起始因子4E(eukaryotic translation initiation factor,eIF4E)是一種致癌基因,eIF4E蛋白作為一種高度保守的mRNA帽結合蛋白質,控制著蛋白質的帽依賴性翻譯的起始,帽依賴性翻譯是真核生物蛋白質主要翻譯方式[8]。研究表明,eIF4E通過與多條信號通路密切聯系參與腫瘤發生;在宮頸癌細胞中eIF4E被異常激活后促進腫瘤細胞的生長、侵襲和遷移能力[9,10]。Y盒結合蛋白1(Y-Box binding protein-1,YB-1)同樣也是一種致癌基因,YB-1蛋白有3個結構域:氨基酸N末端(A/P domain)、親水結構域末端(C-terminal domain,CTD)和冷休克結構域(cold shock domain,CSD),3個結構域參與多種生物學功能。研究表明,YB1基因在多種腫瘤細胞的發生發展中起作用,YB-1與促進細胞增殖、分化和腫瘤細胞的遷移等密切相關[11];除此之外,在腫瘤細胞中YB1還通過充當轉錄因子上調或下調從而激活/抑制基因的轉錄從而調節細胞翻譯[12]。YB1基因在多種腫瘤細胞的發生發展中起作用[13-17]。與其他腫瘤相比,eIF4E和YB1基因在宮頸癌上的研究相對較少,因此, 這兩個基因在宮頸癌上還有很多值得探究的地方。通過初步探索聯合敲減YB1和eIF4E基因對宮頸癌細胞的增殖、侵襲和遷移等惡性生物學行為的影響,為后續探究YB1和eIF4E基因在宮頸癌中的具體作用以及分子機制提供更好的參考依據,為將來宮頸癌靶向治療藥物的開發提供一條新的思路,同時希望為臨床宮頸癌的治療提供一條新路徑。
1 材料與方法
1.1 材料與試劑 CO2細胞培養箱(美國 Thermo Scientific公司);TS100倒置式生物顯微鏡(美國Thermo Scientific公司);SW-CJ-2FD型超凈工作臺(蘇州市凈化設備廠)潔凈工作臺(上海博訊實業有限公司);胎牛血清 FBS(貨號 10270-106),(美國 GIBCO 公司 );DMEM高糖培養基(貨號 C11995500BT),(美國 GIBCO 公司);青-鏈霉素溶液(北京索萊寶科技有限公司);胰酶(北京索萊寶科技有限公司);eIF4E上下游引物(上海捷瑞公司);CCK-8試劑盒(貨號 CK04)(日本同仁公司);Matrigel膠(BD Bioscience);Lipofectamine 3000轉染試劑(上海 invitrogen公司)。
1.2 實驗細胞及分組情況 實驗細胞:宮頸癌HeLa細胞和C33a細胞(購自協和細胞庫),分組:HeLa細胞系:mock空白對照組、NC組、sh-YB1組、Si-eIF4E組、 共敲減shYB1+Si-eIF4E組;C33a細胞系:mock空白對照組、NC組、shYB1組、Si-eIF4E組、shYB1+Si-eIF4E組。
1.3 慢病毒干擾載體 慢病毒干擾載體由上海吉瑪基因公司構建,載體名稱: LV3-4YB1-Homo-540904,sh-YB1 序列為: 5’-GGATATGGTTTCATCAACA-3’。實驗過程按說明書操作。見圖1。
1.4 細胞培養及轉染 復蘇HeLa(mock和sh-YB1)、C33a(mock和sh-YB1)細胞,待細胞匯合度達90%時進行傳代,分別加入0.25%胰蛋白酶1 ml消化,1 000 r/min離心5 min ,棄上清液加入3 ml的完全培養基,轉入T25細胞培養瓶培養,待細胞匯合度達90%時按照以上步驟再次傳代,細胞傳至第三代時轉染。細胞接種至六孔板,培養至密度約60%時轉染24 h后的細胞用于后續實驗。
1.5 實時熒光定量聚合酶鏈反應(RT-qPCR) 轉染24 h后的細胞用 Trizol 法提取細胞RNA,并進行實時熒光定量聚合酶鏈反應。逆轉錄合成 cDNA,PCR進行擴增。內參GAPDH,根據熔解曲線判斷 RT-qPCR 擴增產物的特異性。見表1。

表1 RT-qPCR 擴增引物序列
1.6 CCK-8 法檢測細胞增殖活性 轉染24 h后細胞消化離心完全培養基4 ml重懸,將細胞吹打混勻后計數板計數。取96孔板5塊,分別標記 0、24、48、72、96 h,每孔細胞數量3 000個,體積100 ml,消耗系數1.1,設置5個復孔,置于37℃,5%CO2培養箱分別培養: 0、24、48、72、96 h。屆時每孔加入現配CCK-8混合液(CCK-8溶液:基礎培養基=1∶10)110 μl。培養箱避光孵育2 h,酶標儀波長450 nm處檢測96孔板吸光度(OD 值),抑制率=[(對照孔吸光度-實驗孔吸光度)/(對照孔吸光度-空白孔吸光度)]×100%。
1.7 平板細胞克隆形成實驗 細胞做好標記后消化離心重懸計數。六孔板每孔細胞數量1 500個,體積2 000 ml,設置3個復孔,置于37℃5%CO2培養箱培養每個克隆斑細胞數>50 個細胞即終止培養,舊培養基吸出、風干,后甲醛固定結晶紫染色,相機拍照記錄,Image J軟件計數克隆。克隆形成率 =(克隆數/接種細胞數)×100%。
1.8 細胞侵襲實驗 Matrigel 膠冰箱 4℃ 融化,按照基質膠:DMEM 培養基=1∶10 稀釋基質膠,用預冷的100 μl槍頭吸取50ul基質膠加入Transwell小室,之后將24孔板置于培養箱中過夜。次日, 24孔板中加入600 μl 15%FBS無雙抗完全培養基,轉染24 h后的細胞消化離心(方法同上),1 ml無血清基礎培養基重懸計數并將細胞稀釋至105個/ml,上室中加入100 μl 細胞懸液,培養箱內繼續培養48 h。移液器小心吸除上室內液體,PBS清洗2遍,吹干小室膜,甲醇固定結晶紫染色,倒置顯微鏡鏡下拍照,隨機選取4個視野照相,利用 Image J 軟件統計照片的細胞數,計算平均值。
1.9 細胞遷移實驗 遷移實驗中無需加入基質膠,其他步驟同侵襲實驗。
2 結果
2.1 RT-qPCR、western blot檢測轉染效果 分別在24 h、48 h,收集細胞檢測YB1及eIF4E的 mRNA和蛋白的表達量。結果表明:敲減YB1和eIF4E基因后其mRNA和蛋白表達量明顯下降,mRNA表達量下降均>60%,差異有統計學意義(P<0.05);蛋白質表達量下降幅度均>55%,差異有統計學意義(P<0.05),說明YB1和eIF4E基因敲減效率較高,可用于后續實驗。見表2,圖2、3。
表2 HeLa及C33a系細胞敲減eIF4E和YB1基因后mRNA和蛋白表達量
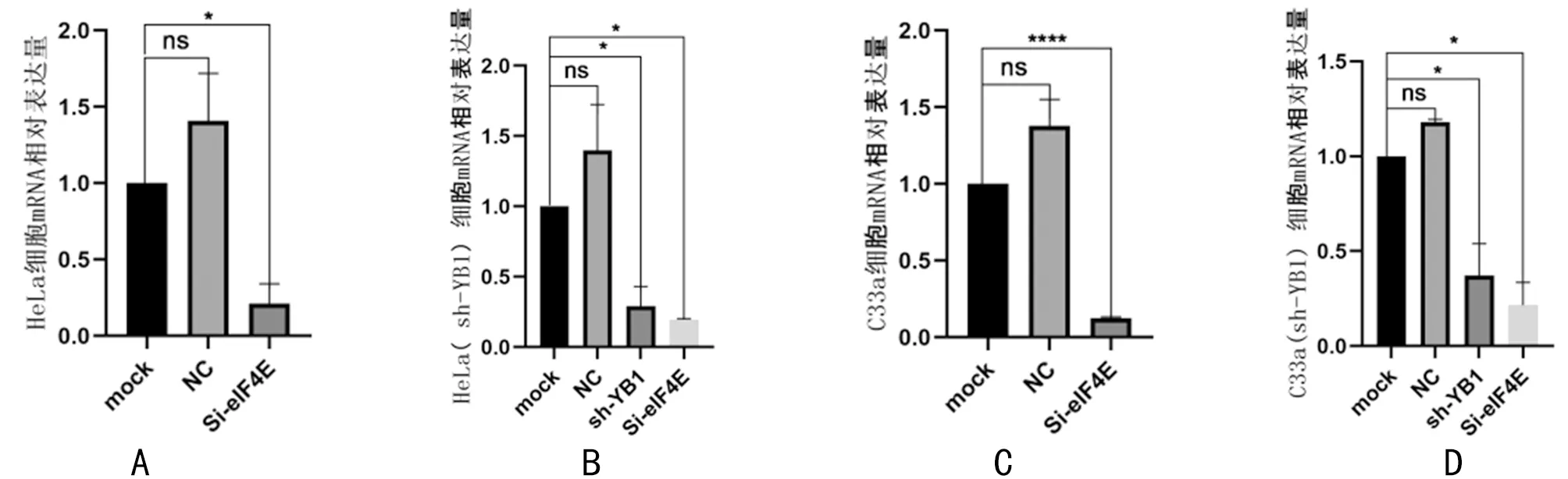
圖2 瞬時轉染SiRNA-eIF4E后各組YB1與eIF4E的mRNA相對表達量;A HeLa細胞;B HeLa(sh-YB1)細胞;C C33a細胞;D Ca33a(sh-YB1)細胞
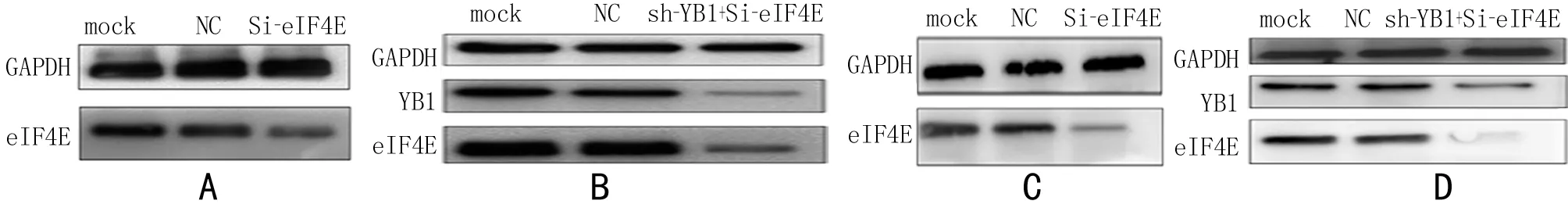
圖3 瞬時轉染SiRNA-eIF4E后各組YB1與eIF4E的蛋白相對表達量;A HeLa細胞;B HeLa(sh-YB1)細胞;C C33a細胞;D Ca33a(sh-YB1)細胞
2.2 敲減YB1和eIF4E對宮頸癌細胞增殖和平板細胞克隆形成能力的影響
2.2.1 細胞增殖實驗結果表明,HeLa和C33a細胞敲減YB1和eIF4E基因后細胞增殖能力受到抑制,sh-YB1組、Si-eIF4E組及共敲減YB1+eIF4E組與mock組及NC組之間細胞吸光度差異有統計學意義(P<0.05)。在增殖能力上:mock 組 與NC組 OD 值差異無統計學意義(P>0.05)。敲減YB1和(或)eIF4E基因后,細胞吸光度下降明顯(P<0.05),且sh-YB1+Si-eIF4E組吸光度較sh-YB1或Si-eIF4E均減小,差異有統計學意義(P<0.05)。
2.2.2 平板細胞克隆形成實驗表明, sh-YB1組、Si-eIF4E及共敲減YB1+eIF4E組克隆形成數量明顯低于mock組及NC組HeLa細胞系中與mock組相比sh-YB1組及Si-eIF4E組和共敲減YB1+eIF4E組平板細胞克隆形成率分別降低了27.1%、39.5%和68.3%(P<0.05);C33a細胞系中與mock組相比sh-YB1組、Si-eIF4E組和共敲減YB1+eIF4E組細胞克隆形成率分別降低了41.8%、47.8%和77.1%差異有統計學意義(P<0.05)。見表3~5,圖4、5。
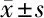
表3 5組細胞增殖活性HeLa細胞吸光度
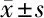
表4 5組細胞增殖活性C33a細胞吸光度
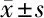
表5 HeLa細胞系與C33a細胞系細胞克隆形成數目 個,

圖4 共敲減YB1和eIF4E基因抑制宮頸癌細胞的增殖能力;A HeLa細胞系;B C33a細胞系
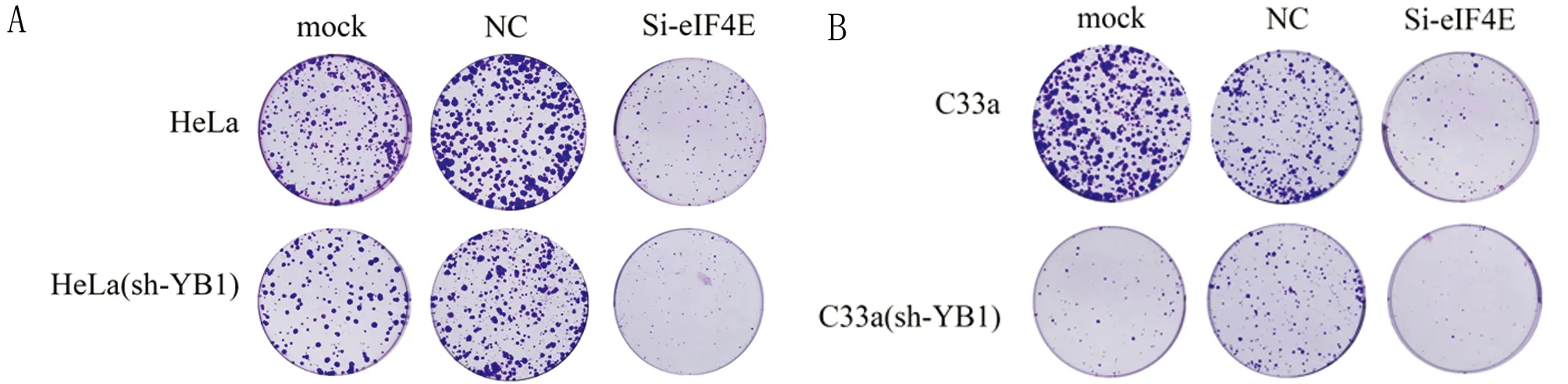
圖5 共敲減YB1和eIF4E基因抑制宮頸癌細胞的克隆形成能力(結晶紫染色×100);A HeLa細胞系;B C33a細胞系
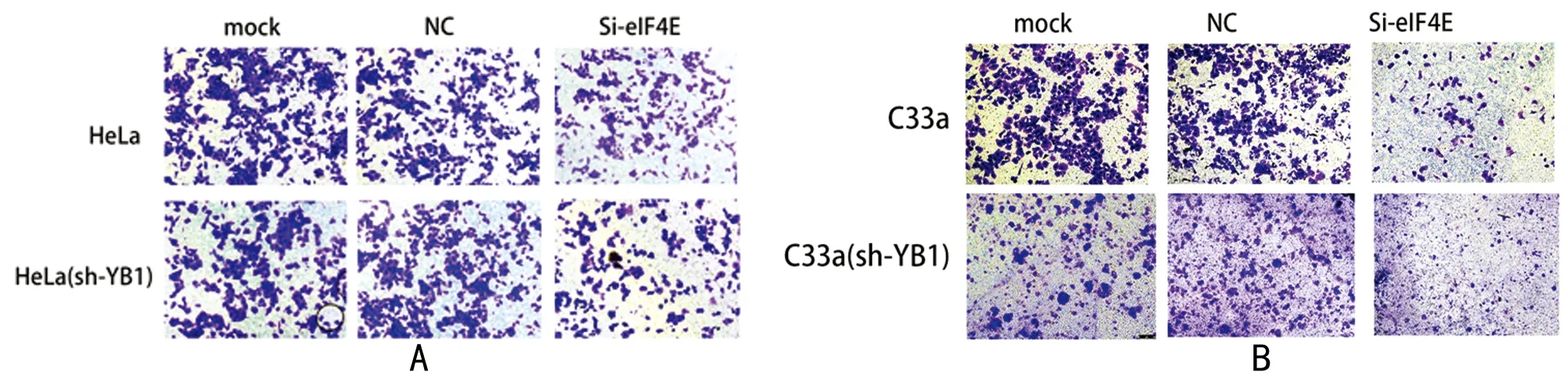
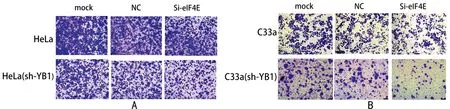
2.3 敲減YB1和eIF4E對宮頸癌細胞侵襲和遷移能力的影響 Transwell實驗結果表明,HeLa和C33a細胞分別敲減YB1和eIF4E基因后細胞侵襲和遷移能力受到抑制,sh-YB1組、Si-eIF4E組和共敲減YB1+eIF4E組相比于mock組及NC組之間穿過小室的細胞明顯減少,且穿過小室的細胞數目:共敲減YB1+eIF4E組 表6 共敲減YB1和eIF4E基因抑制宮頸癌細胞的侵襲能力 表7 共敲減YB1和eIF4E基因抑制宮頸癌細胞的遷移能力 圖6 共敲減YB1和eIF4E基因抑制宮頸癌細胞的侵襲能力(結晶紫染色×100);A HeLa細胞系;B C33a細胞系 圖7 共敲減YB1和eIF4E基因抑制宮頸癌細胞的遷移能力(結晶紫染色×100);A HeLa細胞系;B C33a細胞系 宮頸癌手術術后身體機能恢復過程漫長,諸多后遺癥也會伴隨患者終身,嚴重的甚至降低患者的生活質量[1,7]。HeLa細胞作為第一個被分離出來的宮頸癌永生化細胞被廣泛用于腫瘤研究中,HeLa細胞為侵襲性腺癌HPV18+宮頸癌細胞;C33a細胞是染色體數目為46的假二倍體HPV-宮頸癌細胞。通過對HPV+和HPV-的兩種宮頸癌細胞的研究使實驗結果更加客觀全面。聯合敲減eIF4E和YB-1基因減弱宮頸癌細胞的增殖、侵襲和遷移能力深入研究聯合敲減eIF4E和YB-1將對臨床宮頸癌治療靶向藥物的開發有著重要意義。 eIF4E是eIF4F的組成部分,其含量及活性會影響eIF4F復合物的形成,eIF4E作為eIF4F的限速分子控制翻譯的進程:真核生物蛋白質翻譯起始時依賴于mRNA 的 5’端的 m7G 帽結構,eIF4E蛋白一邊識別并結合mRNA 的5’端的 m7G 帽結構形成eIF4E -mRNA復合物[18];一邊與支架蛋白eIF4G相互作用;eIF4E-mRNA、eIF4G和解旋酶eIF4A結合形成eIF4F翻譯復合物,在核糖體上進行蛋白質翻譯[7]。研究表明,腫瘤細胞中eIF4E被異常激活,表達量增高;異常增高的eIF4E通過激活下游myc、BCL2、β-catenin等基因直接/間接調控細胞增殖、侵襲和遷移能力[19-21],本實驗表明,敲減eIF4E基因,抑制了宮頸癌中eIF4E基因的表達,明確減少eIF4E蛋白表達量,顯著降低宮頸癌細胞的增殖率、遷移率以及侵襲率,對宮頸癌惡性生物學行為的抑制是有效的。 YB-1屬于Y盒家族,Y盒是CCAAT盒中啟動子盒增強子中發現的重要序列基序[22]。磷酸化YB1穿梭核膜進入到核內充當生長相關基因的轉錄因子誘導相關基因表達;胞質中的YB1與RNA結合,調控mRNA的翻譯[23];通過胞質、核內的聯合作用,YB1參與復制、轉錄、翻譯各過程并調控其他腫瘤因子[24,25]。研究表明,YB1通過調控cyclin D1、Twist等基因的表達增強腫瘤細胞增殖、侵襲和遷移的能力[26,27]。本實驗結果顯示,敲減YB-1基因減弱了宮頸癌細胞的增殖、侵襲和遷移能力,由此猜測,YB1通過與多種基因的相互作用在宮頸癌惡性生物學行為中發揮著復雜的作用。 盡管eIF4E和YB-1都調控腫瘤的翻譯過程,但這兩個基因卻代表了兩種完全不同的翻譯方式:帽式翻譯和非帽式翻譯[28,29]。真核生物通過帽式/非帽式翻譯蛋白質,共敲減eIF4E和YB-1意在阻止宮頸癌細胞的帽式和非帽式翻譯功能,以此阻止腫瘤進展。實驗證明,共同敲減eIF4E和YB-1基因后,對宮頸癌細胞增殖、侵襲和遷移的抑制率大于單獨敲減任一基因。但由于細胞活動的復雜性和基因之間的敲減率并不相同等條件影響,本實驗存在一定的局限性。 綜上所述,YB1和eIF4E基因與宮頸癌的增殖侵襲和遷移等惡性生物學行為相關。聯合敲減YB1和eIF4E基因致使宮頸癌細胞增殖、侵襲和遷移能力明顯下降。為深入討論YB1、eIF4E基因對宮頸癌HeLa、C33a細胞的增殖、侵襲和遷移的具體分子機制打下了堅實的理論基礎。
3 討論

