絲瓜皮多酚的提取及抗氧化性研究
劉曉倩,陳佳宇,任文靜,郭 然,彭 琪,丁建英
(常熟理工學院生物與食品工程學院,江蘇 常熟 215500)
絲瓜(Luffa aegyptiacaMiller)屬于葫蘆科的攀援草本植物[1],別名為勝瓜、菜瓜,含有蛋白質、脂質、碳水化合物、鐵、鈣、磷、維生素B1及抗壞血酸等多種營養成分[2-3]。絲瓜皮可以作為中藥,具有清熱解毒、消炎、抗氧化、提高免疫力等功效[4,5]。相關研究顯示,絲瓜中含有多酚類物質[6],主要由類黃酮類和酚酸類成分組成[7];絲瓜皮中的多酚含量高于絲瓜果肉,其醇提物中總多酚含量為9.8 mg/g。而絲瓜皮作為絲瓜食用時的副產物常被當作廢棄物丟棄,利用率極低[4-5],因此對絲瓜皮功能成分的提取及研究,可為絲瓜皮資源的開發利用提供基礎。
超聲輔助提取方法與傳統提取方法相比,利用其熱作用和機械作用,可以促使功能成分的溶出,因此可以縮短時間、提高得率[8],用于多種功能成分的提取[4,9],本文用超聲輔助提取方法提取絲瓜皮中的多酚,通過研究不同的提取溫度、時間、乙醇濃度和料液比對多酚提取率的影響,利用單因素結合響應面法對多酚提取工藝進行優化,確定最優的提取工藝,同時研究其抗氧化性,以期為絲瓜皮的開發利用提供技術支持。
1 材料與方法
1.1 原料與試劑
新鮮壽光絲瓜購于常熟大潤發超市。
沒食子酸,上海源葉生物技術有限公司;福林酚試劑、無水乙醇、無水碳酸鈉、1,1- 二苯基-2- 苦基肼自由基(DPPH)、抗壞血酸(VC)、水楊酸、硫酸亞鐵,國藥集團化學試劑有限公司;30%過氧化氫溶液,強盛功能化學股份有限公司;以上試劑均為分析純。
1.2 儀器與設備
RE-5205A 旋轉蒸發儀,上海亞榮生化儀器公司;SHZ-D(III)循環水式真空泵,上海力辰邦西儀器科技有限公司;TU-1901 雙光束紫外分光光度計,北京普析通用儀器有限責任公司;KH-100DB 超聲波清洗機,昆山禾創超聲儀器有限公司;HH-4 數顯恒溫水浴鍋,國華電器有限公司;TG16-WS 高速臺式離心機,湖南湘儀實驗室儀器開發有限公司。
1.3 試驗方法
1.3.1 絲瓜皮多酚提取
絲瓜皮處理:將新鮮的絲瓜刮皮,刮下的絲瓜皮于陰涼處干燥24 h,再將絲瓜皮于60 ℃干燥至恒質量,磨成粉末,過60 目篩,置于4 ℃冰箱備用。
絲瓜皮多酚提取:稱取4 g 絲瓜皮粉末,倒入錐形瓶中,同時以不同料液比加入一定濃度的乙醇溶液,振蕩混勻,使絲瓜皮粉末與乙醇溶液充分混合,超聲功率為100 W,連續超聲提取一定時間,4 000 r/min 離心5 min,將上清液轉入旋轉蒸發儀進行濃縮,濃縮成原體積的1/4,得到絲瓜皮多酚濃縮液,備用。
1.3.2 單因素試驗
絲瓜皮超聲輔助法提取時,結合預試驗,將超聲提取的溫度、時間、乙醇濃度和料液比四個因素進行單因素試驗,提取溫度為20、30、40、50、60、70 ℃,提取時間為10、20、30、40、50、60 min,乙醇濃度為60%、65%、70%、75%、80%、85%,料液比(質量體積比)為1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g/mL),依次比較不同因素下各水平對絲瓜皮多酚得率的影響,以期獲得超聲輔助提取絲瓜皮多酚的最佳水平[10]。
1.3.3 絲瓜皮多酚提取的響應面優化試驗
為進一步研究各因素的交互作用對多酚提取率的影響,采用響應面分析法優化提取工藝[11]。基于Box-Behnken 試驗設計,選擇對多酚提取率有影響的4 個主要因素乙醇濃度、提取時間、料液比、提取溫度進行4 因素3 水平響應面分析試驗,響應面設計水平見表1[12]。
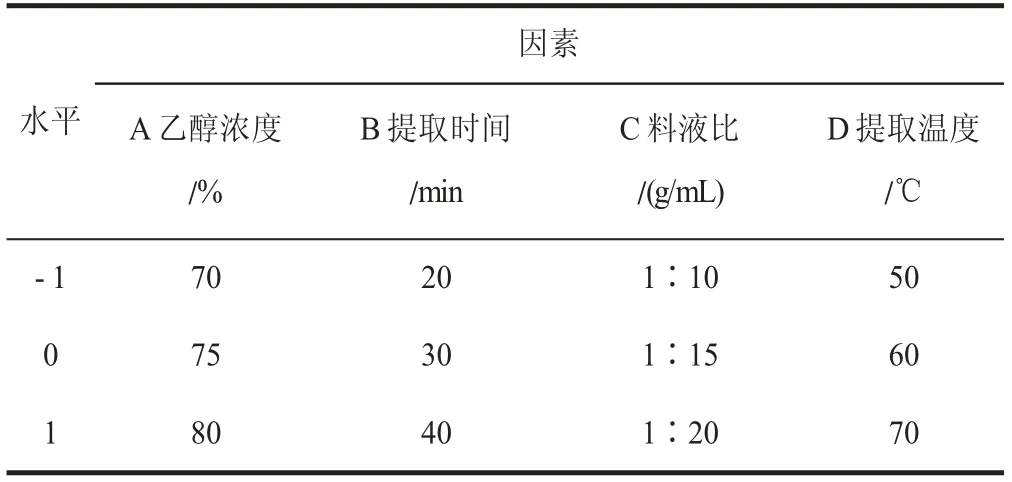
表1 響應面設計因素水平表Table 1 Factors and levels table of response surface design
1.3.4 絲瓜皮多酚得率的測定
將1.3.1 得到的絲瓜皮多酚濃縮液5.0 mL加入25.0 mL容量瓶中,加水定容,取0.5 mL 置入50 mL 比色皿中,隨后向比色皿中加入1.0 mL 福林酚試劑,振蕩,使溶液充分混勻,再加入2.0 mL 10%碳酸鈉溶液,振蕩,靜置1 h。最后測定溶液在760 nm 下的吸光度,根據公式(1)計算絲瓜皮多酚得率[13]。
式中,Y為絲瓜皮的多酚得率,mg/g;m為絲瓜皮質量,g;n 為稀釋倍數;V為被測液體積,mL;c為多酚濃度,mg/mL。
1.3.5 絲瓜皮多酚對DPPH 自由基的清除作用
在試管中分別滴加0.2、0.4、0.6、0.8、1.0 mg/mL 的提取液2 mL,再加入2.0 mL、0.2 mmol/L 的DPPH 溶液,充分震蕩,避光靜置30 min。以無水乙醇調零,在517 nm 波長下測得吸光度值;把DPPH 溶液換為無水乙醇,作為對照測其吸光度值;取相同體積DPPH 溶液和無水乙醇混合,測其吸光度值。按照上述步驟,將抗壞血酸作為參照物[14],測定其吸光度值。以上述操作平行3 次,取平均值。用公式(2)計算多酚對DPPH 自由基的清除率。
式中,A樣品為提取液和DPPH 溶液的吸光度值;A對照為提取液和無水乙醇的吸光度值;A空白為無水乙醇和DPPH 溶液的吸光度值。
1.3.6 絲瓜皮多酚對羥基自由基的清除作用
在試管中分別滴加0.2、0.4、0.6、0.8、1.0 mg/mL 提取液2 mL,再加入9 mmol/L FeSO4溶液和8.8 mmol/L H2O2溶液各2.0 mL,充分震蕩,靜置5 min 再加入9 mmol/L 水楊酸溶液2.0 mL,充分震蕩,放置于水浴鍋中37 ℃恒溫水浴30 min。以蒸餾水調零,在510 nm 波長下測得吸光度值;把過氧化氫溶液換為蒸餾水,作為對照測其吸光度值;將提取液替換成蒸餾水作為空白對照,測其吸光度值[15]。按照上述步驟,將抗壞血酸作為參照物,測定其吸光度值。以上述操作平行3 次,取平均值。根據公式(3)計算絲瓜皮多酚對羥基自由基的清除率。
式中,A樣品為提取液和H2O2溶液的吸光度值;A對照為提取液和蒸餾水的吸光度值;A空白為蒸餾水和H2O2溶液的吸光度值。
1.4 數據處理方法
使用Excel 2010 進行數據處理及作圖。
2 結果與分析
2.1 絲瓜皮多酚提取單因素試驗結果
2.1.1 料液比對絲瓜皮多酚得率的影響
由圖1 可知,隨著絲瓜皮多酚提取體系中溶劑量的增加,絲瓜皮多酚的得率呈現先升高后下降的趨勢,這可能是由于溶劑的增加,使絲瓜皮多酚與溶劑中多酚濃度差增大,促進多酚的溶出。但當料液比超過1∶15 后,隨著溶劑量的不斷增加,多酚在濃縮后處理過程中損失增加[14-15],使提取率下降。由此將料液比設定為1∶10~1∶20,作為后續響應面優化試驗的條件。
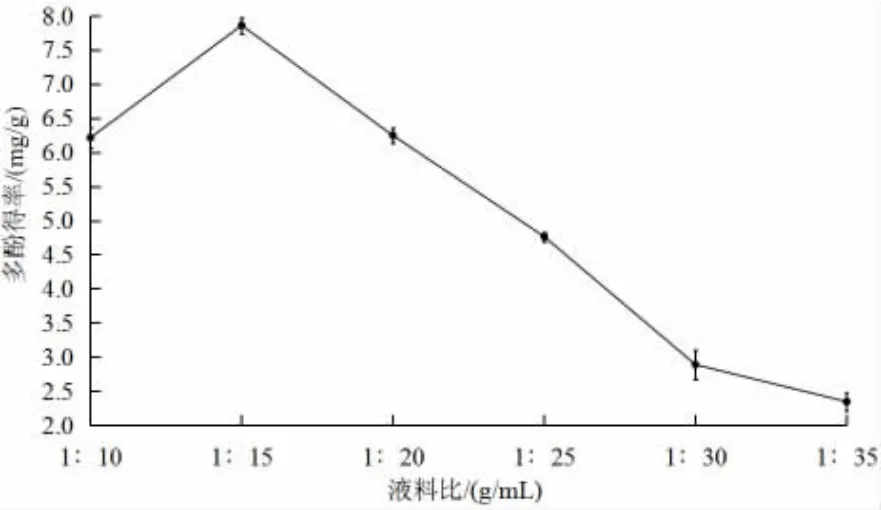
圖1 料液比對絲瓜皮多酚得率的影響Fig.1 Effect of material liquid ratio on the yield of polyphenols from luffa peels
2.1.2 乙醇濃度對絲瓜皮多酚得率的影響
如圖2所示,隨著乙醇濃度的增加,絲瓜皮多酚出現先增后減的趨勢。當乙醇濃度為60%~75%時,絲瓜皮多酚提取率呈明顯上升趨勢,在75%時達到最大值,這可能是由于乙醇濃度過低時,極性過強,導致糖類等水溶性物質浸出量增大;但在乙醇濃度為75%~85%時,得率逐漸降低,可能是乙醇濃度過高造成提取溶劑極性太低,導致蛋白質發生變性,使細胞壁結構變得致密,從而導致多酚不能溶出;另外多酚往往以氫鍵形式與其他成分結合,乙醇濃度過高,直接影響氫鍵的斷裂,使多酚提取得率下降[16]。因此,將乙醇濃度設定為70%~80%作為響應面優化試驗的條件。
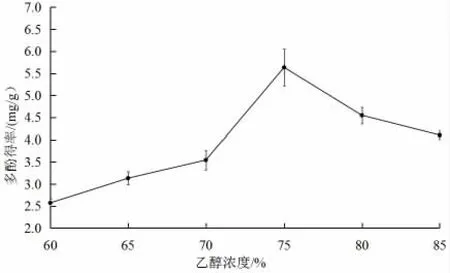
圖2 乙醇濃度對絲瓜皮多酚得率的影響Fig.2 Effect of ethanol concentration on polyphenol yield rate of luffa peels
2.1.3 提取時間對絲瓜皮多酚得率的影響
如圖3所示,當提取時間為10~30 min 時,絲瓜皮多酚得率隨提取時間增加而增加;當達到30 min 時,多酚得率達到最大值,為7.50 mg/g;提取時間達到30 min以后,多酚得率隨提取時間的增加而下降。可能的原因是多酚溶解于溶劑內需要時間,所以在30 min 之前,多酚得率呈上升趨勢;當達到30 min 臨界點時,多酚得率將不再增長,而且隨著提取時間延長,提取液中的多酚物質會發生氧化、聚合、分解等各種反應[17],從而使其含量有所下降。由此將提取時間設定為20~40 min 作為響應面優化試驗的條件。
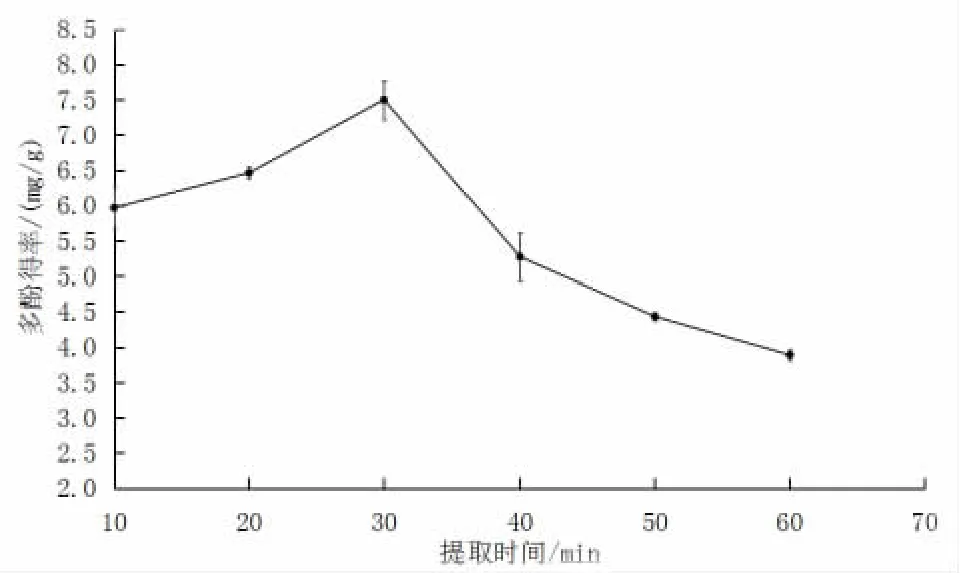
圖3 提取時間對絲瓜皮多酚得率的影響Fig.3 Effects of extraction time on the polyphenol yield rate of luffa peels
2.1.4 提取溫度對絲瓜皮多酚得率的影響
如圖4所示,當提取溫度在20~60 ℃時,絲瓜皮多酚得率隨提取溫度的升高而上升,當提取溫度達到60 ℃時,達到最大值,為6.08 mg/g。這是因為隨著提取溫度的升高,分子運動加劇,從而使多酚析出增加;但溫度超過60 ℃,過高的溫度使多酚的化學結構破壞,從而使多酚得率下降[17]。由此將提取時間設定為50~70 ℃作為響應面優化試驗的條件。
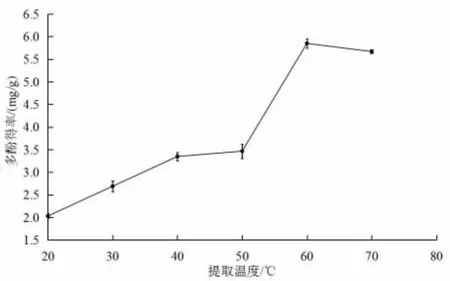
圖4 提取溫度對絲瓜皮多酚得率的影響Fig.4 Influence of extraction temperature on polyphenol yield rate of luffa peels
2.2 響應面試驗結果與分析
2.2.1 響應面試驗結果及方差分析
響應面試驗結果如表2(見下頁)所示,利用軟件Design- Expert 10.0.3 對數據進行解析[18],得到二次多項回歸方程:多酚提取率Y(%)=9.96+0.96A+0.87B+0.26C+109D+0 .37AB-0 .24AC+0 .30AD+0 .28BC-0.62BD+0.045CD-3.24A2-1.86B2-0.85C2-1.64D2。
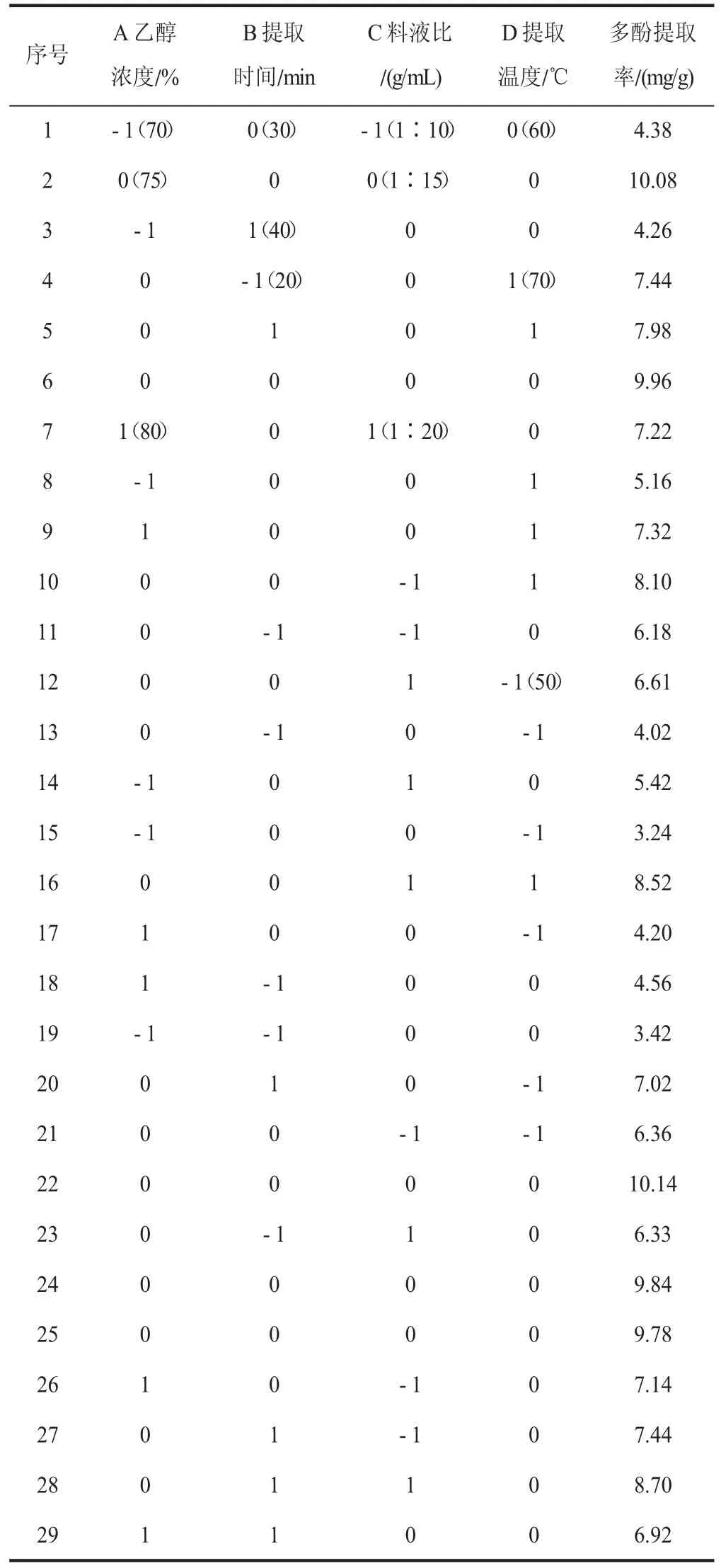
表2 試驗設計與結果Table 2 Test design and results
對模型進行回歸分析,其結果見表3,一次項A、B、C、D 對多酚提取率線性效應顯著(P<0.05),二次項A、B、C、D 對多酚提取率曲面效應顯著(P<0.05),AB、AD、BD 對多酚提取率交互效應顯著(P<0.05)。該模型的負相關系數R2=0.991 8,P<0.000 1,可以證明該模型達到極顯著水平,該模型失擬項不顯著(P>0.05),證明該模型可信,擬合度較高,可用于絲瓜皮超聲波輔助提取工藝的分析和優化。由F值可知,各因素對絲瓜皮多酚提取量的影響大小順序為提取溫度>乙醇濃度>提取時間>料液比。
2.2.2 因素間交互作用分析結果
由圖5(見53 頁)結合表3(見54 頁)可知,提取時間-乙醇濃度、乙醇濃度-提取溫度、乙醇濃度-料液比交互作用對絲瓜皮多酚提取率影響顯著(P<0.05),其他因素交互作用對絲瓜皮多酚提取率影響不顯著。
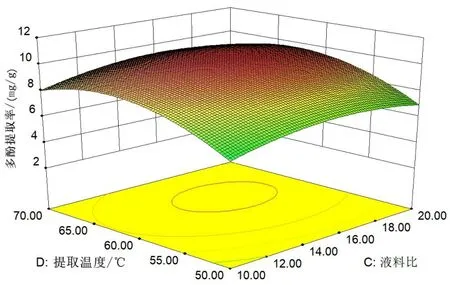
圖5 各因素的交互作用對多酚提取率的影響Fig.5 The influence of the interaction of various factors on the extraction rate of polyphenols
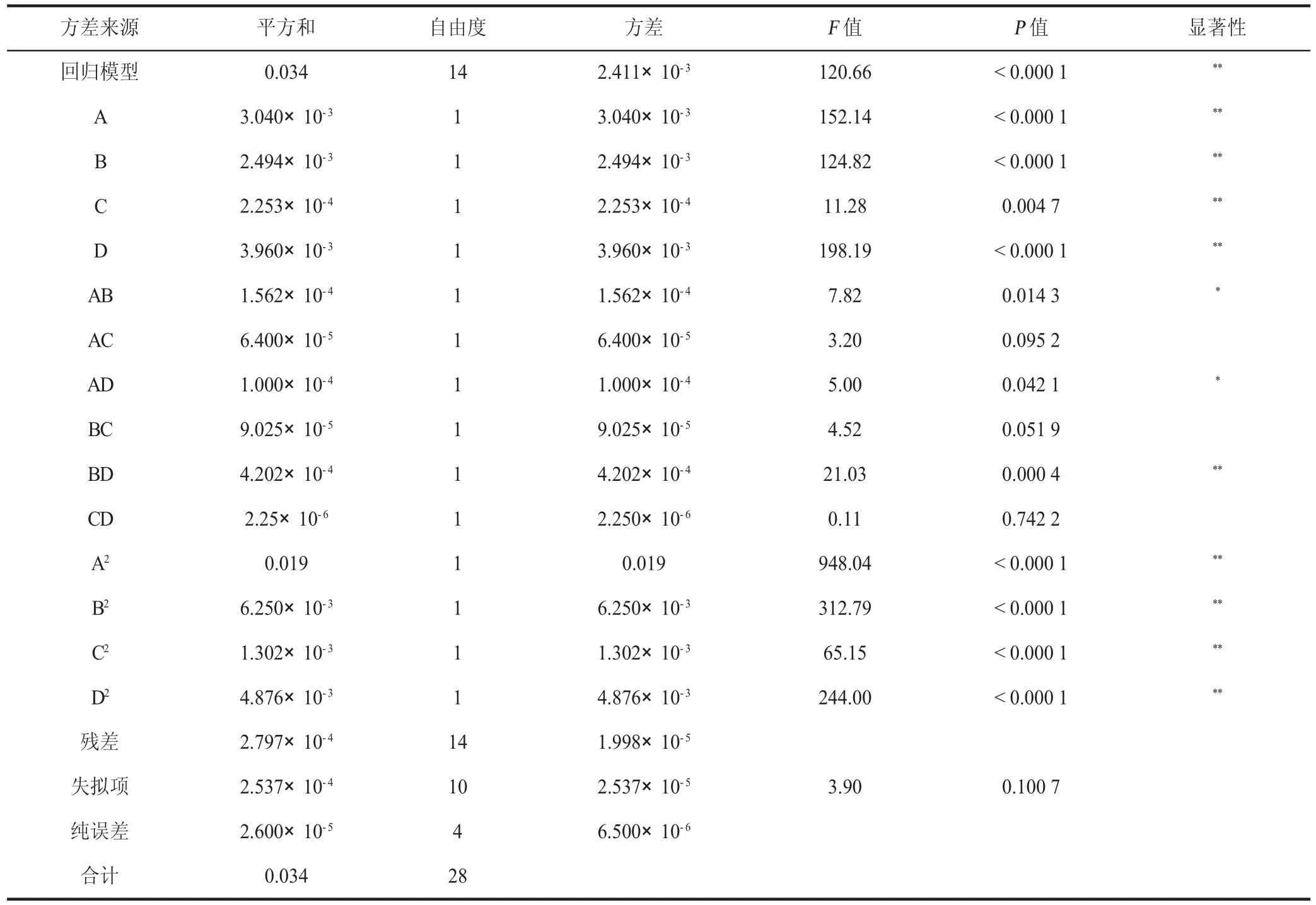
表3 絲瓜皮多酚提取率擬合回歸方程的方差分析結果Table 3 Variance analysis results of the Prate fit regression equation
2.2.3 最優工藝條件試驗驗證
多酚最優提取工藝為乙醇濃度76.02%、提取時間30.19 min、料液比1∶15.75(g/mL)、提取溫度62.62 ℃,在此條件下模型預測的多酚提取率為10.24 mg/g。
根據軟件預測結果,結合實際工藝設置的可行性,取乙醇濃度76%、提取時間30 min、料液比1∶16(g/mL)、提取溫度63 ℃為條件進行三次重復試驗,平均多酚提取率為10.13 mg/g,與模型預測結果接近,表明模型擬合效果良好,基于該響應面模型分析優化多酚提取率提取工藝的方法有效可行[19]。
2.3 絲瓜皮多酚溶液的抗氧化能力分析結果
2.3.1 絲瓜皮多酚對DPPH 自由基的清除效果
酚類化合物是果蔬中主要的抗氧化物質之一,DPPH自由基被廣泛應用于天然植物或化合物的抗氧化能力評價。如圖6(見53頁)所示,絲瓜皮多酚與VC在消除DPPH自由基方面效果相近,其清除率隨溶液濃度的增加而增加,呈現正相關。當絲瓜皮多酚濃度為0.6 mg/mL 時,對DPPH 自由基的清除率為92.8%,顯示絲瓜皮多酚對DPPH 自由基具有良好的清除效果。有研究表明胎菊多酚對DPPH 自由基的清除率為97.49%[20],與絲瓜皮多酚相當。
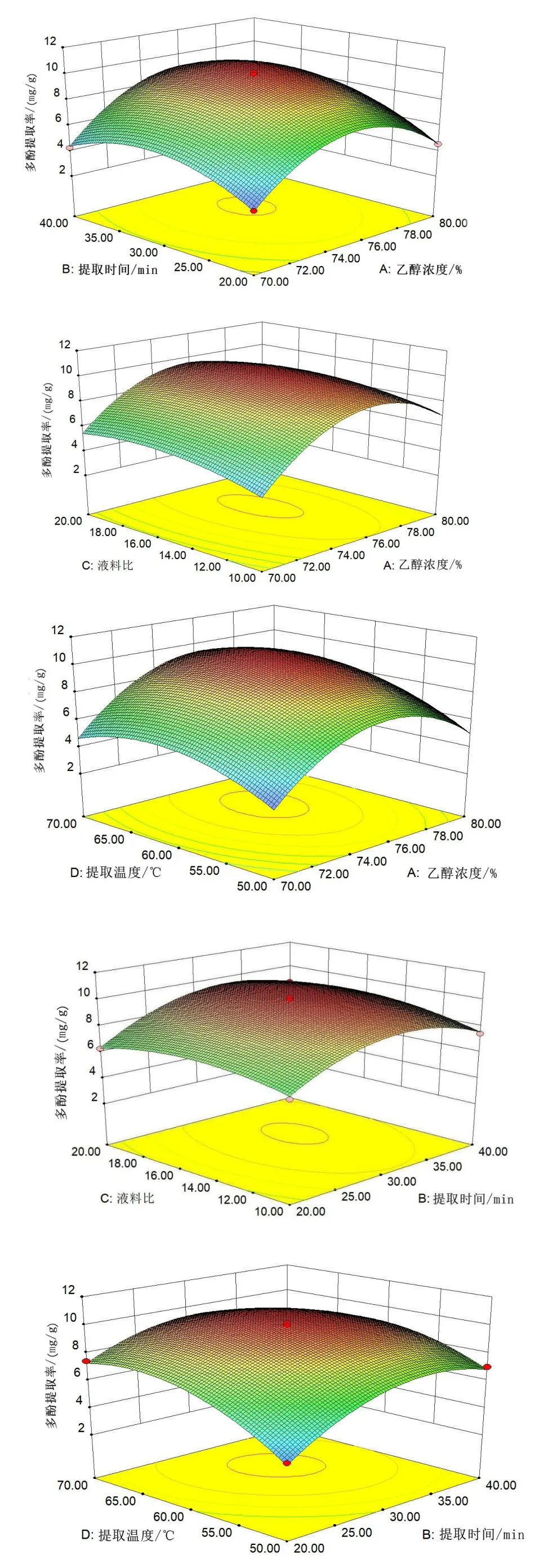
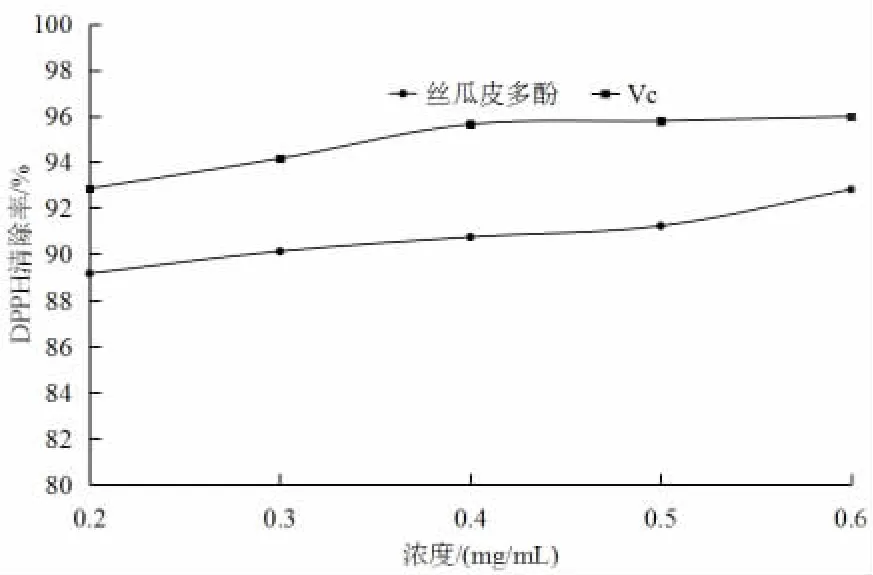
圖6 絲瓜皮多酚對DPPH 清除效果Fig.6 Effect of luffa peels on the effect of DPPH removal
2.3.2 絲瓜皮多酚對羥基自由基的清除效果
絲瓜皮多酚溶液與VC 溶液對羥基自由基清除效果如圖7所示,VC 與絲瓜皮多酚對羥基自由基具有清除效果,但通過數據對比發現,絲瓜皮多酚對羥基自由基的清除效果超過VC 對羥基自由基的效果。當絲瓜皮多酚濃度為0.6 mg/mL 時,對羥基自由基的清除率為88.17%。遠高于邵安冉等[20]報道的胎菊多酚26.42%的羥基自由基清除率,可見絲瓜皮多酚對羥基自由基具有較好的清除效果。
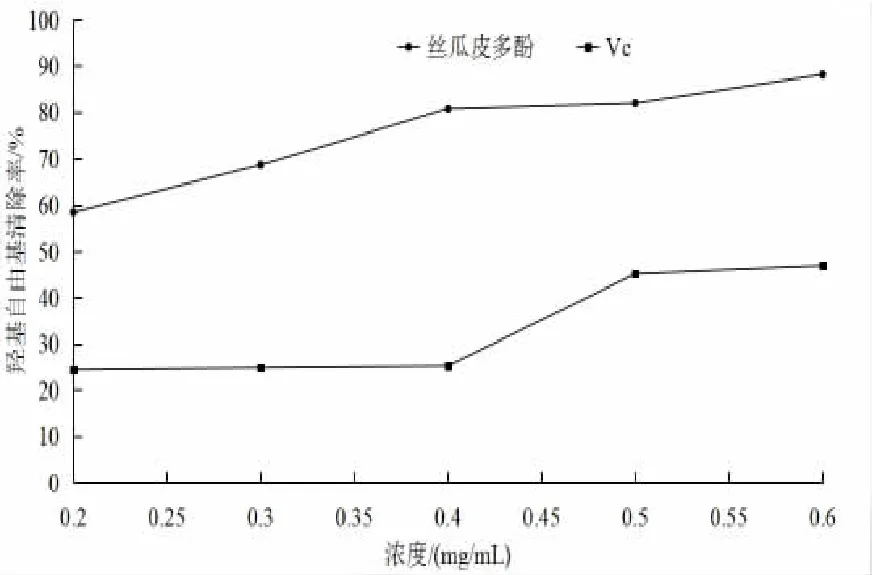
圖7 絲瓜皮多酚對羥基自由基清除效果Fig.7 Effect of luffa peels polyphenols on hydroxyfree radicals removal
3 結論
在構建資源節約型社會的進程中,農業生物廢棄物的再利用越來越受到人們的重視。本文以絲瓜食用后丟棄的絲瓜皮作為原料,采用超聲輔助乙醇提取的方法對絲瓜皮中的多酚進行提取,優化提取工藝參數,并對絲瓜皮多酚的抗氧化性進行了研究。得出絲瓜皮多酚超聲輔助提取的最佳工藝條件為乙醇濃度76%、提取時間30 min、料液比1∶16(g/mL)、提取溫度63 ℃。以此條件進行驗證實驗,得到絲瓜皮多酚得率為10.13 mg/g,與響應面模型預測值10.24 mg/g 相近。絲瓜皮多酚抗氧化性能研究發現,隨著絲瓜皮多酚濃度增大,絲瓜皮多酚對DPPH 和羥基自由基的清除率均不斷增加,絲瓜皮多酚濃度達到0.6 mg/mL 時,對DPPH 和羥基自由基的清除率分別為92.8%和88.17%,說明絲瓜皮多酚具有良好的抗氧化活性。絲瓜皮作為絲瓜烹飪或加工時產生的廢棄物,但其含有豐富的多酚成分,絲瓜皮多酚具有良好的抗氧化性,在食品加工以及化妝品行業有廣闊的應用前景,后續將對絲瓜皮多酚進一步純化并對其組分研究,為其進一步應用提供基礎。

