維持性血液透析患者血小板/淋巴細胞比值與左心室肥厚的相關性研究
卜 希,劉滄桑
(長沙市第四醫院,湖南 長沙 410006)
維持性血液透析(MHD)是終末期腎臟病(ESRD)患者最常見的腎臟替代治療方式。截至2020年12月底,我國大陸地區登記的血液透析患者達70 萬人。MHD患者的病死率高,比一般人群約高出十倍,心血管疾病是其主要并發癥和主要死因,約占總死亡人數的50%[1]。左心室肥厚是MHD患者最常見的心血管疾病,是心源性猝死的高風險因素,也是心血管病死亡的預測因子[2]。左心室肥厚(LVH)的發生和持續進展與不良心血管預后和生存預后有關。除慢性容量和壓力超負荷、神經激素激活、尿毒癥毒素蓄積、貧血、甲狀旁腺功能亢進、營養不良等原因外,炎癥也是左心室肥厚的重要原因[3-4]。血小板/淋巴細胞比值(PLR)是一種全身炎癥標志物,檢測方法簡捷,易動態監測,被證實能較好地反映機體炎癥狀態。PLR在心血管疾病中對疾病的發生或預后有獨特的預測作用[5]。
但在維持性血液透析患者中,PLR與LVH的相關性研究較少。本研究通過回顧性分析維持性血液透析患者的臨床資料,探討PLR對LVH的預測價值,報告如下。
1 資料與方法
1.1 一般資料
選擇我院2021年7月1日—2022年1月1日維持性血液透析患者105 例,根據左心室質量指數(LVMI)分為LVH組[75 例(71.43%)]和非LVH組[30 例(28.57%)]。
1.2 納入和排除標準
納入標準:年齡≥18 歲、透析齡≥3 個月、規律血液透析每周2~3次(每次4 h)且臨床資料完整的患者。排除標準:合并腹膜透析的患者;腎移植患者;合并感染患者;合并急性心腦血管事件、惡性腫瘤、嚴重血液病患者;其他引起淋巴細胞減少的原因,如使用皮質類固醇,HIV感染,營養不良,系統性紅斑狼瘡,類風濕性關節炎,結節病,細胞毒性劑,免疫抑制藥物。
1.3 研究方法
LVH的評定根據《亞洲高血壓合并左心室肥厚診治專家共識》[6],即LVMI男性≥115 g/m2、女性≥95 g/m2。研究期間由超聲專科醫生完善心臟超聲檢查,測定左室舒張末期內徑(LVEDD)、室間隔厚度(IVST)及左室后壁厚度(LVPWT)。LVMI(g/m2)=左心室質量/體表面積;左心室質量(g)=0.8×1.04×[(LVEDD+IVST+LVPWT)3-LVEDD3]+0.6;體表面積(m2)=0.005 7×身高(cm)+0.012 1×體質量(kg)+0.088 2(男性);體表面積(m2)=0.007 3×身高(cm)+0.012 7×體質量(kg)-0.210 6(女性)。
1.4 觀察指標
收集患者一般資料,包括年齡、性別、身高、體質量、透析血管通路、腎臟原發病類型(如高血壓腎損害、糖尿病腎病、慢性腎小球腎炎、多囊腎等)和透析齡等。收集透析前實驗室檢查結果,包括白細胞計數、淋巴細胞計數、血紅蛋白、血小板計數、超敏C反應蛋白(hs-CRP)、血清鈣、血清磷、血清白蛋白、血肌酐、血尿素氮、血尿酸、全段甲狀旁腺素(iPTH)等,根據血小板計數與淋巴細胞計數計算PLR。收集患者透析的相關資料,計算尿素下降率(URR)、尿素清除指數(Kt/V)。計算公式:URR=(透析前尿素濃度-透析后尿素濃度)/透析前尿素濃度;Kt/V=-ln(R-0.03)+(4-3.5×R)×UF/W,其中R為透析前后尿素比率,UF為透析超濾量,W為透析后體質量。
1.5 統計學方法
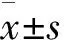
2 結 果
2.1 MHD患者的一般資料
共入選105 例MHD患者,其中男62 例,女43 例;年齡(63.02±12.55) 歲;長期中心靜脈置管16 例,自體內瘺89 例;透析齡14.00(7.00,36.50) 個月;LVMI為(116.50±16.38) g/m2;PLR為191.51(135.72,300.06);腎臟原發病來源:高血壓腎損害19 例,糖尿病腎病39 例,慢性腎小球腎炎41 例,腎病綜合征1 例,梗阻性腎病2 例,多囊腎1 例,其他2 例。
2.2 兩組臨床資料比較
105 例MHD患者中,LVH組75 例,非LVH組30 例。兩組血紅蛋白、血小板計數、PLR和hs-CRP及LVMI比較,差異有統計學意義(P<0.05);兩組年齡、男性比例、體質量指數、長期中心靜脈置管例數、白細胞計數、淋巴細胞計數、血清鈣、血清磷、血清白蛋白、血肌酐、血尿素氮、血尿酸、iPTH和URR及Kt/V比較,差異無統計學意義(見表1)。

表1 兩組臨床資料比較
2.3 PLR與臨床指標的相關性分析
通過Spearman相關性分析比較PLR與各個臨床指標的相關性。PLR與超敏C反應蛋白(r=0.372,P<0.001)和LVMI(r=0.258,P=0.008)呈正相關;與年齡、男性比例、體質量指數、白細胞計數、血紅蛋白、血清鈣、血清磷、血清白蛋白、血肌酐、血尿素氮、血尿酸、iPTH和URR及Kt/V等無相關性(見表2)。

表2 PLR與臨床指標的相關性
2.4 影響MHD患者并發LVH的因素
以是否LVH為因變量,以單因素分析中有統計學意義的指標為自變量,其中取PLR的中位數191.51進行二分類,將PLR作為分類變量,然后采用條件法建立二元Logistic回歸分析結果顯示PLR≥191.51和血紅蛋白是MHD患者并發LVH的獨立危險因素(見表3)。

表3 影響MHD患者并發LVH的二元Logistic回歸分析
3 討 論
LVH是MHD患者常見和嚴重的心血管并發癥,嚴重影響患者預后,是心血管患者死亡的獨立危險因素。據報道[7],在ESRD患者中LVH的患病率可高達71%~89%,并且隨著透析時間的延長,LVH的風險逐漸增加。本研究中MHD患者的LVH發病率為71.43%,與以前的報道[8]基本一致。盡管對LVH的研究在不斷進展,但臨床上仍缺乏早期預測LVH的敏感、特異的生物學標志物,造成確診延誤,給患者和社會造成沉重的經濟負擔,因此研究早期識別MHD患者發生LVH的生物學標志物,對降低心血管事件病死率有重要臨床意義。
PLR是一種新型的炎癥標志物,被多項研究證實是可用于評估全身炎癥狀態的指標。多項研究表明[9],PLR對心血管疾病的發生或預后有獨特的預測作用。Zhang等[10]的研究證實PLR是預測血液透析患者全因死亡、心血管死亡的廉價且可靠的生物標志物。在腹膜透析中,高PLR可用于預測持續不臥床腹膜透析患者發生心血管事件的風險,也被證實與患者發生LVH具有相關性,是LVH發生的獨立影響因素[11]。PLR與心血管疾病的發展及預后密切相關,但在血液透析中其與LVH的關系研究較少。本研究中,LVH組PLR和hs-CRP顯著高于非LVH組,且PLR是預測LVH的獨立危險因素。
目前我們對MHD患者發生LVH的病理生理學認識尚不完全。研究認為[12],LVH的發病機制由多因素造成,除傳統認為的腎素-血管緊張素系統的激活、一氧化氮合成的抑制、血管內容量擴張、骨骼和礦物質代謝紊亂、繼發性貧血和動靜脈內瘺的存在外都可能導致左心室肥厚甚至左心室纖維化;另一方面,尿毒癥患者中的慢性炎癥、氧化應激和內皮功能障礙加速動脈粥樣硬化和心臟損傷,在左心室肥大的發展中也起著至關重要的作用。炎癥因子和氧化應激通過誘導趨化因子表達,引起炎性細胞的聚集和浸潤產生炎性損傷,從而影響心血管內皮功能,增加血流動力學負荷,使心室壁壓力增加,還直接導致細胞增殖、凋亡,調節細胞外間質的合成和降解,長期受累導致不可逆的心肌損傷,促進LVH的發生[13]。臨床研究中也發現炎癥標志物如hs-CRP、腫瘤壞死因子-α(TNF-α)和白介素-6(IL-6)的濃度與LVMI相關,微炎癥狀態與MHD患者心臟的結構和功能障礙密切相關[14]。在本研究中PLR與hs-CRP和LVMI呈正相關,進一步驗證炎癥在LVH中的重要作用。
我們還發現貧血是MHD患者并發LVH的獨立危險因素。MHD患者普遍存在一定的貧血,血液中血紅蛋白攜氧量減少,加重心肌缺血,心臟通過增加心排血量以維持機體正常的氧供需求,同時機體產生各種代謝產物導致血管擴張、心臟前負荷增加,進而逐漸發生左心室結構變化、容積增大、后壁厚度增加,導致LVH的形成。因此,對于MHD患者需積極糾正貧血,延緩LVH的進程,對預后改善有一定價值。
本研究具有一定的局限性:一是本研究為單中心回顧性研究,樣本例數有限,需要更大樣本、多中心、隨機對照研究來進一步驗證;二是由于經濟原因,未納入其他炎癥指標(如IL-6,IL-11和TNF-α等)一同研究。
綜上所述,PLR是一種簡單的炎癥標志物,廉價易得,檢測方法簡捷,便于動態監測。本研究顯示其升高是MHD患者并發LVH的獨立危險因素,可用于對MHD患者進行LVH危險分層的一個簡單快捷的工具,臨床工作中應重視PLR升高的MHD患者,從而及早采取預防措施。

