胎鼠真皮間充質干細胞對小鼠巨噬細胞極化的影響
夏震宇 龔思宇 王曉川 姜篤銀 單菲 趙潔
[摘要]目的:探究胎鼠真皮間充質干細胞(Fetal mice dermal mesenchymal stem cells, FDMSCs)對M1/2型巨噬細胞極化的影響。方法:本研究提取FDMSCs,利用脂多糖(Lipopolysaccharide,LPS)、γ干擾素(Interferon-γ,IFN-γ)刺激RAW 264.7誘導為M1型巨噬細胞,利用白細胞介素4(Interleukin-4,IL-4)刺激RAW264.7誘導為M2型巨噬細胞,并建立了FDMSCs-RAW 264.7共培養體系。共培養24 h后,收集巨噬細胞,用實時定量PCR和流式細胞學檢測M1/2型巨噬細胞特征性因子白細胞介素6(Interleukin-6,IL-6)、誘導性一氧化氮合酶(Inducible nitric oxide synthase,iNOS)、CD86、白細胞介素10(Interleukin-10,IL-10)、精氨酸酶1(Arg-1)、CD206的表達變化。結果:FDMSCs使M1型巨噬細胞表達的IL-6、iNOS、CD86減少,IL-10、CD206增多;使M2型巨噬細胞表達的IL-10、Arg-1、CD206表達增多,iNOS表達減少。結論:FDMSCs可以通過調控巨噬細胞極化來調控傷口愈合,對于探索FDMSCs在創面治療過程中的免疫調節機制有積極意義。
[關鍵詞]胎鼠;真皮間充質干細胞;巨噬細胞極化;M1/M2亞型;創面愈合;共培養
[中圖分類號]R751? ? [文獻標志碼]A? ? [文章編號]1008-6455(2023)09-0058-03
Effect of Fetal Dermal Mesenchymal Stem Cells on Mouse Macrophage Polarization
XIA Zhenyu1,GONG Siyu2,WANG Xiaochuan3,JIANG Duyin1,3,4,SHAN Fei4,ZHAO Jie4
(1.Cheeloo College of Medicine,Shandong University,Jinan 250012,School of Basic Medicine,Jining Medical College,Jining 272067,Shandong,China; 3.Department of Burns and Plastic Surgery,the Second Hospital of Shandong University,Jinan 250033,Shandong,China; 4.Department of Emergency,the Second Hospital of Shandong University,Jinan 250033,Shandong,China)
Abstract: Objective? To investigate the effect of FDMSCs on the polarisation of M1/2 type macrophages. Methods? In this study, RAW264.7 was induced into M1-type macrophages by stimulation with lipopolysaccharide (LPS) and gamma interferon (IFN-γ) and into M2-type macrophages by stimulation with interleukin 4 (IL-4), and a FDMSCs-RAW264.7 co-culture system was established. After 24 hours of co-culture, macrophages were harvested and changes in the expression of the characteristic factors interleukin 6 (IL-6), inducible nitric oxide synthase (iNOS), CD86, interleukin 10 (IL-10), arginase 1 (Arg-1) and CD206 in M1/2 type macrophages were detected by qRT-PCR and flow cytometry. Results? FDMSCs decreased the expression of IL-6, iNOS and CD86 and increased the expression of IL-10 and CD206 in M1 macrophages; increased the expression of IL-10, Arg-1 and CD206 and decreased the expression of iNOS in M2 macrophages. Conclusion? FDMSCs can regulate wound healing by modulating macrophage polarisation, which has positive implications for exploring the immunomodulatory mechanisms of FDMSCs in the process of wound treatment.
Key words: fetal mice; dermal mesenchymal stem cells; macrophage polarization; M1/M2 macrophage wound healing; coculture
間充質干細胞(Mesenchymal stem cells,MSCs)是一種具有多向分化能力和自我更新能力的祖細胞,可以從骨髓、脂肪、臍帶血等多種組織中分離得到[1]。大量研究表明,MSCs具有強大的修復能力,既可以遷移至受損部位,通過自身的分化能力修復損傷;又可以通過釋放參與創面愈合的細胞因子、趨化因子、生長因子等協助修復[1]。除分化功能外,MSCs還具有免疫調節功能,特別是對巨噬細胞表型和功能的調控。因此,MSCs成為治療創面不良愈合、自身免疫和炎癥相關疾病的潛在工具[2]。FDMSCs是從孕15 d胎鼠真皮組織中提取的一種間充質干細胞,與其他成人間充質干細胞相比,具有更強的多向分化能力和更低的免疫原性,并且與胎兒期皮膚的無瘢痕愈合密切相關。課題組前期研究結果證實FDMSCs在促進創面愈合,血管再生方面都發揮著顯著作用[3]。但有關FDMSCs在免疫調控方面的作用尚未見探索。巨噬細胞作為人體免疫細胞的重要組成部分,在傷口愈合的炎癥、增殖和重塑期都發揮著關鍵作用,這種作用是通過由炎癥型M1型巨噬細胞至抗炎型M2型巨噬細胞的表型轉換實現的[4]。在一些難以愈合的慢性傷口中,M1型巨噬細胞群占據優勢,導致創面長期處于炎癥期,進而影響組織修復與重塑[5]。本次實驗擬探究FDMSCs對巨噬細胞極化的調控作用以及對創面愈合的影響,對于進一步探索FDMSCs在創面治療中的作用有著積極意義。
1? 材料和方法
1.1 細胞提取和培養:FDMSCs提取自孕15 d BAL B/C小鼠背部真皮。孕鼠購自濟南朋悅實驗動物繁育有限公司。孕鼠購回后,按手術無菌操作取出胎鼠并切取背部皮膚。先用中性蛋白酶分離表皮與真皮,后用Ⅰ型膠原酶消化真皮組織,用70μm濾網濾出FDMSCs,與含有10%FBS的DMEM低糖培養基于5% CO2、37℃培養箱進行傳代培養。RAW264.7(蘇州海星生物公司)培養采用高糖DMEM培養基。傳代培養3次后取對數生長期的細胞用于試驗。
1.2 培養細胞鑒定
1.2.1 FDMSCs:課題組早期已完成FDMSCs的提取及鑒定,本次FDMSCs的提取與前期研究步驟相同[6]。
1.2.2 巨噬細胞:RAW 264.7為小鼠單核巨噬細胞白血病細胞,源自BAL B/c小鼠由Abelson鼠科白血病病毒誘導的腫瘤。購回后按常規方法,分別使用LPS、IFN-γ與IL-4將RAW 264.7誘導為M1,M2型巨噬細胞[7-8]。
1.3 FDMSCs與M1/M2型巨噬細胞共培養:使用0.4 μm小孔的transwell小室進行共培養實驗。M1/2型巨噬細胞接種于下室,FDMSCs接種于上室。檢測前共培養24 h。
1.4 流式細胞術:流式細胞術檢測FDMSCs與RAW264.7的表面標志物。收集5×105個細胞并用PBS緩沖液重新懸浮,在黑暗中與特異性抗體孵育15 min。之后用PBS緩沖液洗滌細胞,并用流式細胞儀進行檢測。
1.5 實時定量PCR:按試劑盒說明書要求從細胞中提取RNA并逆轉錄成cDNA,用SYBR Green探針檢測mRNA的相對表達。通過ΔΔCt的方法計算mRNA表達。
1.6 統計學分析:使用GraphPad Prism 8進行統計分析。對每個結果進行3次或多次獨立實驗,并計算平均值和標準差,行單因素方差分析或t檢驗。P<0.05為差異具有統計學意義。
2? 結果
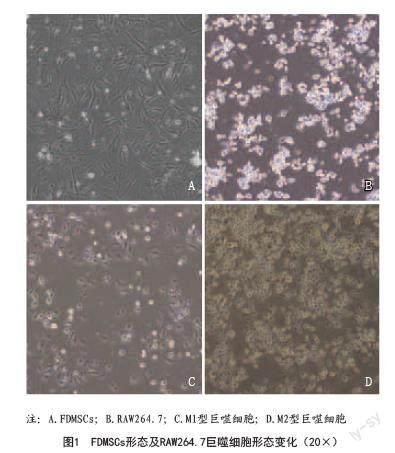
2.1 細胞形態學觀察:提取的FDMSCs貼壁生長,細胞細長,呈現梭形或紡錘形(見圖1A)。巨噬細胞RAW 264.7購回后,細胞貼壁生長,呈小卵圓形,折光性強,呈團簇狀生長(見圖1B)。用LPS和IFN-γ將RAW 264.7極化為M1表型。M1型巨噬細胞伸出特征性的偽足,呈棒狀和放射狀,細胞折光性減弱(見圖1C);用IL-4將巨噬細胞極化為M2表型,M2型巨噬細胞體積增大呈橢圓形,胞質豐富(見圖1D)。
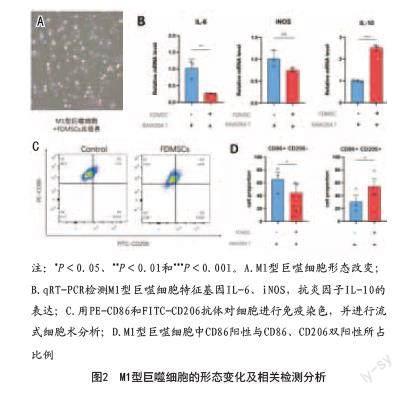
2.2 FDMSCs促進RAW 264.7由M1型向M2型轉換:將FDMSCs與M1型巨噬細胞共培養24 h后,放射狀、棒狀巨噬細胞明顯減少,細胞變圓,胞質增多(見圖2A)。隨后應用熒光定量PCR檢測M1型巨噬細胞的特征促炎因子iNOS和IL-6的基因表達。結果表明,與對照組相比,與FDMSCs共培養的M1型巨噬細胞特征性因子iNOS與IL-6表達均顯著降低,抗炎細胞因子IL-10升高(見圖2B)。最后,使用流式細胞術檢測CD86和CD206兩種細胞標記物,結果顯示代表M1極化水平的CD86表達降低,代表M2極化水平的CD206表達升高(見圖2C、D)。以上實驗結果表明,FDMSCs可以降低M1型巨噬細胞的極化水平,降低促炎因子IL-6和iNOS的表達水平,從而使巨噬細胞調控的炎癥反應水平下降;同時FDMSCs可以促進IL-10表達水平的升高,促進M1型巨噬細胞向M2型的表型轉換。
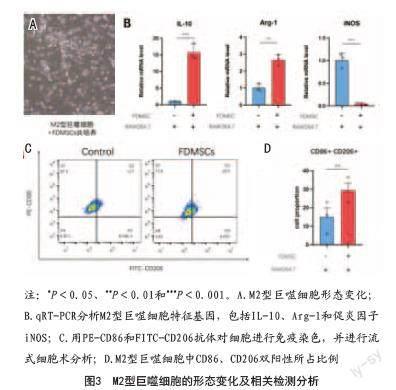
2.3 FDMSCs使M2型巨噬細胞進一步活化:將FDMSCs與M2型巨噬細胞共培養24 h后,M2型巨噬細胞形態變化不明顯(見圖3A)。隨后,通過熒光定量PCR檢測代表M2型巨噬細胞極化水平的特征性細胞因子IL-10和Arg-1,與對照組相比,FDMSCs干預后的M2型巨噬細胞IL-10和Arg-1的基因表達升高(見圖3B)。最后,使用流式細胞術檢測CD86和CD206兩種細胞標記物,結果顯示,相較于對照組,實驗組中CD86表達降低,CD206表達升高(見圖3C、D)。以上實驗結果表明,FDMSCs可以增強M2型巨噬細胞的極化,增加M2型巨噬細胞特征性細胞因子IL-10和Arg-1的基因表達,進一步增強M2型巨噬細胞的抗炎作用。
3? 討論
在傷口愈合初期,具有促炎表型的(M1型)巨噬細胞表達高水平的CD86和PD-L1,分泌iNOS、TNF-α、IL-1β、IL-6等多種炎癥介質參與炎癥反應。隨著組織修復階段的開始,巨噬細胞群轉換為抗炎表型(M2)型,表達高水平的CD206、Arg-1、FIZZ1,分泌TGF-β、IL-1受體拮抗IL-10等抗炎細胞因子[10]。在組織重塑階段,巨噬細胞還可以釋放基質金屬蛋白酶(MMPs)以分解臨時細胞外基質,并在成纖維細胞的參與下共同推動基質的重塑和膠原沉積,這一過程在傷口閉合后還會持續一段時間[9]。在愈合過程中,MSCs與巨噬細胞共同定位于傷口附近,并將巨噬細胞極化為M2表型,從而發揮促進創面愈合的作用。例如骨髓間充質干細胞,可以通過減少炎癥細胞的浸潤,減少IL-6和TNF-α的表達,增加IL-10的表達,以達到促進創面愈合的效果。有研究證實了MSCs通過調控巨噬細胞的極化,在心肌修復和減輕急性腎損傷后的纖維化都發揮著關鍵作用[11-12]。
作為一種從胎鼠真皮中提取的間充質干細胞,FDMSCs具有較低的免疫原性和較好的生物相容性;其來源于真皮,在皮膚創面修復過程中可能更好的發揮原位作用;還是參與無瘢痕愈合的關鍵細胞。前期研究結果已證實了FDMSCs在血管再生、創面修復、治療瘢痕疙瘩方面都有著積極作用。然而,FDMSCs對于巨噬細胞的免疫調控作用還沒有相關研究。
本研究利用Transwell共培養體系,通過熒光定量PCR和流式細胞學檢測,發現在FDMSCs干預下,M1型巨噬細胞特征性因子IL-6和iNOS表達降低,M2型巨噬細胞特征性因子IL-10和Arg-1表達升高;M1/2型巨噬細胞表面標記物CD86表達降低,CD206表達升高。實驗結果表明FDMSCs在誘導巨噬細胞極化方面可以促進M1型巨噬細胞向M2型轉換,并使M2型巨噬細胞進一步活化,從而在傷口愈合早期發揮對炎癥的抑制作用以及后期促進組織修復的作用,為進一步研究FDMSCs通過對巨噬細胞的免疫調節進行創面治療奠定了基礎。
[參考文獻]
[1]Uccelli A,Moretta L,Pistoia V.Mesenchymal stem cells in health and disease[J].Nat Rev Immunol,2008,8(9):726-736.
[2]Zheng G,Ge M,Qiu G,et al.Mesenchymal stromal cells affect disease outcomes via macrophage polarization[J].Stem Cells Int,2015,2015:989473.
[3]Pan Y,Jiang D Y.Research advances on the application of fetal dermal mesenchymal stem cells in burn wound treatment[J]Zhonghua Shao Shang Za Zhi,2021,37(1):86-89.
[4]Mosser D M,Edwards J P.Exploring the full spectrum of macrophage activation[J].Nat Rev Immunol,2008,8(12):958-969.
[5]Zhao R,Liang H,Clarke E,et al.Inflammation in chronic wounds[J].Int J Mol Sci,2016,17(12):2085.
[6]Jiao Y,Wang X,Zhang J,et al.Inhibiting function of human fetal dermal mesenchymal stem cells on bioactivities of keloid fibroblasts[J].Stem Cell Res Ther,2017,8(1):170.
[7]Ti D,Hao H,Tong C,et al.LPS-preconditioned mesenchymal stromal cells modify macrophage polarization for resolution of chronic inflammation via exosome-shuttled let-7b[J].J Transl Med,2015,13:308.
[8]Gao S,Mao F,Zhang B,et al.Mouse bone marrow-derived mesenchymal stem cells induce macrophage M2 polarization through the nuclear factor-κB and signal transducer and activator of transcription 3 pathways[J].Exp Biol Med (Maywood),2014,239(3):366-375.
[9]Wynn T A,Vannella K M.Macrophages in tissue repair, regeneration, and fibrosis[J].Immunity,2016,44(3):450-462.
[10]Murray P J.Macrophage polarization[J].Annu Rev Physiol,2017,79:
541-566.
[11]Wang M,Zhang G,Wang Y,et al.Crosstalk of mesenchymal stem cells and macrophages promotes cardiac muscle repair[J].Int J Biochem Cell Biol,2015,58:53-61.
[12]Wise A F,Williams T M,Kiewiet M B,et al.Human mesenchymal stem cells alter macrophage phenotype and promote regeneration via homing to the kidney following ischemia-reperfusion injury[J].Am J Physiol Renal Physiol,2014,306(10):F1222-1235.
[收稿日期]2023-02-21
本文引用格式:夏震宇,龔思宇,王曉川,等.胎鼠真皮間充質干細胞對小鼠巨噬細胞極化的影響[J].中國美容醫學,2023,32(9):58-60,77.

