加味肝豆湯聯合二巰丙磺鈉驅銅治療對濕熱內蘊型病脂質代謝和膽汁酸的影響
王 飛,汪美霞,陶 莊,蔣真真
(1.安徽中醫藥大學,安徽 合肥 230012;2.安徽中醫藥大學第一附屬醫院,安徽 合肥 230031)
肝豆狀核變性(hepatolenticular degeneration,HLD)又稱Wilson病(Wilson’s disease,WD),是由編碼銅轉運ATP7B基因突變導致ATP酶功能減弱或消失引起的常染色體隱性遺傳病[1]。臨床上可見血清銅藍蛋白(ceruloplasmin,CP)合成減少以及膽道排銅障礙,蓄積在體內的銅離子在肝、腦、腎、角膜等處沉積。根據WD臨床表現的不同,將其劃分為肝型、腦型及肝腦型[2-3]。世界范圍內WD的發病率約為1/30 000,致病基因攜帶者約為1/90[4]。脂質代謝異常為WD常見臨床癥狀之一,當肝臟脂質代謝網絡調控發生紊亂,游離脂肪酸、游離膽固醇等在肝臟中積累,引起細胞器功能障礙甚至細胞死亡,長期的損傷修復過程會導致肝臟纖維組織彌漫性增生,最終導致肝硬化,肝硬化的發生概率隨著病程的延長增加[5]。肝臟是膽汁酸(bile acid,BA)合成和再循環的重要場所,肝功能受損時,膽汁在肝臟淤積,進而影響糖脂代謝、能量消耗等環節[6]。肝豆湯是安徽中醫藥大學第一附屬醫院經臨床實踐研制的用于治療濕熱內蘊型WD的有效方劑,具有清熱解毒、通腑利尿之功,加味肝豆湯是國醫大師韓明向在肝豆湯的基礎上加茵陳、郁金而成的驗方。目前,關于WD伴脂質代謝紊亂的研究國內外少有報道。本研究旨在觀察加味肝豆湯聯合二巰丙磺鈉(sodium dimercaptosulphonate,DMPS)驅銅治療對濕熱內蘊型WD患者脂質和膽汁酸代謝紊亂的臨床療效。
1 臨床資料
1.1 診斷標準
1.1.1 WD診斷標準 參照《肝豆狀核變性診療指南(2022年版)》[7]制定WD的診斷標準:①存在原因不明的精神神經癥狀和(或)肝病表現;②CP<0.2 g/L,和(或)24 h尿銅排出量>100 μg,或肝銅含量>250 μg/g;③角膜K-F色素環陽性;④父母近親婚配,同胞中有確診WD患者或死于原因不明的肝病者。符合①②的同時符合③或④即可明確診斷。
1.1.2 濕熱內蘊證診斷標準 參考《中藥新藥臨床研究指導原則》[8]制定濕熱內蘊證診斷標準:主癥包括肢體拘攣、言語含糊、脘腹脹滿、納食不香等次癥包括面色晦暗、頭昏目眩、黃疸水臌、口苦或臭、尿赤便結等;舌紅或偏紅,苔黃膩,脈弦滑數。
1.1.3 高脂血癥診斷標準 參照《中國成人血脂異常防治指南(2016年修訂版)》[9]制定高脂血癥診斷標準:總膽固醇(total cholesterol,TC)≥5.18 mmol/L,三酰甘油(triglyceride,TG)≥1.70 mmol/L,高密度脂蛋白膽固醇(high-density lipoprotein-cholesterol,HDL-C)<1.04 mmol/L,低密度脂蛋白膽固醇(low-density lipoprotein-cholesterol,LDL-C)>3.37 mmol/L,≥1項指標異常者即可診斷為高脂血癥。
1.2 納入標準 ①符合WD診斷標準;②符合濕熱內蘊證診斷標準;③符合高脂血癥診斷標準;④年齡為12~30歲;⑤患者或其監護人均自愿簽署知情同意書。
1.3 排除標準 ①既往有肝膽手術史者;②合并有心腦血管、消化系統、腎臟等嚴重損害者;③合并有病毒性、藥物性、酒精性、自身免疫性肝臟損害及其他不明因素引起的肝臟損害者;④精神異常不能配合者;⑤服用其他中藥或其他生物制劑者。
1.4 一般資料 收集安徽中醫藥大學第一附屬醫院腦病中心2021年9月至2022年11月住院的WD患者60例,按隨機數字表法將其分為對照組和治療組,每組30例。治療組:男13例,女17例;年齡14~28歲,平均年齡(21.45±3.56)歲;病程3~7年,平均病程(4.69±1.25)年;統一Wilson病評定量表(unified Wilson’s disease rating scale,UWDRS)平均評分(48.33±8.78)分。對照組:男15例,女15例;年齡13~29歲,平均年齡(21.87±4.02)歲;病程2~6.5年,平均病程(4.98±1.78)年;UWDRS平均評分(48.45±9.11)分。兩組患者性別、年齡、病程、UWDRS評分比較,差異均無統計學意義(P>0.05),具有可比性。本研究經安徽中醫藥大學第一附屬醫院倫理委員會批準及審核(倫理審查編號:2021MCZQ07)。
2 方法
2.1 治療方法 兩組患者均接受低銅、低脂、高蛋白飲食。對照組予以驅銅治療,按照20 mg/kg緩慢靜脈滴注DMPS(上海禾豐制藥有限公司,國藥準字H31021514),每日1次,靜脈滴注6 d后,間歇2 d;予以10%葡萄糖酸鈣20 mL靜脈滴注,每日1次,共4個療程。治療組患者在對照組療法基礎上服用加味肝豆湯(萆薢、半枝蓮、穿心蓮各15 g,郁金12 g,黃芩、黃連各9 g,生大黃、茵陳各6 g)顆粒劑(四川新綠色藥業公司生產),每日早晚各1袋,餐后用溫開水150 mL沖服。8 d為1個療程,兩組均治療4個療程。
2.2 指標觀察方法
2.2.1 濕熱內蘊證積分及中醫證候療效判定標準 參考《中藥新藥臨床研究指導原則》[8]制定濕熱內蘊證證候積分標準,治療前后分別觀察主癥(肢體拘攣、言語含糊、脘腹脹滿、納食不香)和次癥(面色晦暗、頭昏目眩、黃疸水臌、口苦或臭、小便黃赤、大便干結),主癥按“輕度”“中度”“重度”分別計2、4、6分,次癥按“輕度”“中度”“重度”分別計1、2、3分,正常計0分。見表1。采用尼莫地平法計算療效指數,再根據療效指數判定中醫證候療效。療效指數=(治療后濕熱內蘊證積分-治療前濕熱內蘊證積分)/治療前濕熱內蘊證積分×100%。顯效:75%≤療效指數≤100%;有效:30%≤療效指數<75%;無效:0≤療效指數<30%;惡化:療效指數<0。
2.2.2 血脂、肝功能、尿銅檢測 治療前后分別抽取患者空腹外周靜脈血5 mL,2 000 r/min離心10 min,取上層血清,利用膽固醇氧化酶法測定TC、HDL-C、LDL-C水平,用磷酸甘油氧化酶法檢測TG水平,采用膽汁酸循環酶法測定BA水平,采用乳酸脫氫法檢測丙氨酸氨基轉移酶(alanine transferase,ALT)、天冬氨酸氨基轉移酶(aspartate transferase,AST)和γ-谷氨酰轉移酶(γ-glutamyl transferase, GGT)水平,采用GGX型原子吸收分光光度計檢測24 h尿銅水平。
2.2.3 安全性觀察 治療前后檢測兩組患者血常規、尿常規、糞常規、肝功能、腎功能、心電圖。
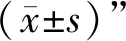
3 結果
3.1 兩組患者中醫證候療效比較 兩組患者中醫證候療效比較,差異有統計學意義(P<0.05),治療組療效優于對照組。見表2。
3.2 兩組患者治療前后濕熱內蘊證積分比較 兩組患者治療后濕熱內蘊證積分均較治療前顯著降低(P<0.05),且治療組降低程度大于對照組(P<0.05)。見表3。

表2 兩組患者中醫證候療效比較

表3 兩組患者治療前后濕熱內蘊證積分比較
3.3 兩組患者治療前后血清BA、ALT、AST和GGT比較 治療后兩組患者血清BA、ALT、AST、GGT水平均較治療前顯著降低(P<0.05),且治療組血清BA、ALT、AST、GGT水平降低程度顯著大于對照組(P<0.05)。見表4。
3.4 兩組患者治療前后血清TC、TG、LDL-C和HDL-C水平比較 與治療前比較,治療后兩組患者血清TC、TG、LDL-C水平均顯著降低(P<0.05),血清HDL-C水平顯著升高(P<0.05),且治療組血清TC、LDL-C水平降低程度和HDL-C升高程度顯著大于對照組(P<0.05)。見表5。
3.5 兩組患者治療前后24 h尿銅水平比較 第2、4個療程末,兩組患者24 h尿銅水平均較治療前顯著增加(P<0.05);第4個療程末,治療組24 h尿銅水平顯著高于對照組(P<0.05)。見表6。
3.6 安全性觀察 治療后兩組患者血常規、尿常規、糞常規、肝功能、腎功能和心電圖均未出現明顯異常,且在治療過程中均未出現與藥物相關的不良反應。

表4 兩組患者治療前后BA、ALT、AST和GGT比較
4 討論
脂質代謝異常為WD的常見臨床癥狀,主要表現為TC、TG、LDL-C升高和HDL-C降低,肝臟合成脂質過多、脂肪酸攝取過多或氧化失常、脂質分泌異常等是肝臟脂質代謝異常的主要原因[10]。內源性血脂主要合成于肝臟等組織細胞中,TC、TG、LDL-C、HDL-C是反映機體脂質代謝水平的常用指標。TC由LDL-C攜帶運輸至全身,組織中多余的TC由HDL-C吸收,運輸到肝臟,加工為BA排出體外。BA在肝細胞中生成TG及膽固醇酯,可降低BA對肝臟的損傷作用[11]。約70% BA形成于肝細胞中,通過膽鹽輸出泵輸送至膽囊,進食后隨膽囊收縮再排入十二指腸內,BA在膽汁淤積狀態下可以造成肝和膽管細胞損傷,間接激活肌成纖維細胞,從而促進肝纖維化[12]。此外,BA可通過調控胰脂肪酶和脂蛋白酯酶的活性,提高對脂肪的水解代謝,間接激活M1受體,啟動炎癥級聯反應,最終導致肝纖維化形成。25%以上的血脂異常患者合并脂肪肝[13],而ALT、AST、GGT作為檢測機體肝功能損傷的主要指標,其含量升高能反映機體肝功能的損傷[14]。

表5 兩組患者治療前后血清TC、TG、HDL-C、LDL-C水平比較

表6 兩組患者治療前后24 h尿銅水平比較
WD可歸屬于中醫學“肝積”“脅痛”“鼓脹”等范疇。《靈樞·五癃津液別》曰:“五谷之津液和合而為膏者,內滲入于骨空,補益腦髓,而下流于陰股。”指出膏脂由水谷精微化生而成,液者為膏,凝者為脂,嗜食肥甘厚膩,膏脂精微超出正常所需則凝結于皮下臟腑形成脂凝。膽汁酸乃膽汁主要成分,而膽汁的合成與肝密切相關,《東醫寶鑒·膽腑》中“肝之余氣,溢入于膽,聚而成精”,肝之功能受損,則膽汁生成排泄等方面皆受到影響。楊文明認為,WD的病機特點為本虛標實,其本為先天肝腎陰虛或病久傷陽致脾腎陽虛,其標為濕熱內蘊,痰瘀互結,且銅濁毒邪貫穿疾病整個病程[15]。濕熱、銅毒之邪侵襲,久則傷脾,脾虛濕困,阻滯中焦,則見食欲不振、腹脹痞滿等癥[16],當治以清熱化濕、通腑利尿,方選高鋅低銅之加味肝豆湯。肝豆湯中生大黃、黃連、黃芩藥性苦寒,歸脾、胃、大腸經,生大黃清熱瀉火、利濕退黃;黃連清熱燥濕、瀉火解毒;半枝蓮、穿心蓮、萆薢清解熱邪濁毒。諸藥合用,具有清利腸中濕熱、通泄銅毒濁邪之功。加味肝豆湯在肝豆湯的基礎上加用茵陳和郁金,茵陳清利濕熱,郁金解郁疏肝、通腑利膽,加強原方清利濕熱、通腑泄濁解毒的功效。
本研究發現,加味肝豆湯聯合DMPS驅銅治療能顯著改善患者濕熱內蘊證候,降低血清TC、TG、LDL-C、BA、ALT、AST水平,升高血清HDL-C水平,提示加味肝豆湯聯合DMPS驅銅治療可以有效改善患者脂質代謝及BA水平,保護肝功能。治療2個療程后,兩組患者24 h尿銅均較治療前顯著升高,但組間差異無統計學意義,這可能與治療時間較短有關;治療4個療程后,治療組24 h尿銅水平顯著高于對照組(P<0.05),說明加味肝豆湯聯合DMPS驅銅治療可顯著降低體內游離銅含量。兩組治療后均未出現與藥物相關的不良反應,說明加味肝豆湯的安全性高。
現代藥理學研究[17]顯示,加味肝豆湯中藥物及其有效成分具有降低血脂、保護肝臟和促進膽汁排泄作用。大黃素通過促進下游蛋白微小異源二聚體表達,引起BA生成減少及代謝增加,減輕膽汁淤積。黃連可上調鈉離子—牛磺膽酸協同轉運蛋白等的表達水平,從而促進膽汁酸排泄,降低肝內膽汁淤積,改善肝功能[18]。黃芩苷聯合姜黃素可降低肝內膽固醇7α-羥化酶等分子的表達水平,從而發揮抗膽汁淤積和促脂質代謝作用[19]。穿心蓮可通過降低乳酸脫氫酶的活性發揮保肝作用[20]。茵陳中有效成分倍半萜內酯能夠降低肝內脂肪蓄積[21]。郁金中吉馬酮成分可有效抗脂肪生成,同時促脂肪分解[22]。
綜上所述,以清熱化濕、利腑泄濁解毒為功效的加味肝豆湯聯合DMPS驅銅治療能夠有效改善濕熱內蘊型WD患者臨床癥狀,提高臨床療效。其作用機制可能與改善脂質代謝異常,調節BA代謝,保護肝功能相關。

