Wilson病認知功能障礙與腸道菌群的相關性研究
沈 奇,王艷昕,朱晶晶,文 曼,束道賢,王 穎,孫 敏
(1.安徽中醫藥大學第一附屬醫院腦病科,安徽 合肥 230031;2.安徽中醫藥大學研究生院,安徽 合肥 230012;3.淮南聯合大學,安徽 淮南 232038;4.安徽大學,安徽 合肥 230601)
Wilson病(Wilson’s disease,WD)是一種罕見的先天性銅代謝障礙的常染色體遺傳病,由位于人染色體13q14.3上ATP7B基因變異所致,表現出神經癥狀、精神異常、肝功能異常、角膜K-F環等癥狀[1]。近年來研究[2]發現,認知功能障礙作為WD的非運動癥狀之一,表現為執行功能、記憶力、注意力障礙,影響患者正常生活。WD腦型多因銅離子存積于大腦各處,尤其是基底節區,損傷基底節—丘腦—皮質環路,影響認知功能[3]。但是有部分研究表明,認知功能障礙并非完全與銅離子在腦的沉積有關,提示WD的認知功能障礙還有更復雜的原因。相關研究[4]表明,WD患者代謝紊亂導致腸道功能失調,影響腸道菌群的多樣性。腸道菌群對人體腦功能、情緒以及行為等具有調節作用,其功能失調容易引起帕金森病、精神分裂癥、阿爾茨海默病和腦卒中等神經、精神疾病[5]。目前,尚未有對WD的認知功能障礙與腸道微生物多樣性的研究。基于腸道菌群與WD的相關性,本研究運用16S rRNA基因測序技術對WD認知功能障礙患者和WD無認知功能障礙患者的糞便進行檢測,分析WD認知功能障礙與腸道微生物類型是否存在相關性,以期為臨床診療WD伴認知功能障礙提供思路及參考。
1 臨床資料
1.1 診斷標準
1.1.1 WD西醫診斷標準 參照《肝豆狀核變性診斷和治療指南》[6]:按照錐體外系體征或有肝臟損害病史,合并24 h尿銅>100 μg,或銅藍蛋白<200 mg/L,或肝銅含量>250 μg/g,K-F環陽性便可確診;若銅藍蛋白正常或K-F環陰性,而兩條染色體均攜帶ATP7B基因致病變異等明確診斷。
1.1.2 認知功能障礙診斷標準 參照《中國精神障礙分類與診斷標準》中相關標準[7],并結合臨床癥狀擬定認知功能障礙診斷標準:①記憶力受損超出根據年齡與教育的期望值;②有客觀的證據顯示存在短期和(或)長期的記憶損傷;③整體的認知能力降低;④有抽象思維損害和(或)判斷障礙;⑤經醫師通過認知量表檢測,可明確其存在認知功能障礙;⑥日常生活能力下降。
1.2 納入標準 ①確診WD者。②觀察組蒙特利爾認知評估(Montreal cognitive assessment,MoCA)量表認知評分<26分,受教育年限≤12年,可將結果加1分;對照組MoCA量表認知評分≥26分,受教育年限≤12年,可將結果加1分,但總分不能超過30分。③首次就診患者或近3個月未服用治療WD的相關藥物及改善認知功能的藥物。④年齡13~65歲。⑤患者及其家屬知情同意。
1.3 排除標準 ①年齡>65歲或<13歲;②嚴重肝功能異常、腦梗死、惡性腫瘤、凝血功能異常、免疫功能異常、心血管疾病患者;③入組前1個月曾服用治療WD的藥物及改善認知功能的藥物;④顱腦MRI檢查可見額葉皮質下對稱性受累,顯示雙側T2高信號影;⑤患者拒絕簽署知情同意書。
1.4 一般資料 篩選2017年6月至2018年12月在安徽中醫藥大學第一附屬醫院腦病科住院且滿足納入標準的WD患者,調查所有患者的基本情況,且做好數據統計工作,即患者的年齡、性別、既往史、家族史、飲食情況以及過敏史等內容。根據納入和排除標準,應用MoCA量表篩查滿足認知功能障礙診斷標準的WD患者作為觀察組,MoCA量表評分正常且滿足納入標準的WD患者作為對照組。 共納入對照組32例、觀察組患者38例。對照組:男16例,女16例;平均年齡(28.81±10.67)歲;平均受教育年限(9.91±3.19)年;統一Wilson病評分量表(unified Wilson’s disease rating scale,UWDRS)評分為(103.91±19.45)分。觀察組:男19例,女19例;平均年齡(27.35±9.45)歲;平均受教育年限(9.39±3.14)分;UWDRS評分為(105.11±20.97)分。兩組患者性別、年齡、UWDRS、受教育年限比較,差異均無統計學意義(P>0.05),具有可比性。 兩組患者在入組前1個月未出現呼吸系統疾病,在收集樣本的1周內未服用過任何藥物。
2 方法
2.1 標本收集 收集兩組患者的晨起大便樣本(為了避免其他因素影響實驗結果,全部待檢者需在無菌區排便)3~4 g,然后將樣本放入一次性便簽盒中,密封后立即送至冷藏柜中冷藏待檢。
2.2 糞便DNA抽提 取糞便樣本0.2~0.3 g,放進存有預熱溶液A的離心管中,震蕩離心5~10 min后放入65 ℃水溫中至少5 min;將樣本所得的上清液與溶液B相互混合,然后將其置于離心管內冰浴5 min以上。然后離心3 min,將其轉移到另外一個1.5 mL的離心管,管內上清液不得多于0.6 mL,然后將其添加到1.5倍的溶液C中,使其充分混合;隨后將上柱分2次(將沖洗液分別加入柱內,離心1 min后除去穿透液),將其余的液體離心1 min,以便在DNA樣品中清洗溶液。將該溶液移到另外一個離心管中,再加DNA洗脫液,1~2 min后進行最后一次離心,持續1 min,最終獲得的DNA樣本,放于-20 ℃冰箱中。所提取的總DNA經1%瓊脂糖凝膠電泳檢測完整性。
2.3 PCR擴增 選擇可變區的特定區段(V3~V4區),選用通用引物338F和806R對總DNA樣品進行細菌16S rDNA序列片段擴增,引物序列:上下游引物806R(5′-GGACTACHVGGGTWTCTAAT-3′)與338F(5′-ACTCCTACGGGAGGCAGCA-3′),經過27個循環,每一個樣品進行3次重復,將重復樣品中的PCR產物進行合并,初步檢測濃度后用于后續高通量測序。
2.4 熒光定量和高通量測序 將PCR產物進行熒光定量檢測,采用QuantiFluorTM-ST藍色熒光定量系統進行定量檢測;依據定量結果和測序量要求,將PCR產物構建測序文庫,通過第二代DNA高通量測序技術,使用Illumina Miseq PE300測序平臺進行高通量測序。
2.5 生物信息學分析 將測序后得到所有序列基于聚類單元分析以及分類學分析,獲得腸道菌群豐度及多樣性,在門、科、屬等生物分類水平上分析統計各樣品的物種相對豐度。
3 結果
3.1 測序數據優化情況
3.1.1 DNA的序列長度 采用高通量測序系統,對兩個組別的DNA樣品進行比較,并選取12例子樣品序列優化,得到1~520 bp的DNA序列長度,大部分DNA的序列長度為421~460 bp。見圖1。
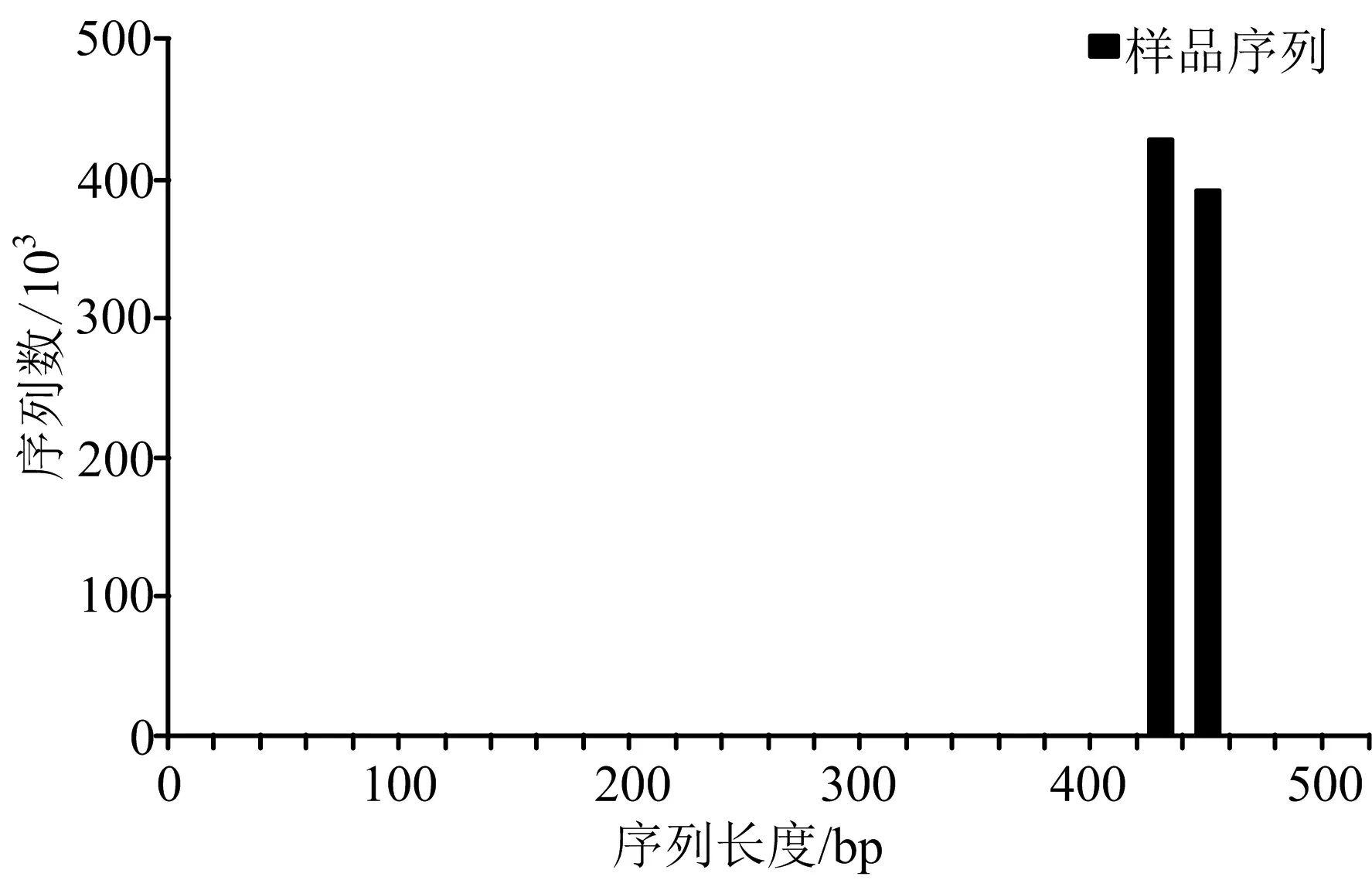
圖1 樣品序列長度分布
3.1.2 樣本多樣性分析 多樣性指數為腸道菌群種類多樣性的程度,均通過Alpha多樣性分析而獲得。其中Sobs指數表示觀測到的物種數目,Simpson指數是物種豐富度的指標,即菌群中每個物種豐度的比例,其數值越大,代表菌群多樣性越低;Shannon指數表示物種豐富度和均勻性的指標,數值越大代表菌群多樣性越大。兩組樣本多樣性指數比較,差異無統計學意義(P>0.05)。見表1。
表1 兩組樣本多樣性比較
3.1.3 稀釋曲線分析 稀釋曲線是用來估計比較測序數據量不同樣品中物種的豐度,可以對兩組腸道菌群群落豐度進行深入對比,并且也用于檢測樣品測序量是否充足。稀釋曲線斜率平滑、變化不大,提示測序數據量較為充足,測序深度基本包含樣本中所有物種,每個樣本中物種分布也相對均勻。兩組稀釋曲線斜率較為平滑,且兩組測序的數據具有充分的合理性,可以為進一步的統計分析提供依據。見圖2。
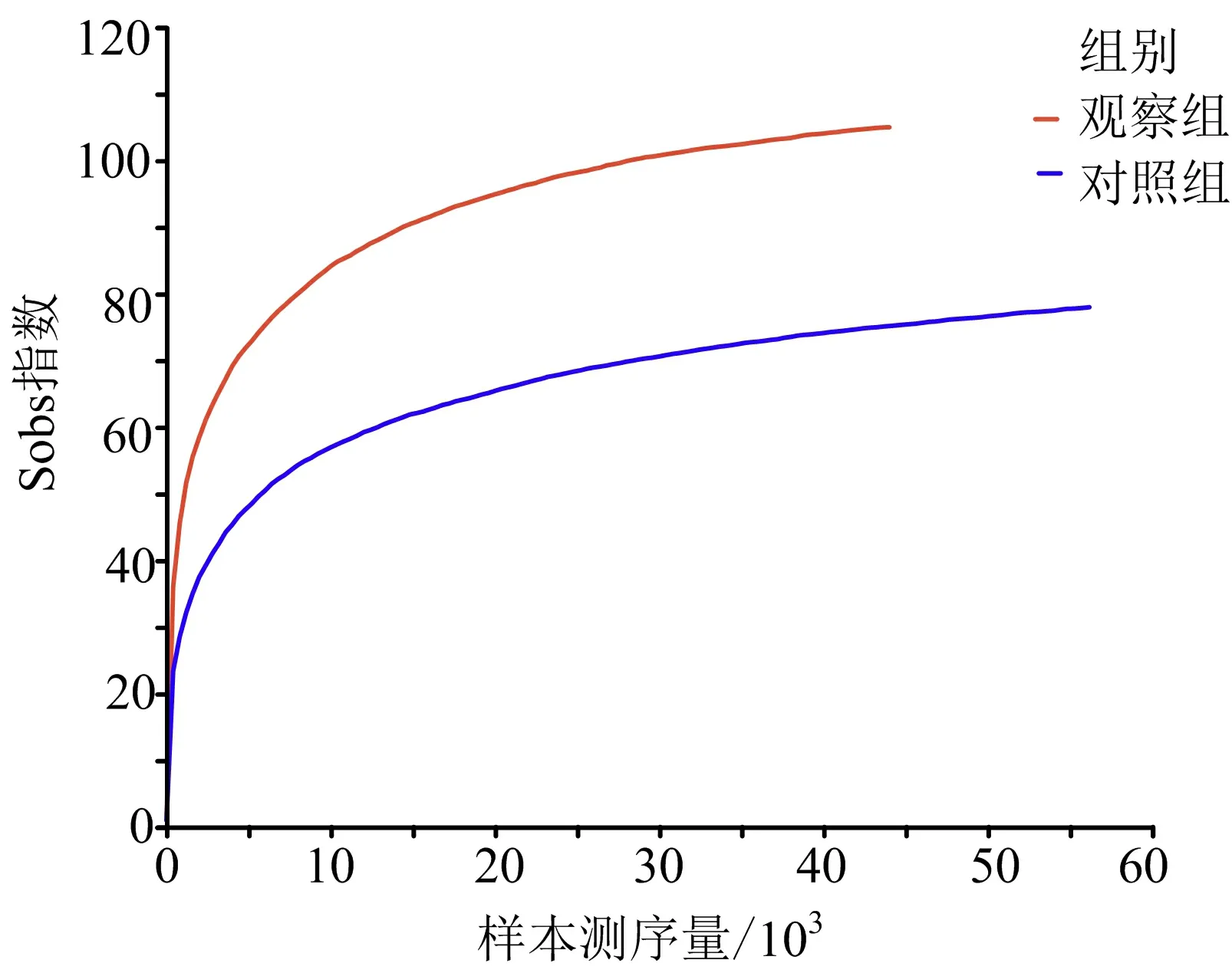
圖2 兩組稀釋曲線
3.2 樣品分組分析 非度量多維尺度(non-metric multidimensional scaling,NMDS)分析顯示:兩組微生物組成差異具有統計學意義(圖3A)。通過相似性分析(analysis of similarities,ANOSIM )評估的腸道菌群結構在兩組之間存在顯著差異(R=0.650 5,P=0.009)。 主成分分析(principal component analysis,PCA)(圖3B)和主坐標分析(principal co-ordinates analysis,PCoA)(圖3C)表明兩組患者的腸道微生物存在明顯差異。
3.3 物種差異 組間物種差異研究,即對兩個群落中不同種類進行監測,并進行假定檢驗,以評價其差異的顯著程度。本研究樣品的物種進行差異顯著性分析,分別從門、科和屬3個不同生物分類信息比較其相對豐度信息,以探討腸道菌群和WD認知障礙的相關性。
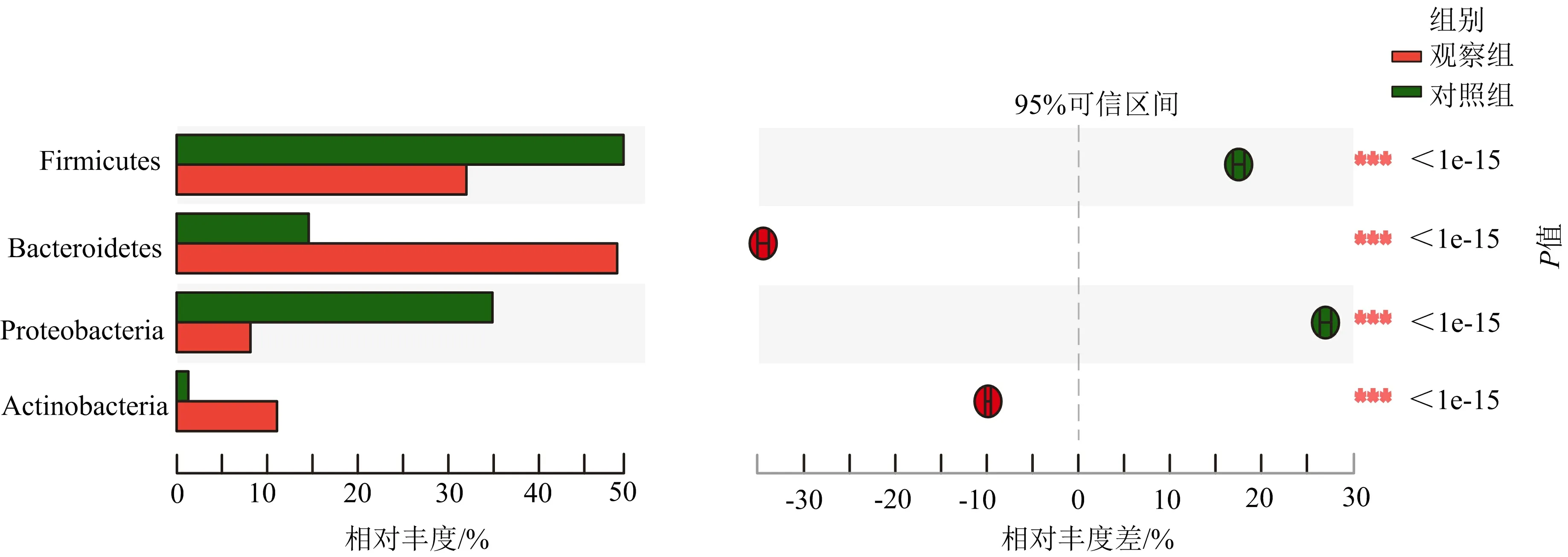
3.3.1 兩組門水平相對豐度比較 兩組差異明顯的物種有擬桿菌門(Bacteroidetes),分別占14.36%和48.78%;厚壁菌門(Firmicutes),分別占49.46%和32.02%;放線菌門(Actinobacteria),分別占1.21%和11.12%;變形菌門(Proteobacteria),分別占34.96%和8.08%。與對照組比較,觀察組擬桿菌門和放線菌門豐度明顯升高(P<0.05);厚壁菌門和變形菌門豐度明顯降低(P<0.05)。見圖4。
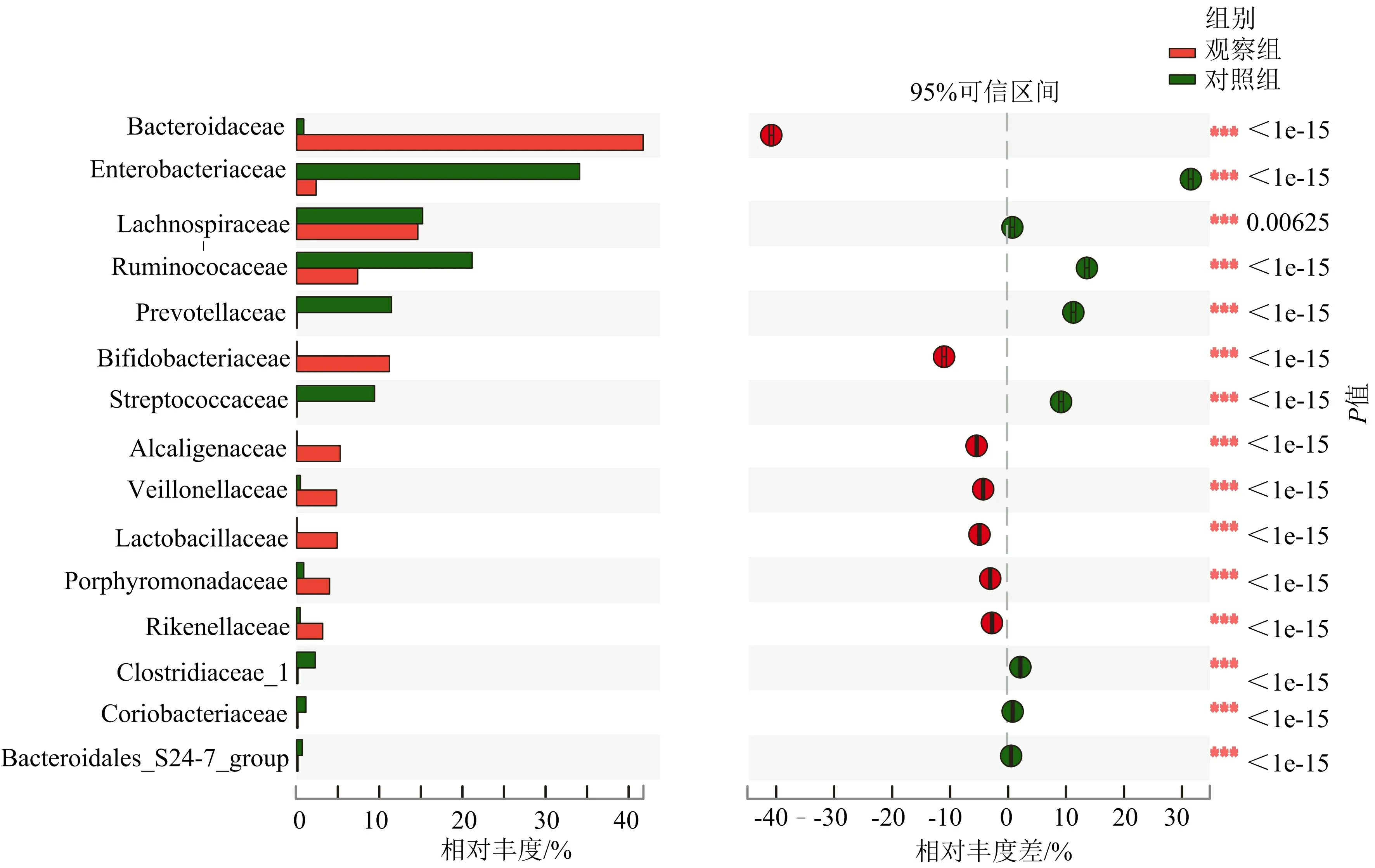
3.3.2 兩組科水平菌群相對豐度比較 兩組差異明顯的物種有產堿桿菌科(Alcaligenaceae),分別占0.005%和5.224%;韋榮氏球菌科(Veillonellaceae),
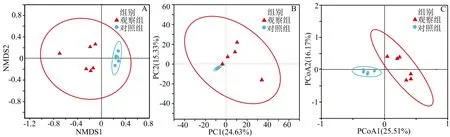
注:A.NDMS分析;B.PCA分析;C.PCoA分析
分別占0.520%和4.693%;乳酸菌科(Lactobacillaceae),分別占0.005%和4.844%;紫單胞菌科(Porphyromonadaceae),分別占0.876%和3.828%;雙歧桿菌科(Bifidobacteriaceae),分別占0.251%和11.090%;理研菌科(Rikenellaceae),分別占0.415%和3.082%;擬桿菌科(Bacteroidaceae),分別占0.961%和41.840%;鏈球菌科(Streptococcaceae),分別占9.363%和0.071%;腸桿菌科(Enterobacteriaceae),分別占34.120%和2.391%;普氏菌科(Prevotellaceae),分別占11.450%和0.027%;毛螺菌科(Lachnospiraceae),分別占15.350%和14.720%;科里桿菌科(Coriobacteriaceae),分別占0.938%和0.018%;乳球菌科(Ruminococcaceae),分別占21.210%和7.396%;梭菌科(Clostridiaceae_1),分別占2.298%和0.018%;未分類擬桿菌(Bacteroidales_S24-7_group),分別占0.657%和0%。與對照組比較,觀察組雙歧桿菌科、紫單胞菌科、擬桿菌科、產堿桿菌科、理研菌科、乳酸菌科、韋榮氏球菌科豐度明顯升高(P<0.05),梭菌科、科里桿菌科、未分類擬桿菌、腸桿菌科、毛螺菌科、乳球菌科、普氏菌科、鏈球菌科豐度明顯降低(P<0.05)。見圖5。
注:P值為Ae-b形式,為A×10-b次方值,其值遠小于0.05
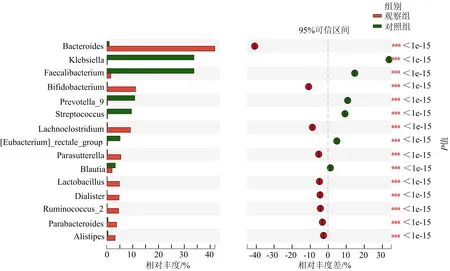
3.3.3 兩組屬水平菌群相對豐度比較 兩組差異明顯的物種有擬桿菌屬(Bacteroides),分別占0.961%和41.840%;柯林斯氏菌屬(Parabacteroides),分別占0.459%和3.648%;Lachnoclostridium,分別占0.237%和9.064%;乳球菌屬(Ruminococcus_2),分別占0.037%和4.467%;帕拉斯氏菌屬(Parasutterella),分別占0%和5.224%;雙歧桿菌屬(Bifidobacterium),分別占0.251%和11.090%;另枝菌屬(Alistipes),分別占0.415%和3.082%;小桿菌屬(Dialister),分別占0%和4.613%;乳酸菌屬(Lactobacillus),分別占0.005%和4.844%;棲糞桿菌屬(Faecalibacterium),分別占16.270%和1.599%;克雷伯氏菌(Klebsiella),分別占33.800%和0.049%;鏈球菌屬(Streptococcus),分別占9.363%和0.071%;普雷沃氏菌屬(Prevotella_9),分別占10.860%和0.014%;布勞特氏菌屬(Blautia),分別占3.187%和1.973%;直腸真桿菌屬([Eubacteri-um]_rectale_group),分別占5.047%和0.271%。與對照組比較,觀察組乳酸菌屬、小桿菌屬、乳球菌屬、柯林斯氏菌屬、另枝菌屬、擬桿菌屬、雙歧桿菌屬、帕拉斯氏菌屬豐度明顯升高(P<0.05),直腸真桿菌屬、布勞特氏菌屬、克雷伯氏菌、棲糞桿菌屬、普雷沃氏菌屬、鏈球菌屬豐度明顯降低(P<0.05)。見圖6。
注:P值為A e-b形式,為A×10-b次方值,其值遠小于0.05
注:P值為Ae-b形式,為A×10-b次方值,其值遠小于0.05
4 討論
WD是一種銅代謝異常的常染色體隱性遺傳病,臨床主要以錐體外系癥狀及肝臟損害為主,除了以上損害外,認知功能障礙也十分常見[2]。在認知功能障礙的整個發展過程中,腸道微生物,如放線菌門、厚壁菌門、擬桿菌門、變形菌門起到重要作用[8]。但是關于WD合并認知功能障礙的研究較少,因此本研究在既往研究基礎上,進一步對WD患者腸道菌群與認知的相關性展開研究。
中醫理論認為人的意識、思維、情感等腦神的變化與腑氣通暢關系密切,例如腦卒中后便秘就是腦神的改變影響腸腑氣的通暢,便秘患者腸腑通降失常,腑氣不通,上擾清竅,也可影響神明。腦與腸在生理、功能或病理上相互影響、相互制約。現代醫學將腸道微生物與大腦之間的雙向交流稱為微生物群—腸—腦軸,涉及神經細胞發育、大腦功能和認知調節等方面[9]。現有研究[10-11]發現,腸道微生物主要通過以下兩個方面影響認知功能:腸道微生物產生的代謝物(如短鏈脂肪酸、神經遞質及其前體)通過影響大腦中相關代謝物水平,從而調節大腦功能和認知;腸道炎癥以及腸道屏障功能失調,腸道通透性增加可能會導致神經退行性病變,影響認知功能。其中短鏈脂肪酸(short-chain fatty acids,SCFAs)包括乙酸鹽、丙酸鹽和丁酸鹽,是腸道微生物厚壁菌門、普氏菌科、普雷沃氏菌屬、鏈球菌屬和真桿菌屬等代謝的主要產物[12],能夠提供能量以及維持腸道菌群和電解質的穩定[13]。同時能影響血腦屏障通透性,維持中樞神經系統內環境穩定,被認為是微生物—腸—腦相互作用的關鍵遞質,能夠調控宿主認知功能等行為[14]。SCFAs減少則更容易發生認知障礙,進而出現神經退行性疾病[15]。
丁酸鹽是厚壁菌門的主要產物[16],在大腦中可通過抑制組蛋白脫乙酰酶,對神經退行性疾病發揮神經保護作用并改善記憶[17]。帕金森病患者SCFAs濃度降低,尤其是丁酸鹽濃度降低,腸道屏障滲透性和血腦屏障的通透性增加[18],脂多糖等促炎產物通過腸壁進入血液,穿過血腦屏障激活小膠質細胞并引發神經炎癥反應,從而導致人和動物的認知能力下降[19]。研究[20]發現,厚壁菌門中毛螺菌科和梭菌科數量與認知表現呈正相關,在2型糖尿病患者中觀察到其相對豐度降低。其中,梭菌的減少會增加腸道通透性,增加的滲透性使細菌或細菌成分如脂多糖和其他抗原滲入并引發炎癥反應,從而影響大腦的認知能力[21]。本研究發現,WD認知功能障礙患者擬桿菌門增加,厚壁菌門、毛螺菌科、梭菌科、普氏菌科、普雷沃氏菌屬、鏈球菌屬、直腸真桿菌屬降低,與相關研究結果一致。
綜上所述,WD認知功能障礙的發病或整個病程中存在腸道菌群的參與,這些腸道菌群的改變可能通過SCFAs影響WD認知功能障礙。但其具體作用機制有待進一步研究。

