逆灸對Aβ25-35誘導的阿爾茨海默病大鼠海馬JAK2、STAT3的影響
李 真,李夢醒,劉 芳,唐何勇,劉 箐,宋宗勝,史可鑒,蘭 崴,李斯亮,姚曉雯,唐 巍
(1.安徽中醫藥大學針灸推拿學院,安徽 合肥 230012;2.安慶醫藥高等專科學校臨床醫學系,安徽 安慶 246052;3.安徽中醫藥大學中西醫結合學院,安徽 合肥 230012;4.合肥市第一人民醫院南區合肥市濱湖醫院,安徽 合肥 230092)
阿爾茨海默病(Alzheimer’s disease,AD)是一種常見的退行性神經系統疾病,以認知功能進行性減退為主要臨床特征[1-2]。β-淀粉樣蛋白(amyloid β,Aβ)過量沉積和神經原纖維纏結(neurofibrillary tangles,NFT)是其主要病理改變[3]。Aβ過量沉積引發的慢性炎癥反應,是AD發病的主要病理機制[4]。酪氨酸蛋白激酶-2/信號轉導和轉錄激活因子-3(Janus kinase-2/signal transducer and activator of transcription-3,JAK2/STAT3)信號通路是機體參與免疫調節和介導炎癥反應的重要通路之一[5]。近年來研究[6-7]顯示,通過干擾JAK2/STAT3信號通路可調控Aβ誘導的小膠質細胞炎癥反應中炎癥因子的釋放,從而減少神經炎癥反應的發生。
AD起病隱匿,無明顯征兆,現代臨床尚無有效逆轉病程的治療措施和藥物[8]。針灸治療AD效果明顯,且早已被國內學術界證實,但是對逆灸治療的研究相對較少。有研究[9-10]表明,逆灸可修復損傷的神經細胞,改善AD大鼠的記憶能力,延緩衰老進程。本實驗觀察逆灸“百會”“腎俞”“足三里”穴對AD大鼠認知功能的作用及JAK2/STAT3信號通路相關炎癥蛋白表達的影響,以探究逆灸防治AD的作用機制。
1 材料
1.1 動物選取 健康雄性SD老齡大鼠36只,12月齡,體質量(350±30)g,SPF級,購自山東省實驗動物中心[生產許可證號:SCXK(魯)2019-0003]。所有動物飼養于安徽中醫藥大學新安醫學教育部重點實驗室動物房。獨立通風系統籠具,溫度(25±2)℃,濕度(55±5)%,12 h光照時間,自由攝食、飲水。整個實驗所有過程均符合安徽中醫藥大學實驗動物倫理委員會相關規定,實驗過程中對所有動物的處置均嚴格遵照中華人民共和國科技部頒布的《關于善待實驗動物的指導性意見》。
1.2 主要藥物與試劑 0.4 cm×12 cm特制小艾條:岳陽市艾健堂生物科技有限公司;Aβ25-35寡聚體(貨號 A4559-1MG):美國Sigma;蘇木精染液(貨號 B006)、醇溶伊紅染液(貨號 B005):安徽Ebiogo;TRIzol(貨號 15596018):美國Lifetechnogies;PBS緩沖液粉末(貨號 ZLI-9062):北京Zs-BIO;Western一抗二抗去除液(貨號 P0025):上海Beyotime;ECL超敏發光試劑盒(貨號 340958):美國Thermo;山羊抗小鼠IgG(貨號 ZB-2305)、山羊抗兔IgG(貨號ZB-2301):北京Zsbio;p-STAT3(貨號 ab267373)、p-JAK2(貨號ab32101):英國Abcam。
1.3 主要儀器與設備 Morris水迷宮系統:北京諾達思信息技術有限公司;腦立體定位儀、醫用牙科鉆(78042):深圳瑞沃德生命科技有限公司;病理切片機(RM2016):上海徠卡顯微系統貿易有限公司;電泳儀(EPS300)、轉膜儀(VE-186):上海天能科技有限公司;低速迷你離心機(LX 300):海門市其林貝爾儀器制造有限公司;高速臺式冷凍離心機(JW-3021HR):安徽嘉文儀器裝備有限公司;光學顯微鏡(BX51):日本Olympus;普通PCR儀(K960):杭州晶格科學儀器有限公司;微量移液器:德國Eppendorf;熒光定量PCR儀(PIKOREAL96):美國Thermo;自動曝光儀(JS-1070P):上海培清科技有限公司。
2 方法
2.1 動物模型復制和分組 大鼠適應性喂養7 d,采用隨機數字表法將其分為4組:正常組、假手術組、模型組和逆灸組,每組9只。通過雙側海馬內注射聚集態Aβ25-35復制AD大鼠模型[11]:用1 %戊巴比妥鈉(40 mg/kg)進行腹腔注射麻醉,于腦立體定位儀上固定其頭部,并保持前后始終位于同一水平線上。剃毛,碘伏無菌操作,切開頭皮,充分暴露出大鼠前囟和后囟,調整位置,使前囟和后囟位于同一水平面上,并調整左右兩側使之平行,以前囟位置作為原點,參照《大鼠腦立體定向圖譜》定位出海馬區(前囟向后4.4 mm,左右各旁開2.2 mm,硬腦膜下3.0 mm),微量注射器垂直顱骨緩慢插入,雙側分別注射5 μL聚集態Aβ25-35,以1 μL/min的速度注入,注射結束后留針5 min,為使Aβ25-35在局部組織中充分浸潤,防止其溢出,應緩慢出針。模型復制后適應性喂養5 d,以模型組逃避潛伏期時間延長,穿越平臺次數減少作為模型制備成功的標志。假手術組實驗過程與上述步驟相同,僅注射等量生理鹽水。
2.2 干預方法 大鼠穴位定位參照《實驗針灸學》[12],“百會”穴位于頂骨正中,“腎俞”穴位于第2腰椎棘突下旁開7 mm,“足三里”穴位于膝關節后外側,腓骨小頭下約5 mm處。將大鼠放置于特制懸空木架上,采用特制小艾條,于“百會”“腎俞”“足三里”穴位上方進行懸灸治療,灸15 min,每日1次,治療6 d,休息1 d,1周為1個療程,共治療3個療程。逆灸結束后進行模型復制。正常組、假手術組、模型組不做其他干預措施,僅進行同等時間抓取和固定。
2.3 觀察指標與檢測方法
2.3.1 Morris水迷宮實驗檢測大鼠學習記憶和空間探索能力 定位航行實驗:第1天將大鼠放入水中120 s,只進行自由游泳以適應環境。第2天起,水池以中心點均分為4個象限,將平臺置于第1象限中心位置,并保持低于水面2 cm,將各組大鼠分別從4個象限面向水池壁放入水中各1次,每次間隔15 s。若大鼠能夠在120 s內找到平臺所在的位置,則記錄大鼠找到平臺的時間,為逃避潛伏期;若大鼠不能夠在120 s內找到平臺所在的位置,則指引大鼠至平臺上,并讓其停留在平臺上10 s,再撈起放入籠中,將其逃避潛伏期時間記錄為120 s。連續5 d,根據第5天大鼠逃避潛伏期判斷大鼠學習記憶能力。空間探索實驗:第6天撤去置于第1象限中心位置的平臺,選擇任一非平臺象限將大鼠面壁放入水中,采用隱匿平臺的方法將大鼠放在水中使其運動120 s,并記錄其在120 s時間內穿越原平臺位置的次數。
2.3.2 蘇木精—伊紅(hematoxylin-eosin,HE)染色法觀察海馬的組織形態 各組大鼠Morris水迷宮行為學實驗檢測結束后,禁食24 h,稱質量,各組大鼠用1 %戊巴比妥鈉(40 mg/kg)進行腹腔注射麻醉,固定大鼠,沿腹中線剪開大鼠胸腔,充分暴露心臟,自大鼠左心室心尖部插入至升主動脈起始部,剪開右心耳,快速注入0.9% NaCl溶液,至右心房流出液澄清后,用4%多聚甲醛溶液繼續灌注,至大鼠四肢僵硬,斷頭取腦,在冰塊上迅速分離出大鼠海馬組織,將其一側海馬組織固定于4%多聚甲醛中,另一側海馬組織置于凍存管,放入-80 ℃冰箱中冷凍保存備用。
每組取3只經4%多聚甲醛溶液固定的大鼠海馬組織(約3 mm×4 mm×4 mm),經乙醇脫水后,浸蠟包埋,切片,厚度約為4 μm,用蘇木精染液、醇溶性伊紅染液進行染色,中性樹膠封片,晾干,觀察大鼠海馬的組織形態。
2.3.3 ELISA法檢測海馬白細胞介素-6(interleukin-6,IL-6)表達水平 每組取3只大鼠海馬組織,解凍后勻漿,取上清液,按ELISA試劑盒說明書操作,分別經洗滌緩沖液洗滌,抗體37 ℃孵育,加入相應酶的反應溶液等,隨后加入顯色劑,顯色10 min后加入終止劑終止反應,最后用酶標儀于450 nm波長處依序測量各孔的吸光度值。根據吸光度值和標準濃度繪制標準曲線,計算大鼠海馬組織中IL-6水平。
2.3.4 RT-qPCR法檢測海馬組織CA1區JAK2、STAT3 mRNA表達水平 每組取3只大鼠海馬組織,稱取50~100 mg,破碎研磨,加入1 mL TRIzol裂解,離心,棄上清,提取總RNA,將反轉錄出的cDNA取出,放入-80 ℃冰箱中冷凍保存備測。隨后進行熒光定量PCR反應,步驟為95 ℃預變性1 min;95 ℃變性20 s,60 ℃退火60 s,40個循環。以β-actin為內參,采用2-ΔΔCT法計算JAK2、STAT3 mRNA相對表達水平。各檢測指標的引物序列見表1。

表1 各檢測指標的引物序列
2.3.5 Western blot法檢測海馬CA1區JAK2、STAT3蛋白磷酸化表達水平 每組取3只大鼠海馬組織0.1 g,加入600 μL RIPA細胞裂解液進行裂解,12 000×g離心15 min,收集含有組織總蛋白的上清液。按照1∶4的比例在收集的蛋白樣品中加入5×SDS-PAGE蛋白上樣緩沖液,沸水浴加熱至使其蛋白充分變性。樣品冷卻到室溫后,SDS-PAGE電泳分離目的蛋白(80 V,60 min):磷酸化酪氨酸蛋白激酶-2(phosphorylated Janus kinase-2,p-JAK2,轉膜90 min;磷酸化信號轉導和轉錄激活因子-3(phosphorylated signal transducer and activator of transcription-3,p-STAT3)轉膜65 min。加入Western封閉液(5%脫脂奶粉)封閉2 h。加入一抗p-JAK2(1∶5 000)、p-STAT3(1∶1 000),PBST洗滌3次,每次10 min;加入二抗(1∶20 000)孵育,洗滌3次,每次10 min。使用ECL發光試劑盒檢測相關蛋白,運用Image J軟件分析各目的條帶灰度值,將其與內參蛋白GAPDH灰度值之比作為相對表達水平。
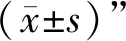
3 結果
3.1 各組大鼠行為學檢測結果比較 與正常組、假手術組比較,模型組逃避潛伏期顯著延長(P<0.05),穿越平臺次數明顯減少(P<0.05);與模型組比較,逆灸組逃避潛伏期顯著縮短(P<0.05),穿越平臺次數顯著增加(P<0.05)。見圖1。

注:A.正常組;B.假手術組;C.模型組;D.逆灸組;與正常組比較,*P<0.05;與假手術組,#P<0.05;與模型組比較,△P<0.05
3.2 各組大鼠海馬組織形態比較 正常組、假手術組海馬神經細胞結構完整,排列有序,細胞核清晰,未見病理性改變;模型組海馬區神經細胞數量明顯減少,細胞核形態改變,核膜界限模糊,細胞間隙增大,海馬周圍神經細胞出現壞死、空泡變性,血管腫脹變形;逆灸組海馬神經細胞數量明顯增多,結構基本完整,少許細胞核輕度不規則。見圖2。


3.3 各組大鼠海馬組織中IL-6水平比較 與正常組、假手術組比較,模型組海馬組織中IL-6水平顯著升高(P<0.05);與模型組比較,逆灸組海馬IL-6水平顯著降低(P<0.05)。見圖3。

注:A.正常組;B.假手術組;C.模型組;D.逆灸組;與正常組比較,*P<0.05;與假手術組比較,#P<0.05;與模型組比較,△P <0.05
3.4 各組大鼠海馬組織CA1區JAK2 mRNA、STAT3 mRNA表達水平比較 與正常組、假手術組比較,模型組海馬組織CA1區JAK2 mRNA、STAT3 mRNA相對表達水平顯著升高(P<0.05);與模型組比較,逆灸組海馬組織CA1區JAK2 mRNA、STAT3 mRNA相對表達水平顯著降低(P<0.05)。見圖4。

注:A.正常組;B.假手術組;C.模型組;D.逆灸組;與正常組比較,*P<0.05;與假手術組比較,#P<0.05;與模型組比較,△P<0.05
3.5 各組大鼠海馬組織CA1區JAK2、STAT3蛋白磷酸化表達水平比較 與正常組、假手術組比較,模型組海馬組織CA1區JAK2、STAT3蛋白磷酸化水平顯著增加(P<0.05);與模型組比較,逆灸組海馬組織CA1區JAK2、STAT3蛋白磷酸化表達水平顯著降低(P<0.05)。見圖5。

注:A.正常組;B.假手術組;C.模型組;D.逆灸組;與正常組比較,*P <0.05;與假手術組比較,#P <0.05;與模型組比較,△P <0.05
4 討論
“逆灸”可通過激發、調動機體潛能,達到“未病先防”目的。逆灸可以抑制炎癥遞質環氧化酶-2和前列腺素E2在海馬區的表達,減輕神經炎癥損傷,從而促進AD大鼠腦內神經細胞的修復以及學習記憶能力的恢復[9]。研究[13-14]表明,艾灸預處理可以增加大鼠海馬CA1區腦源性神經營養因子及受體TrkB、神經生長因子及受體TrkA的表達,從而改善腦內神經細胞的損傷,起到保護腦細胞的作用。
AD隸屬于中醫學“癡呆病”范疇,腦為其病位所在之處,病機以本虛標實為主,腎虛髓虧為本,痰瘀蒙竅為標。根據AD“本虛標實”的病理特點,施以“益腎精”“充腦髓”“補脾胃”的治療原則,取“百會”“腎俞”“足三里”穴位予以艾灸預處理干預治療,此三穴是治療AD的重要腧穴[15-17]。百會為一身陽氣至盛之所,有調督醒神、益智補腦之功;腎俞可補益腎精,精滿化髓,上充腦竅,腦充則神機可復,魂神可安。“足三里”有益氣補血、調理脾胃、化痰通絡、健脾化濕之功。本課題組前期研究[18]發現,逆灸“百會”“腎俞”“足三里”穴在一定程度上起到“未病先防”的作用,能夠改善AD大鼠認知功能障礙。本實驗逆灸“百會”“腎俞”“足三里”補腎生髓、充養腦竅以治本虛,顧護脾胃、除痰化瘀以除標實,標本兼治,以防呆癡。
AD是一種以進行性記憶力減退、認知功能障礙為主要表現的退行性神經病變[1]。本實驗通過雙側海馬內注射聚集態Aβ25-35制備AD大鼠模型[11],模擬AD樣病理和認知功能障礙。實驗結果顯示,模型組大鼠Morris水迷宮實驗中逃避潛伏期時間明顯延長,穿越平臺次數明顯減少,運動軌跡雜亂,路徑多呈邊緣式,海馬組織可見神經細胞排列松散,核膜界限模糊等病理損傷,海馬CA1區神經細胞數量減少、結構變形、胞膜破裂,提示模型組大鼠學習記憶和空間探索能力減退,海馬神經細胞出現損傷,表明模型復制成功。
Aβ過量沉積引發的慢性炎癥反應是AD的主要發病機制[19]。Aβ過量沉積導致神經細胞損傷,引發免疫反應,釋放促炎細胞因子,誘發炎癥反應,造成神經毒性,進而加重記憶認知功能障礙[20]。JAK2、STAT3廣泛表達于腦組織中,參與AD、帕金森病等多種退行性神經病變的發生發展。研究[21]表明,JAK2/STAT3信號通路在AD發展進程中異常激活,誘導炎癥反應的發生、損傷神經細胞結構,加重AD的病理過程,而抑制該信號通路可以減少AD的神經炎癥反應。STAT3主要參與調控通路下游基因,并在神經炎癥因子釋放的過程中發揮重要作用,而在Aβ誘導的AD模型中,STAT3的表達被過度激活,說明STAT3與AD的慢性炎癥損傷的病理過程密切相關[22-23]。研究[24]發現,JAK2抑制劑AG490可阻斷STAT3表達的激活,從而減少炎癥因子IL-6的釋放。因此,調控JAK2/STAT3信號通路能有效地抑制AD的病理過程。本實驗結果顯示,與正常組和假手術組比較,模型組大鼠海馬CA1區JAK2 mRNA、STAT3 mRNA相對表達水平顯著升高,JAK2、STAT3蛋白磷酸化表達水平顯著升高,海馬組織內IL-6水平顯著升高,說明雙側海馬注射Aβ25-35誘導的AD大鼠模型激活了JAK2/STAT3信號通路,并釋放出大量炎癥因子。而與模型組比較,逆灸組大鼠海馬CA1區JAK2 mRNA、STAT3 mRNA相對表達水平顯著降低,JAK2、STAT3蛋白磷酸化表達水平顯著降低,海馬組織中IL-6水平顯著降低,說明逆灸能夠有效地抑制JAK2/STAT3信號通路,減少神經炎癥因子的釋放,減輕神經炎癥反應,促進神經細胞的修復,達到防治AD的目的。
本實驗表明,逆灸“百會”“腎俞”“足三里”穴能改善Aβ25-35誘導的AD大鼠學習記憶功能,減少神經炎癥因子的釋放,延緩神經炎癥反應的發生發展,其作用機制可能與抑制腦內JAK2/STAT3信號通路有關。

