自愈合咪唑鹽聚離子液體/聚丙烯酸多層結構構建及抗菌性能研究*
熊晨崴,周鑫疊,周超,張俊杰,王皓,黃勇△
(1.南京醫科大學附屬常州第二人民醫院 骨科,常州 213000; 2.南京醫科大學 常州醫學中心,常州 213000;3.大連醫科大學 研究生院,大連 116000;4.共和縣中醫院 骨科,青海省海南藏族自治州共和縣 811800;5.常州大學 醫學與健康工程學院,常州 213164)
0 引言
植入型醫療器械在臨床上廣泛使用,若使用前其表面滅菌不徹底,極易造成微生物被膜的粘附,且難以去除,一旦植入患者體內會導致患者體內細菌感染,危害患者健康[1-3]。因此,為防止植入型醫療器械表面微生物被膜的形成,最有效的方法是在醫療器械表面涂覆抗菌涂層[4-5]。傳統抗菌涂層通常采用兩種方式構建,即:(1)表面修飾親水性聚合物[6],如聚乙二醇(PEG)、聚(甲基丙烯酸羧基乙酯)或聚N-乙烯基吡咯烷酮,以減少蛋白質和細菌吸附;(2)表面修飾金屬離子[7]、NO抗菌劑[8]等,通過藥物釋放或接觸等抗菌。由于醫療器械在運輸、儲存或臨床使用過程中易受劃痕、摩擦等破壞,導致表面抗菌涂層脫落,失去抗菌作用,限制了抗菌醫療器械的臨床應用。為此,有必要設計具有自愈合特性的抗菌涂層[9-10]。
層層自組裝技術(layer-by-lager,LbL)具有自愈合的特性,該技術由相鄰電荷的聚電解質交替的多層結構構建而成,其愈合特性主要通過異電荷聚電解質層之間的靜電力和離子作用力下發生鏈段的遷移運動實現。目前,國內外多個課題組報道了采用層層自組裝技術構建表面抗菌涂層的研究,實現了良好的自愈合和抗菌效果[3,11-12]。但層層自組裝抗菌涂層在動態的生理環境中極易脫落,失去抗菌作用,這是由于其自組裝層內的聚電解質層因非共價鍵作用可逆斷開所致。因此,有必要構建一種既不影響自愈合性能,又具有較好結構穩定性的自組裝抗菌涂層。
周超等[16]在結構穩定的自愈合抗菌涂層上有了一定研究,本研究在此基礎上優化了涂層制備工藝,采用呋喃結構的咪唑鹽聚離子液體(PILF)作為聚陽離子電解質層和高效抗菌劑,以含有馬來酰亞胺的聚丙烯酸(PAAF)作為聚陰離子電解質層,通過層層自組裝技術構建多層結構;然后以末端修飾有馬來酰亞胺的聚乙二醇(MPEG)與聚陽離子電解質層發生“Diels-Alder”點擊化學反應,將自組裝層交聯,賦予其結構的穩定性、快速自愈性和長期抗生物膜的效果。
1 實驗
1.1 原料
乙烯基咪唑-3-溴乙烷根據文獻自制,鹽酸多巴胺(99%)、聚乙二醇(PEG,Mn= 6 000 g/mol)、聚丙烯酸(PAA,MW=100 000 g/mol)、溴丁烷(99%)、呋喃-2-羧酸鈉(99%)、偶氮二異丁氰(AIBN,99%)、糠胺(99%)、N-羥基琥珀酰亞胺(NHS, 99%)、1-(3-二甲氨基丙基)-3-乙基碳二亞胺鹽酸鹽(EDC,99%)、4-二甲氨基吡啶(DMAP,99%)、三乙胺(99%)和其他化學品均從上海阿拉丁生化科技股份有限公司購買,并按接收方式使用。
1.2 呋喃結構的咪唑鹽聚離子液體合成
首先,將乙烯基咪唑-3-溴乙烷(4.12 g,20.00 mmol),AIBN(0.03 g,0.20 mmol)溶于20 mL甲醇中,氮氣保護下60 ℃反應12 h,聚合物在丙酮中沉淀;接著,在DMF中與等量的呋喃-2-羧酸鈉混合,與溴離子發生離子交換;然后,用去離子水透析24 h,以去除過量的呋喃-2-羧酸鈉;最后,冷凍干燥后,得到呋喃羧酸咪唑鹽聚離子液體(PILF)。
1.3 合成聚丙烯酸接枝2-呋喃胺(PAAF)
首先,PAA(1.00 g,0.01 mmol)溶于磷酸鹽緩沖鹽水(50 mL,pH 7.4)攪拌2 h;其次,依次加入NHS(0.32 g,2.80 mmol)和EDC(0.54 g,2.80 mmol),在室溫下快速攪拌6 h;接著,加入 2-呋喃胺(0.27 g,2.80 mmol),在37 ℃下再攪拌48 h;然后,用去離子水透析2 d,經冷凍干燥后得到該產品。
1.4 雙馬來酰亞胺聚乙二醇(MPEG)的合成
首先,將PEG(5.88 g,0.98 mmol)溶于二氯甲烷(30 mL),同時常溫下滴加三乙胺(0.30 g,2.94 mmol)和DMAP(0.36 g,2.94 mmol);其次,將3-馬來酰亞胺丙酰氯(0.55 g,2.94 mmol)溶解在二氯甲烷(30 mL)中,冰浴條件下恒速滴加到上述PEG溶液中;接著,在室溫下攪拌混合物過夜;然后,分別用鹽酸溶液1 M(50 mL)、飽和碳酸氫鈉溶液(50 mL)、飽和NaCl溶液(50 mL)洗滌溶液,并用硫酸鎂干燥,并在冰乙醚中沉淀,過濾干燥得到白色固體。
1.5 通過混合反應制備交聯表面多層涂層
首先,將不銹鋼片(d=10 mm)在去離子水和乙醇超聲浴中洗滌15 min;其次,用食人魚溶劑(v(硫酸):v(過氧化氫)=7∶3)預處理10 min,以清潔表面雜質,并使表面富含羥基;接著,將預處理后的SS載玻片浸入含有鹽酸多巴胺(4 mg/mL)的pH 8.5溶液中,在室溫下快速攪拌,直至顏色由金屬變成深棕色。用去離子水洗滌涂有聚多巴胺的不銹鋼片3次,并在50 ℃的真空烘箱中干燥30 min。
配有1 g/mL的聚電解質溶液(PILF為帶正電荷聚電解質,PAAF為負電荷聚電解質),采用層層自組裝技術在涂覆有聚多巴胺的不銹鋼片表面沉積PILF/PAAF自組裝層。每一層聚電解質在不銹鋼片表面沉積吸附10 min,然后用去離子水沖洗1 min,沉積20層聚電解質層,以PILF為外層。然后,將涂覆有PILF/PAAF多層結構不銹鋼片浸沒于含有MPEG交聯劑的溶液中(1 mL,c=0.5 mM)在50 ℃ 發生Diels-Alder 反應4 min,涂層定義為(C-PILF/PAAF)。以不交聯的PILF/PAAF自組裝層作為對照,定義為(PILF/PAAF) 。
1.6 表征方法
聚合物結構采用核磁共振波普1H NMR(Bruker AVANCE III, 400 MHz,美國)表征。不銹鋼片表面涂層結構分別采用紅外光譜表征(Nicolet-460,賽默飛世爾)和X射線光電子能譜表征(KRATOS Axis Ultra HAS,島津)。靜態水接觸角使用JC2000D1測角器(Powereach,中國),并在室溫下采用無柄水滴法測量。不銹鋼片上的LbL自組裝多層涂層的厚度通過橢圓偏光顯微鏡(VASE J. A. Woollam)進行測量,涂層表面電位通過Zeta電位儀測定(安東帕,瑞士)。
1.7 涂層自愈合過程和涂層穩定性表征
用手術刀在表面涂層上劃10~15 μm寬的裂紋,且深度至基材層。然后,將破壞的涂層浸入室溫下的PBS溶液中。用原子力顯微鏡(布魯克,美國)和偏光光學顯微鏡(尼康,Nikon, ECLIPSE E200,日本)觀察并拍攝每個樣品的自愈合過程。涂層穩定性可通過自組裝涂層浸泡于PBS溶液中,并通過紫外-可見分光光度計表征(日本島津 UV-2450分光光度計)。
1.8 涂層的體外抗菌活性表征
采用革蘭氏陽性細菌、金黃色葡萄球菌、革蘭氏陰性細菌和大腸桿菌評價自組裝涂層的抗菌性能。每個樣品(d=10 mm,先前紫外線消毒1 h)被放入24孔板中,將1 mL細菌懸浮液(大腸桿菌或金黃色葡萄球菌)分別以107CFU/mL的濃度播種到每個孔中,在37 ℃和5% CO2下培養,分別培養1、3、5和7 d。用PBS溶液輕輕清洗不銹鋼片3次,以去除未附著的細菌,然后放入含有PBS(10 mL)的離心管中,超聲波沐浴30 min,將所有附著的細菌從涂層表面分離出來,將剝離的細菌懸浮液在PBS溶液中適當稀釋,并分別在溶菌湯瓊脂(LB瓊脂)和Mueller-Hinton瓊脂(MHA)板上計數。使用式(1)計算菌落減少對數:
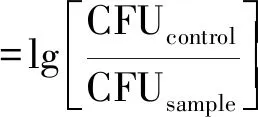
(1)
1.9 涂層細胞毒性表征
首先,采用MC3T3-E1細胞(Beyotime Bio,中國)在含10%胎牛血清和1%青霉素-鏈霉素的DMEM培養基在37 ℃培養,用0.25%胰蛋白酶和0.02%乙二胺四乙酸(EDTA)消化并離心;其次,用細胞計數儀計算細胞懸浮液的濃度,使其細胞密度為105個細胞/mL;接著,采用3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2-H-四唑溴化銨(MTT,Beyotime Bio,中國)法檢測細胞存活率。每個樣品浸泡在37 ℃,24 h;然后,將100 μL MC3T3-E1細胞懸液和100 μL浸提液接種到96孔板中,并準備6個平行重復。以100 μL PBS溶液作為空白對照。在37 ℃、5%二氧化碳中孵育24 h后,每孔加入20 μL MTT(5 mg/mL),再孵育4 h。每個孔中的溶液用150 μL的二甲亞砜(DMSO)取代,然后搖勻15 min。采用酶標儀(F50 TECAN)測定562 nm處的吸光度。式(2)為計算細胞存活率:
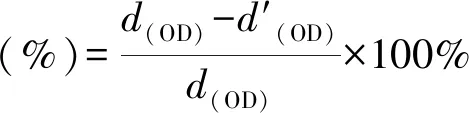
(2)
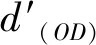
2 結果與討論
2.1 聚電解質的制備及自組裝抗菌涂層的構建
在制備涂層前,根據已有文獻分別制備了聚陽離子電解質PILF、聚陰離子電解質PAAF和交聯劑MPEG(見圖1)[17]。其中,聚陽離子電解質即含呋喃結構的咪唑鹽聚離子液體,具有較高的電負性,已證明其具有高效的抗菌活性和較好的生物相容性[18]。 所構建的聚電解質和交聯劑分別通過核磁共振1H NMR進行了表征,見圖2。圖2(a)中PILF的1H NMR的化學位移,對應連接季銨鹽的質子,其質子濃度為4.01 ppm,呋喃(7.50、6.85和6.48 ppm)的質子積分比為2∶1∶1,證實目標聚離子液體PILF已成功合成[18];在圖2(b)中,化學位移6.3~6.4 ppm出現的雙重峰證明了呋喃接枝到聚丙烯酸上制成PAAF,圖2(c)中化學位移6.1和6.3 ppm出現的峰,以及峰面積的計算證明了馬來酰亞胺不飽和雙鍵成功修飾到PEG末端,制備成MPEG。

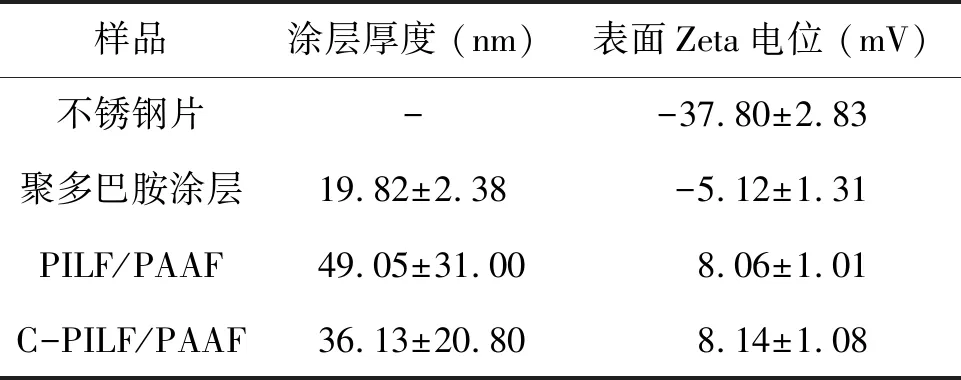
表1 不銹鋼基材表面物理性能
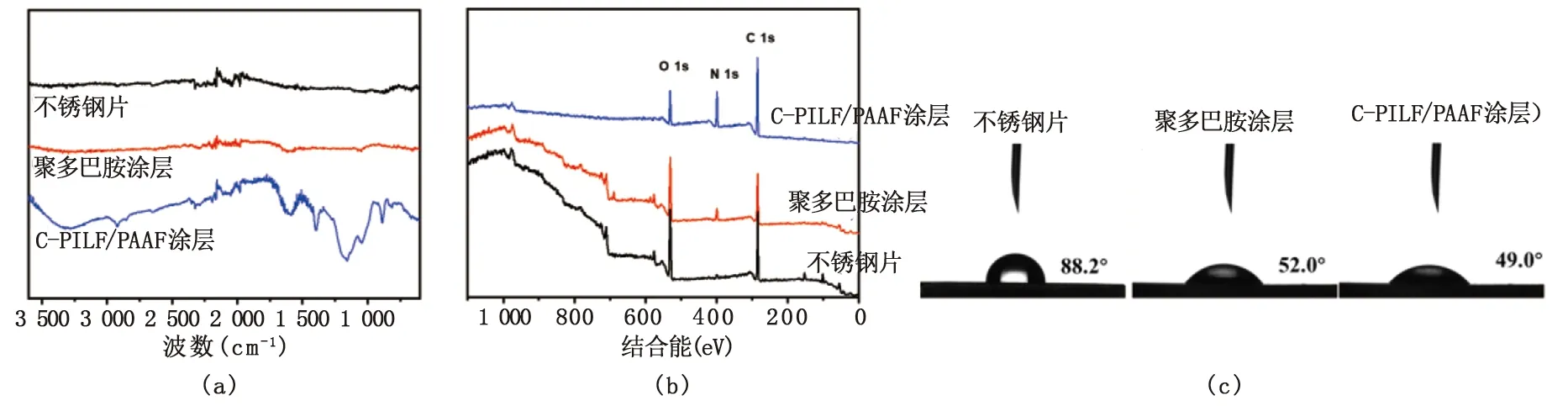
圖3 (a).面涂層紅外光譜圖;(b).PS光電子能譜寬頻掃描;(c).接觸角
2.2 自組裝涂層的自愈合性能和穩定性
基材表面的自組裝涂層的自愈合性能通過劃痕實驗表征。修飾有交聯后的C-PILF/PAAF自組裝涂層的不銹鋼基材經人工劃痕后, 通過AFM表面形貌和光學顯微鏡觀察,見圖4(a)。交聯后的C-PILF/PAAF自組裝涂層上形成了寬度和深度分別為10~15 μm和20 μm的裂縫。將樣品浸入PBS溶液后,交聯后的C-PILF/PAAF自組裝涂層的裂縫在15~30 min內愈合,而在相同時間內未交聯的自組裝涂層PILF/PAAF未能完全愈合。這是由于交聯自組裝涂層一方面在PBS中溶脹引起交聯劑雙馬來酰亞胺聚乙二醇(MPEG)將聚電解質層快速牽引,另一方面聚電解質層之間的靜電吸引,誘導聚合物鏈的移動,使得受損涂層在短時間內重建[16,19-20]。
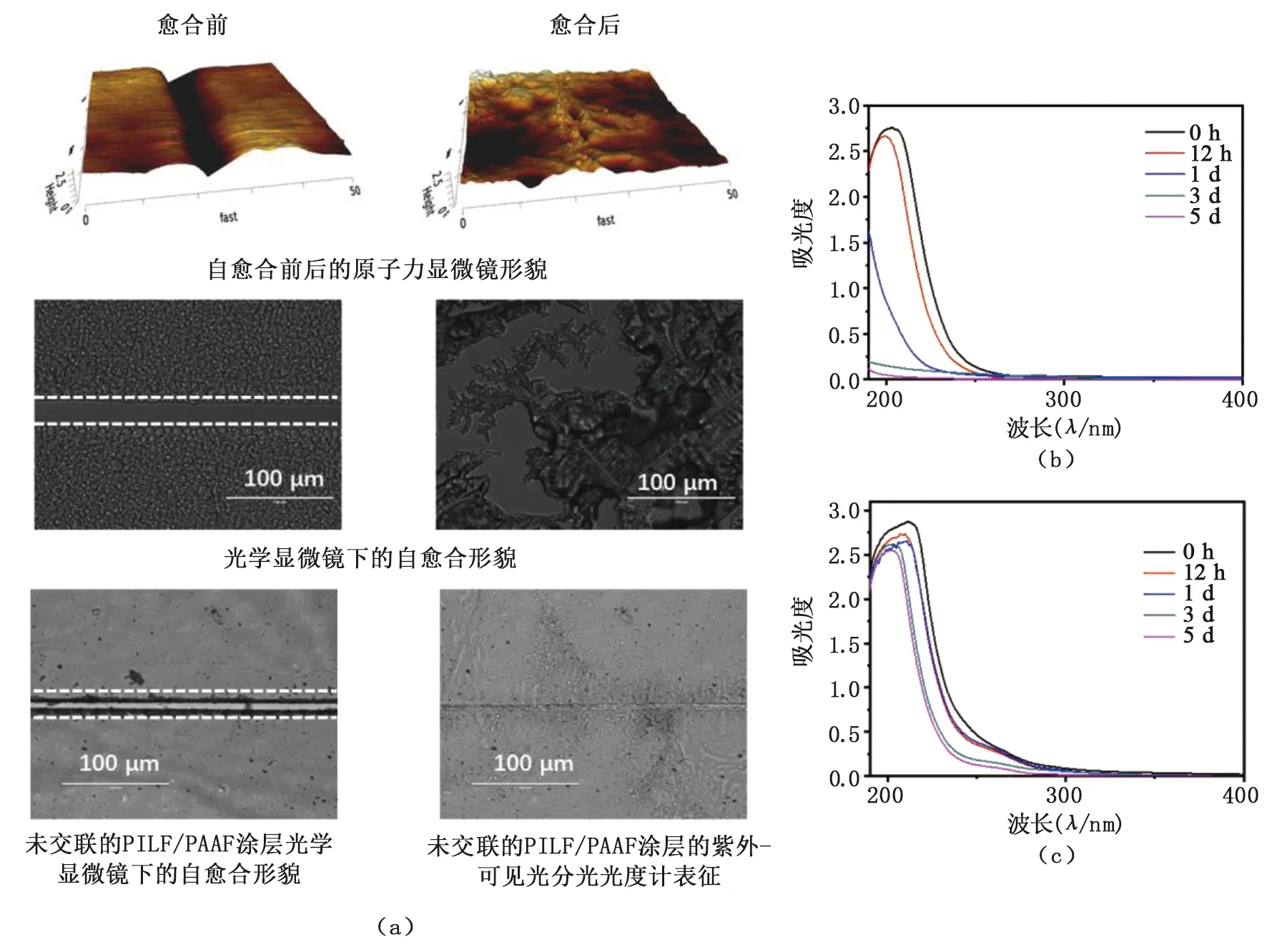
圖4 (a). C-PILF/PAAF涂層的自愈合性能;(b).未交聯的PILF/PAAF涂層的穩定性;(c).交聯后的C-PILF/PAAF涂層的穩定性
自組裝涂層的長期穩定性在醫療器械的臨床使用中至關重要,不僅可延長其使用壽命,還能降低使用成本。將修飾有未交聯的自組裝涂層PILF/PAAF與交聯后的自組裝涂層C-PILF/PAAF的石英片浸泡在PBS溶液中,通過紫外-可見光分光光度計證明了未交聯的自組裝涂層PILF/PAAF在1 d后從基材表面脫落,而交聯的自組裝涂層C-PILF/PAAF在5 d內均保持較好的穩定性,見圖4。
2.3 自組裝涂層的抗菌活性和細胞相容性測定
通過對金黃色葡萄球菌和大腸桿菌菌落數的統計,評價自組裝涂層表面的體外抗菌活性,見圖5(a)、(b)。在7 d內,附著在不銹鋼片內的金黃色葡萄球菌和大腸桿菌逐漸增加,而涂覆有交聯自組裝涂層C-PILF/PAAF 的不銹鋼片,菌落數明顯少于無涂層的不銹鋼片。通過式(1)可得,交聯自組裝涂層C-PILF/PAAF在7 d內對金黃色葡萄球菌的菌落數平均減少了1.74 lgCFU/(殺菌率98.2%),對大腸桿菌的菌落數平均減少了1.19 lgCFU/(殺菌率93.6%),具有持續抗菌的性能。這是由于自組裝涂層最外層的咪唑鹽聚離子液體既是陽離子聚電解質層,又是高效的抗菌劑,具有較強的正電荷效應,結合表1交聯自組裝涂層C-PILF/PAAF的表面Zeta電位為8.14 mV,能有效破壞細菌細胞壁和細胞膜[18]。
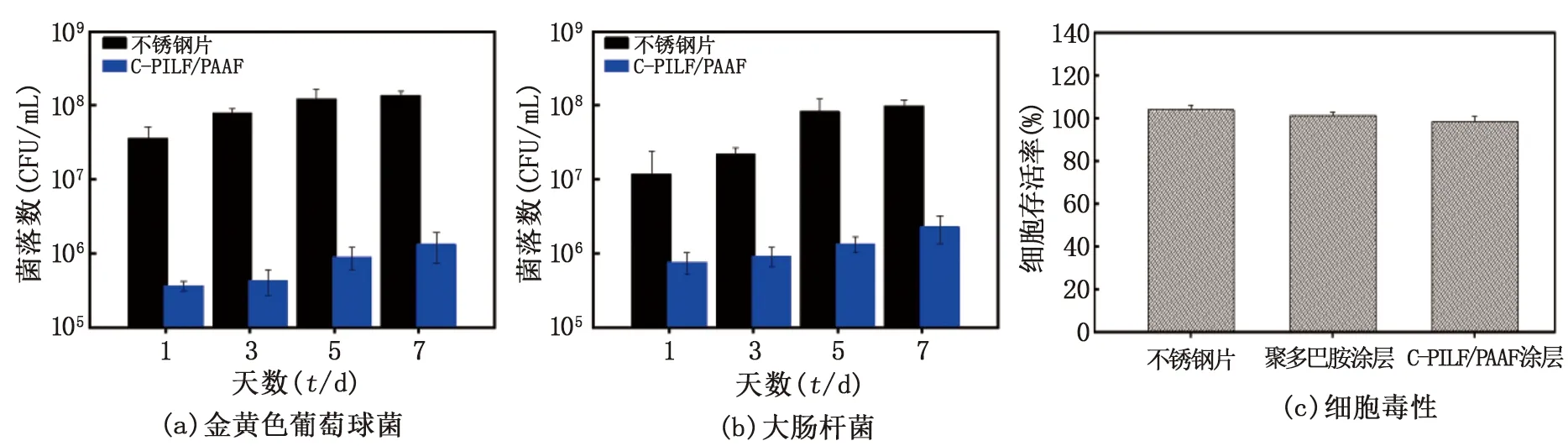
圖5 7 d內菌落數統計及其細胞毒性對比
使用MC3T3-E1細胞評價自組裝表面涂層的細胞相容性。圖5(c)中的MTT檢測所示,涂覆自組裝表面涂層的不銹鋼片具有良好的細胞存活率,達到90%左右,證明了C-PILF/PAAF涂層不僅具有較高的抗菌活性,還具有較低的細胞毒性。
3 結論
本研究以咪唑鹽聚離子液體抗菌劑作為聚陽離子電解質層和抗菌聚合物,與聚陰離子電解質層聚丙烯酸,采用層層自組裝技術在不銹鋼片表面構建多層結構,并通過Diels-Alder技術使用MPEG將聚電解質層交聯,由此制成具有自愈合性能和長期穩定特性的涂層。通過體外生物評價證明,所構建的自組裝涂層具有良好的持久抗菌能力和較低的生物毒性,該方法將為抑制生物醫療器械在臨床使用過程中的細菌感染提供有效策略。

