正方形力學約束對微組織非均一性的影響*
竇婷, 鄧林紅△, 王翔△
(1.常州大學 生物醫學工程與健康科學研究院,常州 213164;2.常州大學 藥學院,常州 213164;3.常州大學 生物與食品工程學院,常州 213164)
0 引言
生物組織是一種復雜、非均一的結構[1-2]。因膠原纖維排列不同而顯示出不同的致密化水平和硬度[3]。由高度排列的I型膠原組成的肌腱組織硬度高[4-5],而由各向同性的膠原纖維組成的組織,如肝[6]、腎[7]或動脈壁[8]等,相對更柔軟。組織硬度是調節細胞功能(如干細胞分化[9],癌癥侵襲[10]和纖維化進展[11])的重要生物力學因素之一。較軟基質[12]有利于間充質干細胞分化為神經元細胞;中等硬度促進肌源性分化;硬質基質促進成骨分化[13];血管的生成受基底硬度調節[4];腫瘤細胞簇[14]通常包裹于致密而堅硬的細胞外基質中,并以此充當屏障,免受化療藥物的影響[15]。故此,對組織內部結構致密化水平的研究具有重要的生物學和醫學意義。
力學微環境是組織非均一性結構形成的重要調節因素[16-17]。在無外界力學約束的情況下,微組織自由收縮。其中,細胞和膠原蛋白呈隨機分布。在由四個微柱構成的垂直雙軸約束條件下[18],微組織缺乏單向的細胞和基質纖維排列,因此,保持機械各向同性[19]。而雙微柱裝置[20]產生的單軸力學約束,可誘導微組織在約束方向上形成與各向異性相關的細胞和纖維排列[4,21]。因此,可通過改變培養過程中的力學邊界條件來控制微組織致密化[22]過程中基質的各向異性。但是,閉合二維邊界條件如何影響微組織的非均一性結構形成,尚不清楚。本研究設計并制備了一種正方形聚二甲基硅氧烷(polydimethylsiloxane,PDMS)微弦裝置。該閉合邊界條件可產生非均一的力學約束。實驗結果表明,PDMS微結構上的3T3和膠原混合物在48 h后,自發收縮形成穩定的微組織。在不同約束區域中,細胞排列及細胞外基質均具有明顯差異,且導致不同的大分子通透性。
1 材料與方法
1.1 材料、試劑與儀器
Sylgard 184(Dow Corning公司);三氯(1H,1H,2H,2H-全氟辛基)硅烷、鬼筆環肽(Af647-Phalloidin)、4 kDa、40 kDa (FITC-dextran)葡聚糖(Sigma公司);聚乙烯醇(polyvinyl alcohol,PVA),單分散熒光微球(阿拉丁生化科技股份有限公司);鼠尾I型膠原 (Advanced Biomatrix公司);杜氏改良培養基 (dulbecco′s modified eagle medium,DMEM)、胎牛血清(fetal bovine serum,FBS)、青霉素、鏈霉素及胰蛋白酶 (Gibco公司);硅脂 (Baysilone公司);細胞增殖試劑盒 (碧云天生物技術有限公司);Fibronectin Rabbit Polyclonal Antibody (Abcam公司)。
CO2細胞培養箱(Thermo公司);生物安全柜(BSC-1304ⅡA2,蘇州安泰空氣技術有限公司);倒置熒光顯微鏡、激光共聚焦顯微鏡(LSM 710)(德國 Zeiss公司);原子力顯微鏡(JPK Nanowizard3,德國Bruker公司);等離子清洗機(Potentlube PT-5S,深圳三和波達機電科技有限公司)。
1.2 方法
1.2.1PDMS微弦的制備 首先,將Sylgard 184和交聯劑以10∶1比例混合并澆筑在硅模具上,高溫固化后得到PDMS微弦負模。再將PDMS負模表面涂布1% PVA的脫模劑。將PDMS預聚物加入負模的微槽內,80 ℃固化4 h后,正方形微弦四角位置粘合4個2 mm高的PDMS圓形支持塊。四個支持塊通過等離子處理,鍵合于一個18 mm圓形蓋玻片上。將裝置浸泡在水中過夜后,剝離反模得到PDMS微弦結構。最后將微弦裝置放置于12孔培養皿中備用。
1.2.2細胞及微組織培養 NIH-3T3成纖維細胞(7-12代)培養于含10%胎牛血清的高糖DMEM中,置于37 ℃、5% CO2培養箱。I型膠原蛋白經pH中性調解后與一定數量的細胞混合,得到終濃度為106細胞/mL和2 mg/mL膠原蛋白的混合物。4 ℃條件下,將20 μL細胞膠原混合物滴加于微弦中央位置,轉移至培養箱固化50 min后,再向培養孔板中加入2 mL培養基,然后置于培養箱或顯微鏡下進行長期成像。
1.2.3微弦收縮的力學仿真計算 使用COMSOL Multiphysics模擬正方形微弦因微組織收縮而產生的應力分布。微組織收縮48 h后獲取圖像中一條微弦邊界的形變進行函數擬合,得到y=(-6E-05)x2+0.205 9x+286.96為微弦的應變函數。設置微弦內區域為可壓縮超彈性材料 (密度為1 kg/m3,楊氏模量為380 Pa,Neo-Hookean模型),建立平面應力模型計算。
1.2.4微組織的活細胞成像及透光率變化測量 倒置熒光顯微鏡的多點成像載物臺可同時對12孔板內的多個微組織目標進行長時自動成像。顯微鏡的環境維持在37 ℃和5% CO2。使用5×/0.16 NA物鏡和ORCA-Flash 4.0相機(日本濱松)進行相成像(1 h/幀)。使用Image J測量不同時間正方形微組織對角線之間的灰度值變化,量化微組織不同區域的透光率。
1.2.5細胞增殖檢測 微組織培養48 h后,加入10 μM的EDU(5-乙炔基-2′-脫氧尿苷)增殖試劑[23]孵育12 h,將EDU結合到新合成的DNA中。微組織經固定、通透化處理后,加入反應液,室溫避光染色3 h;加入Hoechst溶液,室溫避光染色1 h;最后使用3% BSA洗滌3次/5 min。用Zeiss 710共聚焦顯微鏡于10×/0.3 NA或20×/0.5 NA物鏡下分別在綠色(488 nm)和藍色(405 nm)通道對微組織3D成像。使用Image J對圖像進行高斯處理,對微組織100 μm深度的區域進行量化分析,計算單位面積下EDU陽性和細胞總數的比率。
1.2.6熒光成像和圖像分析 微組織培養48 h后,對其固定、通透化和封閉處理。使用結合Alexa Fluor Plus 647的鬼筆環肽(phalloidin-AF647)與DAPI對F-actin和細胞核室溫避光染色3 h,最后使用PBS洗3次/10 min。用Zeiss 710共聚焦顯微鏡于20×/0.5 NA物鏡下,分別在紅色(633 nm)和藍色(405 nm)通道對微組織3D成像。使用Image J對微組織100 μm深度區域的細胞排列分布和細胞核密度進行量化分析。
微組織纖連蛋白(Fibronectin)免疫熒光染色:微組織培養48 h后,對其固定、通透化和封閉處理,FN一抗4 ℃冰箱孵育過夜。使用PBS洗3次/5 min,AF488 G-ANTI-Rb二抗室溫孵育4 h。再用結合Alexa Fluor Plus 647的鬼筆環肽(phalloidin-AF647)與DAPI對F-actin和細胞核室溫避光染色3 h,最后使用PBS洗3次/10 min。用Zeiss 710共聚焦顯微鏡于10×/0.3 NA物鏡下,分別在綠色(488 nm)、紅色(633 nm)和藍色(405 nm)通道對微組織3D成像。通過Image J將微組織Z軸進行投影成像,量化組織內部到組織邊界的熒光強度。
1.2.7微組織楊氏模量測量 微組織培養48 h后,使用0.5% TritonX-100室溫處理1 h,去除細胞活性。將微組織取下并反向粘在載玻片上(注意微組織的距離與初始狀態相同),用AFM探針(MLCT-O10)對樣品進行壓痕實驗。設定在50×50 μm范圍內采集4×4個測點,在每個微組織直角和中心區域取3~5個位置進行測量,得到力-距離曲線。用JPK數據處理軟件確定微組織的彈性模量。
1.2.8FITC-葡聚糖擴散檢測 制備細胞膠原混合物時,加入0.5%的單分散熒光微球(546 nm),用于標記微組織輪廓。微組織培養48 h后,分別加入0.5 mg/mL的4 kDa或40 kDa FITC葡聚糖分子。用Zeiss 710共聚焦顯微鏡于10×/0.3 NA 物鏡下分別在紅色 (561 nm)和綠色(488 nm)通道對微組織3D成像。使用Image J對微組織100 μm深度的區域進行量化分析,計算其相對熒光強度(1 h時微組織的熒光強度/10 min微組織的熒光強度)。
2 結果
2.1 正方形微弦約束下微組織的形成
為了解生長在正方形微弦上的微組織受力情況,對微弦裝置進行力學仿真計算。由圖1(a)左圖可知,對正方形微弦加載收縮力后,正方形直角區域產生較高的應力,而正方形中心區域的張力較小。因此,正方形內應力呈非均一分布,可誘導微組織非均一結構的生成。在成功制備懸空的正方形PDMS微弦裝置后(見圖1(a)右圖),將細胞-膠原混合物加載到正方形微弦中,并進行活細胞時間成像。由圖1(b)可知,微組織在成纖維細胞的作用下持續收縮,48 h后形成一個近似正方形的微組織結構。微組織內部的透光率由于致密化而逐漸下降。其中,直角區域的透光率低于中央區域(見圖1(c)),提示微組織逐漸形成了非均一結構。
2.2 微組織內細胞的非均一性
為進一步研究該微組織的非均一性,本研究首先聚焦于微組織內細胞的空間分布。通過用熒光鬼筆環肽核標記細胞微絲骨架,發現在正方形微組織的直角區域,細胞排列顯示出高度的各向同性,與張力呈90 °分布。而在微組織中心區域,細胞則呈各向異性排列,見圖2(a)。此外,本研究還通過細胞核染色對微組織不同區域的細胞密度進行了測量,結果顯示,兩區域中細胞個數基本在380左右,其細胞分布無顯著性差異,見圖2(b)。
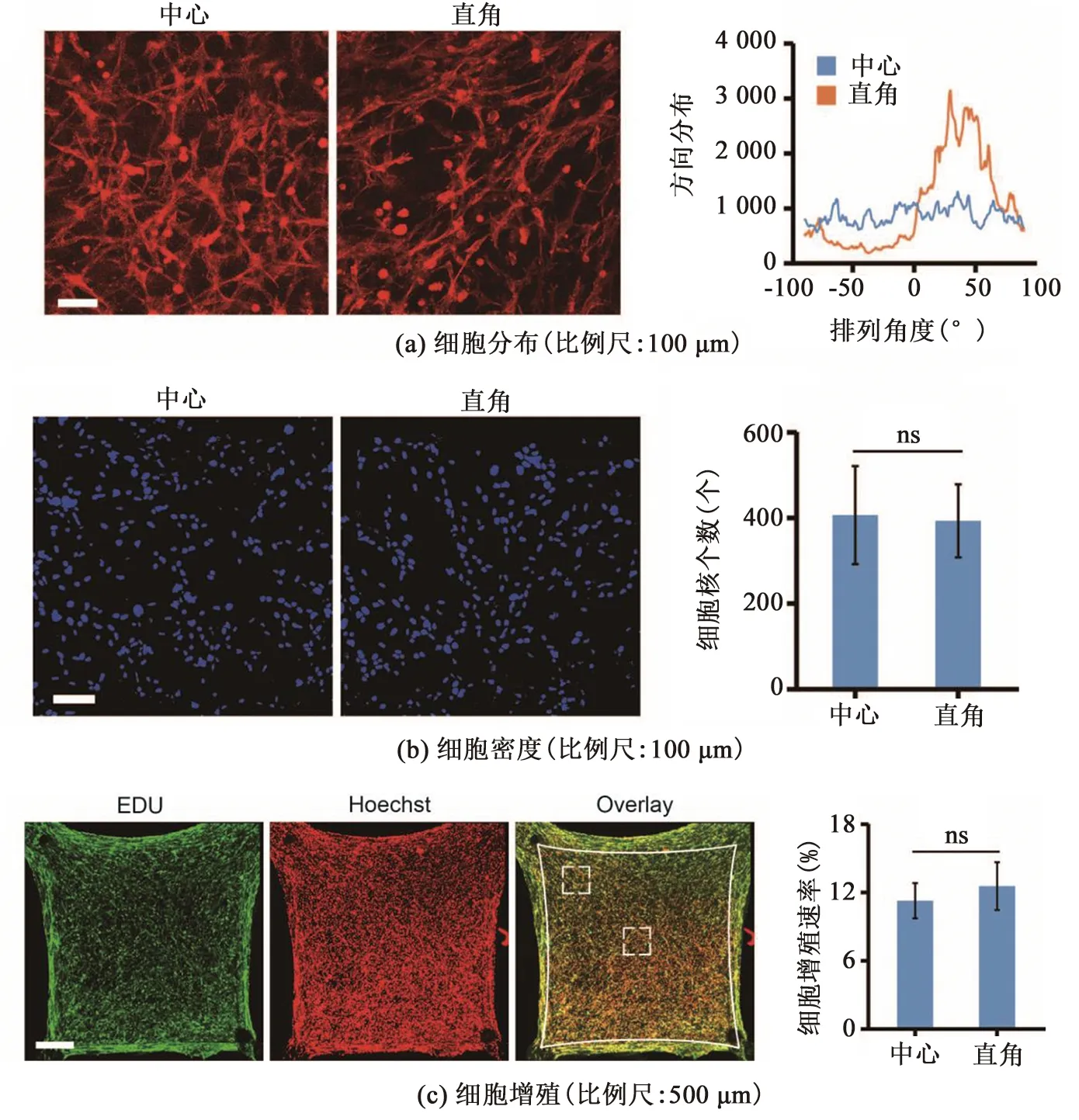
圖2 微組織不同區域內細胞的非均一性
為研究力學約束是否影響微組織內細胞增殖的速度,在正方形微組織收縮培養48 h時,本研究使用EDU標記增殖細胞的DNA。圖2(c)中,實線框表示微弦的位置,虛線框表示微組織內的直角和中心區域。共聚焦成像顯示,微組織邊界區域的EDU陽性率高。通過計算EDU標記的細胞核與總細胞核數量的比值,對細胞增殖進行定量分析,結果顯示,微組織直角區域的細胞增殖率為12.37%,中間區域的細胞增殖率為11.08%,無顯著性差異。
2.3 微組織內細胞外基質的非均一性
為表征微組織內細胞外基質的非均一性,本研究對細胞產生的纖連蛋白(Fibronectin)進行測定。圖3(a)中,實線表示微弦的位置,虛線框表示熒光強度的位置。免疫熒光成像顯示,微組織中心區域到直角區域的纖連蛋白的熒光強度逐漸增加。由圖2(b)可知,中心區域到直角區域中細胞數量接近,直角區域的纖連蛋白水平較高,可能是由于該區域內細胞產生了較多的纖連蛋白。
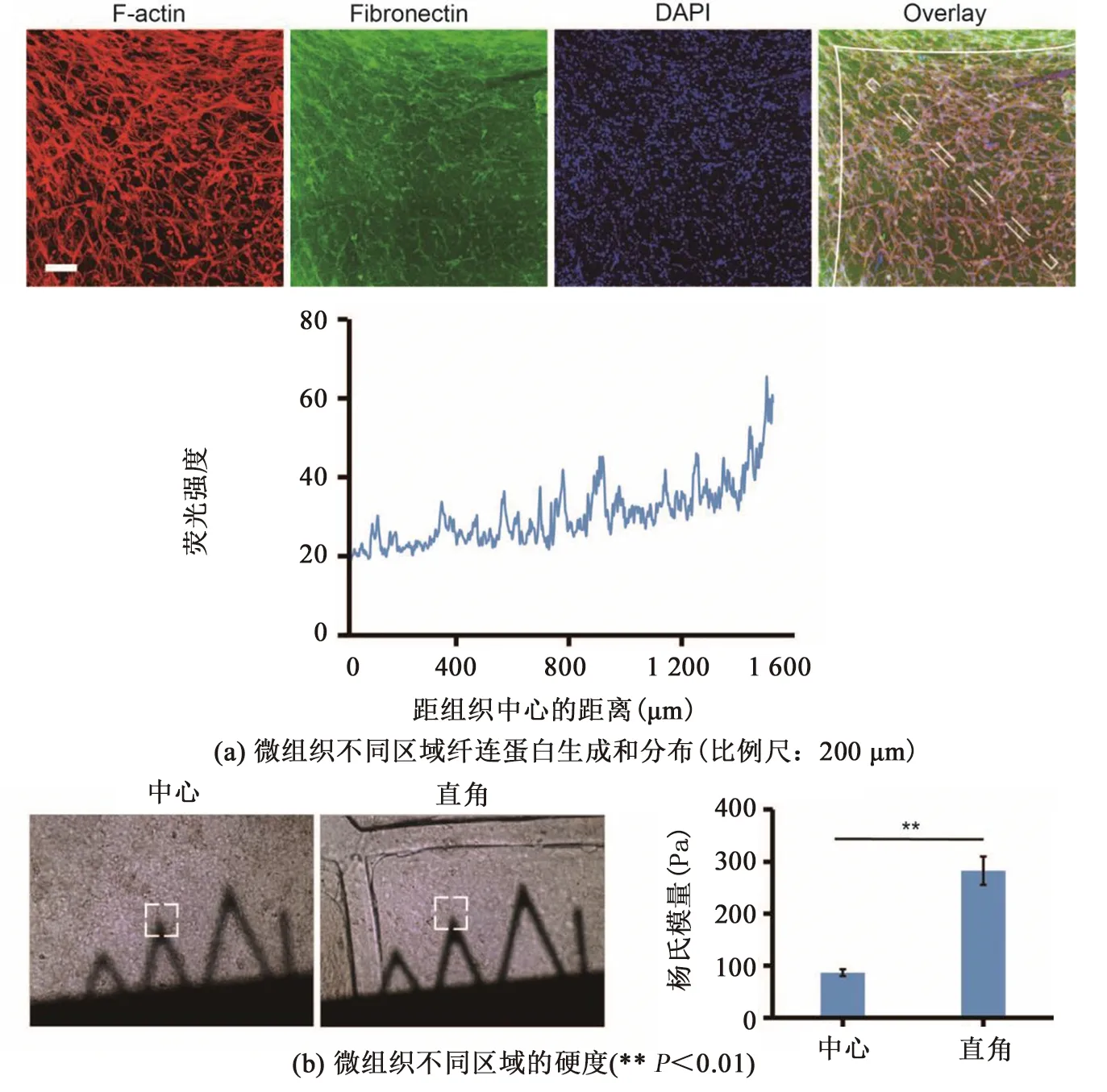
圖3 微組織內細胞外基質的非均一性
組織硬度是反映細胞外基質致密化水平的重要力學指標。因此,本研究使用AFM探針分別對微組織的直角區域和中心區域進行壓痕實驗,測量其楊氏模量,見圖3(b)。實驗結果表明,微組織直角區域楊氏模量為378.04 Pa,比中心區域的楊氏模量113.59 Pa高出2倍左右,證明微組織直角區域的致密化程度高于中央區域。
2.4 微組織非均一性對分子擴散的影響
上述研究證實正方形力學約束可導致微組織內非均一結構的形成。為研究微組織非均一性對大分子擴散的影響,本研究向微組織培養基中加入熒光標記的葡聚糖,使用共聚焦顯微鏡分別對微組織不同區域內100 μm深的區域進行成像,見圖4(a)。通過定量分析10~60 min微組織的熒光變化,發現4 kDa葡聚糖在微組織中心區域的擴散速度高于直角區域,見圖4(b),說明對比力學約束低的區域,力學約束高的大分子通透性更高。然而,40 kDa葡聚糖的擴散速度不僅顯著低于4 kDa葡聚糖,在不同力學約束區域中也未顯示出明顯差異,表明力學約束對組織通透性的影響程度還取決于擴散物質的分子量。
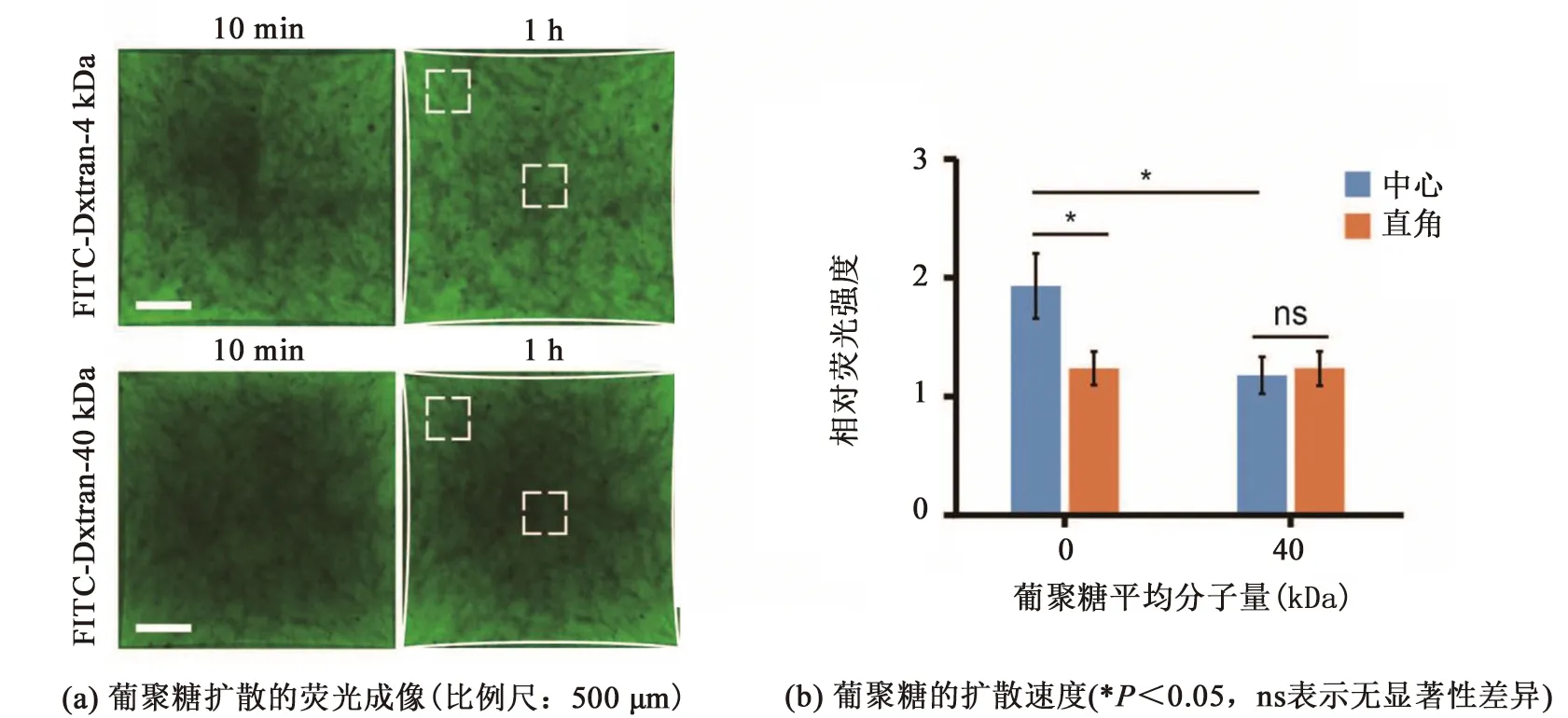
圖4 微組織非均一性對分子擴散的影響
3 結束語
胚胎發育及組織創傷愈合[24]過程中普遍存在致密組織的漸進形成[25],表現為短時間內劇烈的形態變化和組織剛度的提高[26]。該過程不僅受生化因子的調控,還受細胞的收縮力和微環境張力之間的平衡以及由此產生的復合力場的調控。本研究利用正方形PDMS微弦產生的力學約束誘導微組織形成非均一結構,從細胞及細胞外基質兩個角度對其非均一結構進行表征。結果顯示,3D環境中細胞排列受力學約束的調控,呈現出垂直于力場的各向同性分布現象,這可能是細胞為減少機械牽拉而作出的適應性反應。此外,細胞密度和增殖在不同力學約束條件下,未發生明顯變化。在對細胞外基質研究中,纖連蛋白豐度及微組織硬度都顯示出與力學約束的相關性,即較高的力學約束會導致較高的組織致密化水平。組織致密化不僅參與組織發育和修復,還與腫瘤等病理過程密切相關。過度致密化的細胞外基質會阻礙分子擴散,進而影響大分子藥物接近靶細胞[15]。本研究使用熒光標記的葡聚糖[27]模擬大分子藥物,發現4 kDa的大分子在微組織低力學約束區域具有較高的擴散速度,在高力學約束區域的擴散速度降低至與40 kDa的大分子相當的水平。該結果將有助于后續進一步了解大分子藥物在組織內的傳遞。

