甘薯葉片綠原酸及其抗氧化活性的基因型差異
羅青青,陳培濤,宗繼錯,傅玉凡,趙騰飛,徐元江,高紀龍,秦瑞華
1. 西南大學 生命科學學院/重慶市甘薯工程技術(shù)研究中心,重慶 400715;2. 重慶市中藥研究院,重慶 400065
甘薯[Ipomoeabatatas(L.) Lam.]種植于世界上熱帶和亞熱帶地區(qū)的100多個國家, 是世界上最重要的糧食作物之一[1]. 已有研究表明甘薯莖葉中富含蛋白質(zhì)、 多酚、 黃酮、 花青素、 多糖和一些多功能營養(yǎng)素[2-3], 有益于人體健康, 如抗癌、 保肝、 抑菌、 抗艾滋病病毒和提高人體免疫力、 預防糖尿病和心血管病等[4-5]. 甘薯種植主要收獲對象是塊根, 只有很少部分莖葉用于牲畜飼用和人類食用, 絕大多數(shù)被丟棄, 造成了極大的資源浪費[6].
酚類物質(zhì)是廣泛存在于植物中的膳食抗氧化劑, 甘薯葉中多酚化合物主要是綠原酸及其衍生物[7]. 綠原酸(Chlorogenic acid, CGA)是由咖啡酸(Caffeic acid)與奎寧酸(Quinicacid)生成的縮酚酸, 是植物體內(nèi)有氧呼吸過程中經(jīng)莽草酸途徑產(chǎn)生的一種苯丙素類次生代謝產(chǎn)物, 具有多種生物活性[8-9], 如抗氧化作用、 清除自由基、 抑菌作用、 抗病毒作用、 調(diào)節(jié)糖脂代謝、 免疫調(diào)節(jié)及抗腫瘤作用等[10-14]. 在甘薯葉中至少包括6種咖啡酰奎寧酸衍生物, 分別為單咖啡酰奎寧酸(CQA)的3種異構(gòu)體: 綠原酸(3-CQA)、 隱綠原酸(4-CQA)和新綠原酸(5-CQA), 以及3種二咖啡酰奎寧酸: 異綠原酸A(3,5-diCQA)、 異綠原酸B(3,4-diCQA)和異綠原酸C(4,5-diCQA). 甘薯CGA質(zhì)量分數(shù)主要取決于遺傳特性, 除此之外, 生育期對甘薯葉片中酚酸質(zhì)量分數(shù)也有較大的影響, 同一基因型葉片中的CGA質(zhì)量分數(shù)遠高于塊根[15-17].
甘薯莖葉提取物具有較強的抗氧化能力, 其抗氧化能力與莖葉中的CGA、 黃芪素和矢車菊素類化合物相關(guān), 其中與CGA及其衍生物的相關(guān)性最高[16,18-19]. 如Xu等[20]通過對蒲薯53葉提取物進行成分與抗氧化活性分析, 表明提取物抗氧化活性的主要生物活性化合物是多酚類, 尤其是CQA衍生物.
目前對于甘薯CGA的研究主要存在供試材料偏少的問題, 且大多研究薯塊, 對于較多基因型間CGA組分分析更為少見. 因此, 本研究通過高效液相色譜法(High Performance Liquid Chromatography, HPLC)對50個甘薯基因型葉片中CGA組分的質(zhì)量分數(shù)進行測定并對其抗氧化活性進行分析, 以期為甘薯高綠原酸、 高抗氧化活性種質(zhì)資源的篩選及功能莖葉品種的選育、 甘薯莖葉營養(yǎng)功能食品的開發(fā)利用奠定基礎(chǔ).
1 材料與方法
1.1 供試材料
供試的50個甘薯基因型來自西南大學重慶市甘薯工程技術(shù)研究中心合川農(nóng)場育種基地的育成品種或育成品系比較實驗. 供試基因型的編號、 名稱見表1.

表1 50個供試甘薯基因型的編號、 名稱
1.2 方法
1.2.1 取樣及樣品的制備
供試材料大田移栽100 d時, 取甘薯藤蔓自上而下第3~10片新鮮無病斑、 無腐爛的健康葉片, 用流水輕輕洗凈泥沙雜質(zhì)后, 自然晾干多余水分, 葉片于105 ℃殺青后, 60 ℃烘干至恒質(zhì)量, 粉碎, 過100目篩, -20 ℃密封保存?zhèn)溆茫?/p>
參照Zhang等[21]描述的方法, 略作修改. 精確稱取甘薯葉粉末0.05 g, 按料液比1∶100(g/mL)與70%乙醇混合, 于60 ℃下超聲提取1 h, 提取2次, 每次的提取液4 000 r/min離心40 min, 合并上清液, 經(jīng)0.22 μm醋酸纖維膜過濾, 濾液用于CGA質(zhì)量分數(shù)與組分測定及抗氧化能力研究.
1.2.2 CGA質(zhì)量分數(shù)與組分HPLC方法的建立
1.2.2.1 色譜條件: Agilent色譜柱(型號TC-C18, 250 mm×4.6 mm, 5 μm), 0.2%的甲酸(A)-乙腈(B)為流動相, 線性梯度洗脫: 0~5 min 為95%~90%B, 5~45 min為 90%~55%B, 45~50 min為95%B; 流速1 mL/min, 柱溫40 ℃, 進樣體積10 μL, 紫外檢測波長327 nm.
1.2.2.2 標準品溶液的制備: 3-CQA, 4-CQA, 5-CQA, 3,5-diCQA, 3,4-diCQA, 4,5-diCQA標準品購自美國Sigma-Aldrich公司, 分別稱定1.000 mg, 以70%乙醇溶解定容后進行系列稀釋, 分別配成5, 10, 20, 40, 60, 80, 100 μg/mL的系列混合標準品溶液.
1.2.2.3 系統(tǒng)性檢驗: 分別取混合標準品溶液和供試提取液, 按照1.2.2.1色譜條件各進樣10 μL, 記錄色譜圖, 分析各峰分離度, 記錄峰面積和保留時間, 計算相對標準偏差(Relative standard deviation, RSD)值以進行系統(tǒng)適用性實驗、 精密度實驗、 穩(wěn)定性實驗. 以濃度為橫坐標, 峰面積為縱坐標, 進行線性關(guān)系考察.
1.2.3 供試基因型的測定
將樣品提取液進樣10 μL, 按照1.2.2.1色譜條件進行進樣分析, 得到峰面積, 計算各組分的質(zhì)量分數(shù).
1.2.4 抗氧化能力的測定
1.2.4.1 ABTS自由基(SBTS+)清除能力測定: ABTS自由基清除實驗參考Re等[22]描述的方法, 將7 mmoL/L ABTS+溶液與2.45 mmoL/L的K2S2O8溶液1∶1混合過夜反應得到ABTS+儲備液. 將儲備液稀釋至在734 nm處達到0.7±0.02的吸光度以得到ABTS+工作液. 取0.4 mL提取液與3.6 mL ABTS+溶液混合, 室溫反應20 min, 于734 nm波長下在酶標儀上測定吸光值, 并根據(jù)水溶性維生素E(Trolox)制成的標準曲線(Y=0.226 4X+0.531 6,R2=0.999 1)計算清除能力.
1.2.4.2 DPPH自由基清除能力測定: DPPH自由基清除能力實驗參照Yamaguchi等[23]實驗方法, 取提取液2 mL與2 mL 0.2 mmoL/L 的DPPH 溶液混合, 室溫避光反應 30 min, 于 517 nm 波長下測其吸光值, 并根據(jù)Trolox制成的標準曲線(Y=0.121X+5.684 4,R2=0.999 9)計算清除能力.
1.2.4.3 FRAP鐵離子還原能力測定: 鐵離子還原能力的測定參考Thaipong 等[24]描述的方法, 配制0.3 mol/L的醋酸緩沖液(pH值為3.6), 10 mmoL/L TPTZ, 20 mmoL/L FeCl3, 按 10∶1∶1 的比例混合配制 FRAP試劑. 取提取液 0.4 mL 與 3.0 mL FRAP 試劑混合, 室溫反應 10 min, 于 593 nm 波長下測定吸光值, 并根據(jù)Trolox制成的標準曲線(Y=0.002 5X+0.105 2,R2=0.999)計算鐵離子還原能力.
1.2.5 數(shù)據(jù)處理
所有測定實驗均獨立重復3次. 采用Microsoft Excel 2021軟件整理數(shù)據(jù), 采用SPSS 26.0軟件、 Origin 2021軟件對數(shù)據(jù)進行分析和處理.
2 結(jié)果與分析
2.1 CGA質(zhì)量分數(shù)與組分的HPLC方法建立
2.1.1 適用性檢驗結(jié)果
標準品溶液與供試品提取液色譜條件進樣分析結(jié)果顯示, 在該色譜條件下, 3-CQA, 4-CQA, 5-CQA, 3,5-diCQA, 3,4-diCQA和4,5-diCQA的組分間的分離和各個組分的基線分離均良好, 供試品色譜峰與標準品色譜峰的保留時間一致, 說明本方法專屬性良好. 圖1為CGA標準品混合液和代表性基因型的HPLC圖譜.

圖1 CGA標準品混合液及代表性基因型的HPLC圖譜
2.1.2 線性關(guān)系
以濃度為橫坐標, 峰面積為縱坐標進行線性關(guān)系擬合, 結(jié)果顯示6個標準品在5~200 μg/mL濃度范圍內(nèi)線性關(guān)系良好(表2).

表2 6個供試CGA標準品線性關(guān)系擬合
2.1.3 精密度實驗
取混合標準品溶液, 按照1.2.2.1色譜條件連續(xù)進樣6次, 6種標準品峰面積的RSD值分別為0.08%, 0.23%, 0.46%, 0.39%, 0.14%, 0.31%, 表明儀器精密度良好.
2.1.4 穩(wěn)定性實驗
取標準品溶液, 分別于0, 2, 4, 6, 8, 12, 24 h進樣10 μL, 6種標準品峰面積的RSD值分別為0.09%, 0.31%, 0.48%, 0.41%, 0.12%, 0.28%, 表明標準品溶液在24 h內(nèi)穩(wěn)定性良好.
2.2 甘薯葉片中的CGA各組分質(zhì)量分數(shù)與占比分析
供試基因型葉片中5-CQA, 3-CQA, 4-CQA, 3,4-diCQA, 3,5-diCQA, 4,5-diCQA組分和總CGA的質(zhì)量分數(shù)統(tǒng)計分析結(jié)果表明, 50個基因型葉片均有6種CGA組分, 每100 g干物質(zhì)中CGA總質(zhì)量分數(shù)介于310.34~5 033.86 mg之間, 變異系數(shù)為50.17%, 平均值為2 398.48 mg, 基因型間差異達到統(tǒng)計學意義(表3). 以基因型S1(18-11-4), S2(18-11-5)和S3(161837)最高, 每100 g干物質(zhì)中CGA質(zhì)量分數(shù)分別為5 033.86 mg, 4 949.57 mg, 4 941.80 mg, S49(福薯7-6)和S50(2019-1-15)最低, 分別為504.65 mg, 310.34 mg.

表3 50個甘薯基因型葉片CGA各組分質(zhì)量分數(shù)的統(tǒng)計分析
各CGA組分在總質(zhì)量分數(shù)中占比的統(tǒng)計分析結(jié)果表明, 3,5-diCQA, 3,4-diCQA和3-CQA共3種CGA組分是50個基因型葉片綠原酸的主要成分, 其質(zhì)量分數(shù)在總質(zhì)量分數(shù)中的占比平均值分別為35.36%, 22.98%和21.54%, 三者總占比為79.88%. 其次為4,5-diCQA, 4-CQA和5-CQA占比較小, 后兩者不足10%(表4).
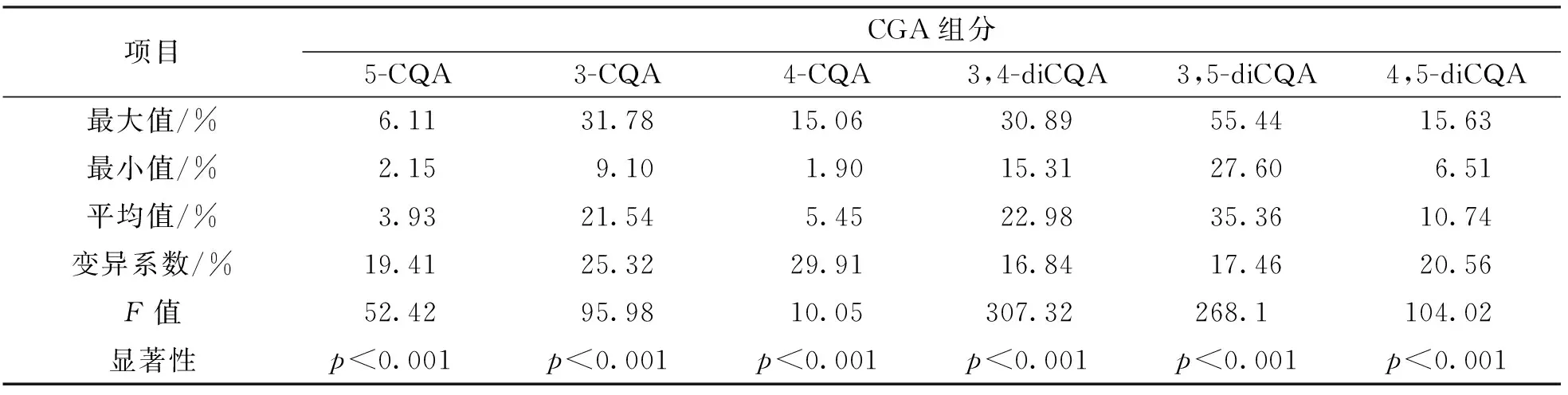
表4 50個甘薯基因型葉片CGA組分占比的統(tǒng)計分析
2.3 抗氧化活性的測定
CGA標準品不同單體的抗氧化能力測定結(jié)果表明, 6種CGA單體的3種綜合抗氧化能力由高到低依次為4,5-diCQA, 3,5-diCQA, 3,4-diCQA, 3-CQA, 4-CQA, 5-CQA(表5).

表5 CGA不同單體的抗氧化能力統(tǒng)計分析
50個甘薯基因型葉片提取物抗氧化能力測定結(jié)果的統(tǒng)計分析表明, 葉片提取物的ABTS, DPPH自由基清除能力和FRAP鐵離子還原能力在50個基因型間差異有統(tǒng)計學意義, ABTS, DPPH自由基清除能力和FRAP鐵離子還原能力最高基因型分別為最低基因型的5.06, 7.08和9.75倍(表6).

表6 50個甘薯基因型葉片抗氧化能力的統(tǒng)計分析
3種抗氧化指標排名前5的基因型及其Trolox當量(TE)見表7, 綜合顯示基因型S8, S10, S3和S1的綜合抗氧化能力較強.

表7 抗氧化能力排名前5基因型及其Trolox當量(TE)
2.4 主成分分析及相關(guān)性分析
對50個基因型甘薯CGA各組分質(zhì)量分數(shù)及在總質(zhì)量分數(shù)中的占比, 3種抗氧化能力共計15個指標進行的主成分分析(Principal components analysis, PCA)表明, 6個CGA組分質(zhì)量分數(shù)在總方差中貢獻率達到95.48%, 其中5-CQA特征值為7.86, 方差貢獻率達到52.39%. 15個指標可簡化為特征值大于1的4個獨立成分, 方差貢獻率分別為51.33%, 18.68%, 10.09%和8.15%, 累計貢獻率為88.25%. 主成分1主要是6種CGA組分質(zhì)量分數(shù)指標, 載荷均高于0.90, 其次是ABTS, DPPH自由基清除能力和FARP鐵離子還原能力指標, 載荷值分別為0.84, 0.81和0.95; 主成分2主要是5-CQA, 3-CQA, 4-CAQ共3種CGA質(zhì)量分數(shù)占比的正向載荷和3,5-diCQA的負向載荷, 主成分3和主成分4分別是3,4-diCQA質(zhì)量分數(shù)占比和4,5-diCQA質(zhì)量分數(shù)占比的正向載荷. 50個基因型在這4個主成分上綜合得分值介于0.10~3.13之間, 排名前10的基因型由大到小依次為S1, S3, S4, S8, S5, S10, S7, S2, S9, S11, 其分值介于1.27~3.13之間. 指標間相關(guān)性分析表明, 抗氧化活性與CGA各組分質(zhì)量分數(shù)的占比不相關(guān), 而與CGA各組分質(zhì)量分數(shù)及總質(zhì)量分數(shù)呈極顯著正相關(guān)(數(shù)據(jù)略).
3 討論與結(jié)論
酚類物質(zhì)是植物界廣泛存在的膳食抗氧化劑, 甘薯塊根和莖葉中的酚酸類化合物主要是CGA[25-26], 包括3種單咖啡酰奎寧酸和3種二咖啡酰奎寧酸以及1種三咖啡酰奎寧酸(3, 4,5-diCQA). Truong等[26]發(fā)現(xiàn)甘薯葉中的CGA質(zhì)量分數(shù)最高, 其次是薯皮、 全根和薯肉組織. 本文研究結(jié)果表明, 甘薯葉片中的3種單咖啡酰奎寧酸和3種二咖啡酰奎寧酸的質(zhì)量分數(shù)及其總質(zhì)量分數(shù)在基因型間差異有統(tǒng)計學意義, 與Truong等[26]、 Chen等[27]和Krochmal等[17]的研究結(jié)論一致. 本文中的基因型S1葉片CGA總質(zhì)量分數(shù)每100 g干物質(zhì)達到5 033.86 mg, 是基因型S50的16.22倍, CGA等功能物質(zhì)在品種之間的差異可能與在次級代謝物形成中起重要作用的遺傳因素有關(guān)[24]. 50個基因型葉片中雖然均存在6種CGA組分, 但是各個組分在總質(zhì)量分數(shù)中的占比在基因型間差異有統(tǒng)計學意義. 總體而言, 3,5-diCQA, 3,4-diCQA和3-CQA 3種CGA組分是本文50個基因型葉片CGA的主要組分, 這3種組分占比平均值分別為35.36%, 22.98%和21.54%, 三者總占比為79.88%, 趙珊等[28]研究13個甘薯基因型的組分也發(fā)現(xiàn), 3,5-diCQA, 3,4-diCQA和3-CQA為主要組分, 三者總占比為79.05%.
CGA具有較強的抗氧化能力[25]. 已經(jīng)有較多的研究表明甘薯葉片具有抗氧化活性和多種生理保健作用. 本文供試材料葉片提取物的ABTS, DPPH自由基清除能力和FARP鐵離子還原能力在50個基因型之間差異有統(tǒng)計學意義, 雖然這些基因型的抗氧化能力大小排序和CGA總質(zhì)量分數(shù)以及各組分質(zhì)量分數(shù)的排序不完全一致(乙醇提取物還含有其他非CGA活性成分), 但是抗氧化能力與CGA質(zhì)量分數(shù)之間總體上呈極顯著正相關(guān), 這與傅玉凡等[29]、 趙櫻等[30]對于甘薯CGA的DPPH清除能力與其質(zhì)量分數(shù)呈顯著或極顯著正相關(guān)的研究結(jié)果類似.
鑒于甘薯葉片遺棄浪費較大的產(chǎn)業(yè)現(xiàn)實以及可利用價值潛力, 有必要開展富含CGA葉類甘薯新品種選育或淀粉、 食用、 加工類品種葉片品質(zhì)改良的甘薯育種工作[31-32]. Ning 等[33]研究發(fā)現(xiàn)CGA的廣義遺傳率高達0.84, 因此進行富含CGA葉類甘薯新品種選育或品種改良理論上也是可行的. 種質(zhì)資源創(chuàng)新與利用是甘薯遺傳多樣性拓展的重要途徑, 是品種改良的基礎(chǔ)和保障. 許建華等[34-35]研究表明西蒙1號甘薯是藥用甘薯品種, 在臨床上對多種出血性疾病及胰島素非依賴型糖尿病有顯著療效, 其莖葉乙醇提取物還具有一定的體內(nèi)外抗腫瘤活性; Xi等[18]通過對渝紫薯7號和西蒙1號葉片中的多酚質(zhì)量分數(shù)和抗氧化活性的對比研究表明, 渝紫薯7號的多酚質(zhì)量分數(shù)(甘薯莖葉中的多酚主要是CGA[25-26])與抗氧化能力分別是西蒙1號的1.18, 1.28倍, 是一個優(yōu)異的富含CGA和高抗氧化能力的資源. 然而渝紫薯7號的CGA質(zhì)量分數(shù)與抗氧化能力在本文50個基因型中分別排名第43位與第42位, 因此本研究有機會篩選出較多的比渝紫薯7號更富含CGA和抗氧化能力更強的資源, 如基因型18-11-4, 161837, 170407, 18-6-33, 18-11-5的CGA質(zhì)量分數(shù)分別比渝紫薯7號高3.82, 3.75, 3.35, 2.99, 3.75倍, ABTS, DPPH自由基清除能力和FARP鐵離子還原能力分別比渝紫薯7號最少高出1.29倍, 1.84倍和1.82倍, 因此, 這些資源可用于高CGA、 高抗氧化能力葉類利用與開發(fā)的甘薯品種的選育與改良工作. 例如, 目前正在大力推廣的高淀粉甘薯渝薯27葉片中CGA總質(zhì)量分數(shù)每100 g干物質(zhì)中含2 078.90 mg, 可與葉富含CGA的淀粉資源18-11-5進行雜交育種篩選塊根淀粉質(zhì)量分數(shù)高、 同時葉片也富含CGA的新品種, 對渝薯27進行改良, 實現(xiàn)薯塊和葉片的綜合利用, 提高單位土地面積的甘薯產(chǎn)業(yè)效益.

