JNK通路介導的鐵死亡在三陰性乳腺癌細胞增殖及凋亡中的作用
張晨欣,周 昱
(佳木斯大學附屬第一醫院腫瘤科,黑龍江佳木斯 154002)
三陰性乳腺癌(triple negative breast cancer,TNBC)是雌激素受體、孕激素受體及人表皮生長因子受 體-2(human epidermal growth factor receptor 2,HER-2)表達均呈陰性的乳腺癌,具有發病年齡早、組織學級別高、復發和遠處轉移發生率高的特點,并且TNBC 無法從內分泌治療和抗HER-2 靶向治療中獲益,因此治療難度大、預后差[1-2]。c-Jun 氨基末端激酶(c-Jun N-terminal kinase,JNK)是絲裂原活化蛋白激酶家族的成員,以磷酸化形式發生激活后調控細胞增殖、存活、分化,在多種惡性腫瘤的發生發展中發揮重要作用[3-5]。已有研究[6]報道促進JNK 磷酸化(p-JNK)對TNBC 細胞具有抑制增殖和促進凋亡作用,但JNK發揮調控作用的分子機制尚不明確。
鐵死亡是一種鐵依賴性的程序性細胞死亡方式,具體指細胞內鐵過載造成脂質氧化物代謝失調、活性氧簇(reactive oxygen species,ROS)大量產生而引起的細胞死亡[7-9]。JNK 是鐵死亡的上游調控因素,有研究報道JNK磷酸化后激活鐵死亡并抑制卵巢癌細胞的增殖[10];也有研究報道鐵死亡激活后,TNBC細胞的增殖減弱、凋亡增強[11]。但JNK 在TNBC 細胞鐵死亡中的調控作用及生物學意義尚未見報道。基于此,本研究將通過臨床TNBC 樣本檢測及細胞實驗分析JNK 通路介導的鐵死亡在TNBC細胞增殖及凋亡中的作用。
1 材料與方法
1.1 組織樣本與細胞系
選擇2020 年1 月—2022 年5 月于佳木斯大學附屬第一醫院腫瘤科手術切除的105 例TNBC 癌組織和癌旁正常組織,納入標準:①經術后病理診斷為TNBC;②均留取TNBC 癌組織和距離病灶邊緣5 cm以上的癌旁正常組織;③臨床資料完整。排除標準:①術前接受過放化療、內分泌治療、靶向治療等;②既往有其他惡性腫瘤病史。
TNBC 細胞系MDA-MB-231 以及乳腺癌(非TNBC)細胞系MCF-7、SK-BR-3購自中國科學院上海細胞資源中心。
1.2 主要試劑與儀器
二甲基亞砜(dimethyl sulfoxide,DMSO)、JNK 激動劑ANISO、鐵死亡抑制劑Ferrostatin-1 均購自美國MCE 公司;CCK-8 法細胞增殖檢測試劑盒、TdT 介導的dUTP 原位切口末端標記(TdT-mediated dUTP nick end labeling,TUNEL)法細胞凋亡檢測試劑盒均購自上海碧云天生物科技公司;谷胱甘肽過氧化物酶(glutathione peroxidase,GSH)檢測試劑盒、超氧化物歧化酶(superoxide dismutase,SOD)檢測試劑盒、丙二醛(malondialdehyde,MDA)檢測試劑盒均購自南京建成生物研究所;總RNA 提取試劑盒、cDNA 第一鏈合成試劑盒、熒光定量PCR(quantitative real time PCR,qPCR)檢測試劑盒均購自北京天根生化科技公司;小鼠抗人JNK、p-JNK 特異性抗體購自CST 公司,小鼠抗人TFR1、GPX4特異性抗體購自Abcam公司。細胞培養箱購自美國Thermo公司,倒置顯微鏡購自日本尼康公司,凝膠成像系統購自上海天能公司。
1.3 試驗方法
1.3.1 Western blot 檢測癌組織中p-JNK、TFR1 和GPX4 蛋白的表達取TNBC 組織和癌旁組織各約30 mg,使用裂解液在冰上對組織進行裂解、提取蛋白,測定蛋白濃度后將含有30 μg 蛋白的樣本用于電泳。在聚丙烯酰胺凝膠中電泳分離蛋白,電轉硝酸纖維素膜后用5%脫脂牛奶室溫封閉1 h,4 ℃孵育JNK 一抗(1∶500 稀釋)、p-JNK 一抗(1∶500 稀釋)、TFR1 一抗(1∶800稀釋)、GPX4一抗(1∶1 000稀釋)或β-actin 一抗(1∶3 000 稀釋)過夜,次日用1∶2 000 稀釋的二抗室溫孵育1 h,最后在凝膠成像系統中曝光得到的條帶,以β-actin 為內參,計算p-JNK、TFR1、GPX4 蛋白的相對表達水平,并對3 種蛋白表達的相關性進行分析。
1.3.2 細胞培養和分組MDA-MB-231、MCF-7、SK-BR-3細胞分別在含有10%胎牛血清的培養基中貼壁培養,每2 d用0.25%胰蛋白酶消化傳代1次。傳代后的MDA-MB-231細胞進行分組給藥:對照組用含有體積分數為0.1% DMSO的培養基處理,JNK激動劑組參照文獻[10]用含有5 μmol/L ANISO 的培養基處理,鐵死亡抑制劑組參照文獻[12]用含有2 μmol/L Ferrostatin-1的培養基處理,激動劑+抑制劑組用含有5 μmol/L ANISO+2 μmol/L Ferrostatin-1 的培養基處理。每組均重復4 次,連續培養24 h。MCF-7 和SKBR-3 細胞用于和MDA-MB-231 對比,不進行JNN 激動劑或鐵死亡激動劑的處理。為了比較乳腺癌MCF-7、SK-BR-3細胞(非TNBC細胞株)與TNBC 細胞株MDA-MB-231 細胞中p-JNK、TFR1、GPX4 蛋白表達的差異,收集上述3 種細胞進行裂解后按1.3.1步驟對p-JNK、TFR1和GPX4蛋白的表達進行檢測。
1.3.3 MDA-MB-231 細胞增殖的檢測將MDAMB-231細胞以每孔1×104個接種在96孔培養板中分組處理24 h后每孔加入10 μL CCK-8試劑,孵育1 h后將培養板放入酶標儀,設置波長為450 nm 檢測吸光度,按照[D(450)對照組-D(450)實驗組]/D(450)對照組×100%計算細胞增殖抑制率。
1.3.4 MDA-MB-231 細胞凋亡的檢測將5×104個MDA-MB-231 細胞接種在48 孔培養板中處理24 h 后棄去培養基,PBS 沖洗2 遍后用4%多聚甲醛固定1 h,而后采用TUNEL試劑盒進行染色,用含DAPI的抗熒光淬滅封片液固定,在熒光顯微鏡下觀察4 個高倍視野(400 倍)中TUNEL 陽性染色細胞和DAPI 陽性染色細胞并計數,按下式計算細胞凋亡率。
細胞凋亡率=TUNEL陽性細胞數/DAPI陽性細胞數×100%
1.3.5 MDA-MB-231 細胞中GSH、SOD、MDA 的檢測MDA-MB-231 細胞接種在12 孔培養板中,分組給藥24 h后收集細胞。使用裂解液在冰上對細胞進行裂解,得到裂解液后GSH 采用比色法進行檢測、SOD采用羥胺法進行檢測、MDA采用硫代巴比妥酸法進行檢測,均按照試劑盒說明書進行操作。
1.3.6 MDA-MB-231 細胞中TFR1 和GPX4 表達的檢測將1×106個MDA-MB-231細胞接種在12孔培養板中,分組給藥24 h后收集細胞。一部分細胞用試劑盒提取細胞中的總RNA,采用cDNA 第一鏈合成試劑盒將提取得到的總RNA反轉錄為cDNA,用qPCR檢測試劑盒對cDNA 中的TFR1、GPX4 進行擴增檢測。qPCR 的體系為:cDNA 1 μL、試劑盒中反應混合液10 μL、上下游引物各0.6 μL,去離子水補足至20 μL。反應程序為:95 ℃預變性3 min,95 ℃、15 s,特異性退火(TFR1基因60 ℃、GPX4基因58 ℃)25 s,72 ℃、30 s,共進行40 個循環。反應結束后得到循環曲線及循環閾值(CT),以β-actin 為內參、按照公式2-ΔΔCT計算TFR1、GPX4的mRNA相對表達水平。另一部分MDA-MB-231細胞使用裂解液在冰上對細胞進行裂解檢測蛋白表達,后續操作過程同1.3.1。
1.4 統計學處理
采用SPSS 23.0 軟件進行統計學處理,計量資料以表示,兩組間比較采用配對樣本t檢驗,四組間比較采用單因素方差分析,兩兩比較采用LSD 法。P<0.05為差異有統計學意義。
2 結果
2.1 TNBC組織中p-JNK、TFR1和GPX4蛋白的表達
與癌旁組織比較,TNBC 組織中p-JNK、TFR1 蛋白的表達水平明顯降低(P<0.05),GPX4 蛋白的表達水平顯著升高(P<0.05),見圖1A 和B。經Pearson 檢驗,TNBC組織中p-JNK蛋白與TFR1蛋白的表達水平呈正相關(r=0.515,P<0.01,圖1C),p-JNK蛋白與GPX4蛋白的表達水平具有負相關關系(r=-0.442,P<0.01,圖1D)。
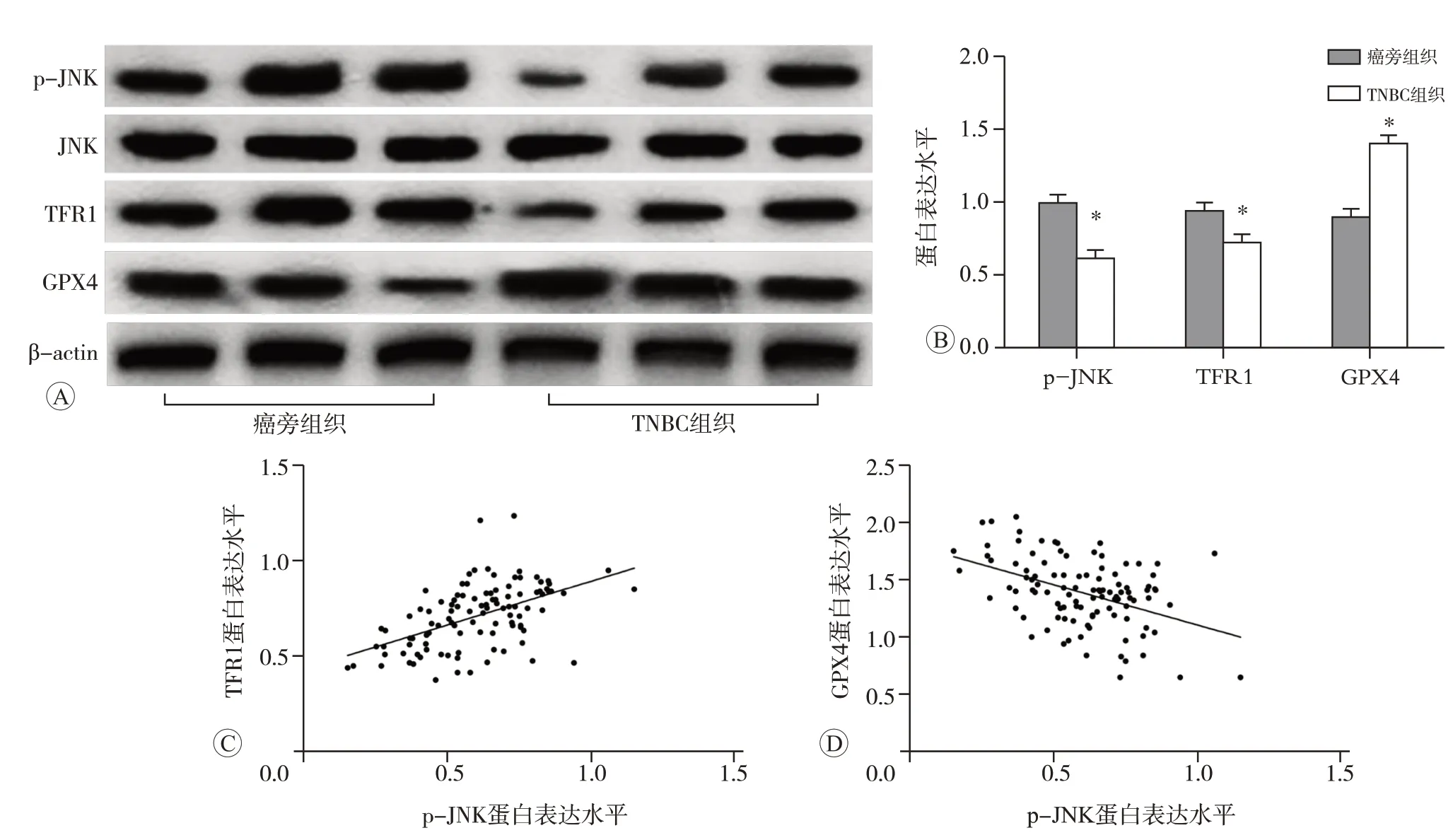
圖1 TNBC組織中p-JNK、TFR1和GPX4蛋白的表達
2.2 TNBC 細胞株中p-JNK、TFR1 和GPX4 蛋白的表達
結果見圖2,與乳腺癌MCF-7、SK-BR-3細胞(非TNBC 細胞系)比較,TNBC 細胞系MDA-MB-231 細胞中p-JNK 和TFR1 蛋白的表達水平明顯降低(P<0.05),GPX4 蛋白的表達水平顯著升高(P<0.05)。故后續試驗均在MDA-MB-231細胞中進行。
2.3 JNK 激動劑及鐵死亡抑制劑對TNBC 細胞增殖、凋亡及氧化應激水平的影響
結果見表1,與對照組比較,TNBC細胞的增殖抑制率和凋亡率在JNK 激動劑組均升高(P<0.05);鐵死亡抑制劑組無顯著變化(P>0.05);激動劑+抑制劑組居中,該組細胞的增殖抑制率和凋亡率低于JNK激動劑組、高于鐵死亡抑制劑和對照組(均為P<0.05)。與對照組比較,JNK 激動劑組TNBC 細胞中GSH 和SOD 活性均顯著降低(P<0.05),MDA含量升高(P<0.05);鐵死亡抑制劑組TNBC 細胞的GSH、SOD 活性及MDA 含量與對照組比較差異均無統計學意義(P>0.05);激動劑+抑制劑組GSH和SOD活性均高于JNK激動劑組而低于鐵死亡抑制劑組(P<0.05),MDA 含量低于JNK 激動劑組而高于鐵死亡抑制劑組,差異具有統計學意義(P<0.05)。

表1 JNK激動劑及鐵死亡抑制劑對TNBC細胞增殖、凋亡及氧化應激水平的影響(n=4,x±s)
2.4 JNK 激動劑及鐵死亡抑制劑對TNBC 細胞中TFR1和GPX4表達的影響
結果見圖3和圖4,與對照組比較,JNK激動劑組TNBC細胞中TRF1 mRNA和蛋白的相對表達水平均顯著升高而GPX4 mRNA 和蛋白的相對表達水平均顯著降低(均為P<0.05);鐵死亡抑制劑組細胞中TFR1 和GPX4 的mRNA 及蛋白相對表達水平與對照組比較差異均無統計學意義(P>0.05);激動劑+抑制劑組細胞中的TRF1 mRNA 和蛋白相對表達水平均低于JNK 激動劑組而高于鐵死亡抑制劑組,差異均具有統計學意義(均為P<0.05),GPX4的mRNA和蛋白相對表達水平均高于JNK激動劑組而低于鐵死亡抑制劑組,差異均具有統計學意義(均為P<0.05)。
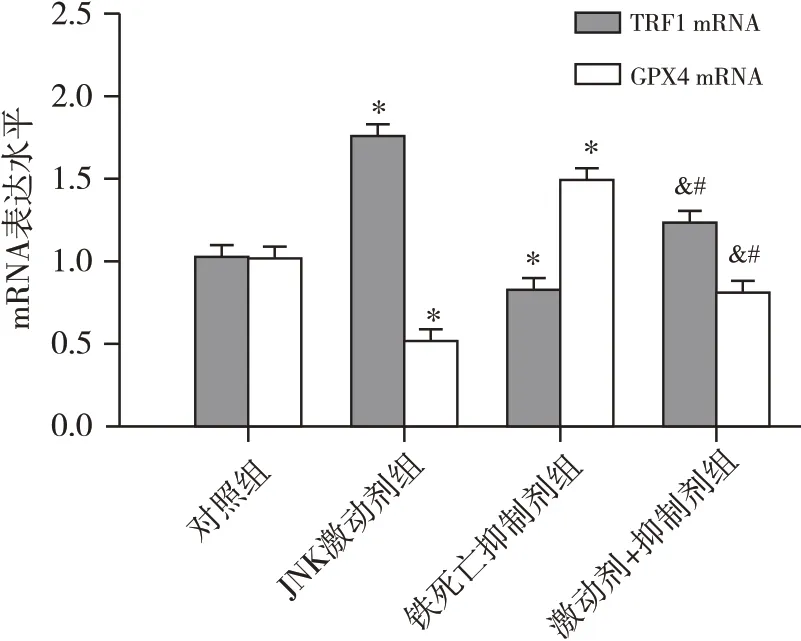
圖3 JNK 激動劑及鐵死亡抑制劑對TNBC 細胞中TFR1 和GPX4 mRNA表達水平的影響
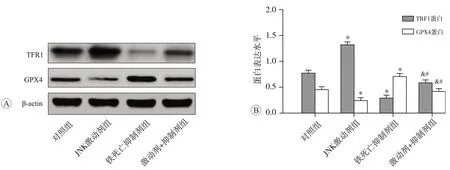
圖4 JNK激動劑及鐵死亡抑制劑對TNBC細胞中TFR1和GPX4蛋白表達水平的影響
3 討論
TNBC 具有侵襲性強、容易發生轉移和復發的特點,而且缺乏特異性治療靶點,治療效果欠佳,預后較差[13-15]。目前,TNBC分子機制不明確是制約其臨床診療的主要因素。因此,研究TNBC 發病的分子機制,發現新治療靶點具有迫切的臨床需求。
絲裂原活化蛋白激酶家族中的JNK 在細胞調控中起重要作用,磷酸化為p-JNK 后對細胞生長、分化、死亡均發揮調控作用。目前關于JNK通路在惡性腫瘤中的研究認為p-JNK起到抑癌作用,在多種惡性腫瘤組織中JNK 磷酸化不足、p-JNK 表達缺失,促進JNK磷酸化對癌細胞的生長和轉移均具有抑制作用[16-19]。本研究對TNBC 組織與癌旁組織中JNK 磷酸化水平的分析顯示,與對應的癌旁組織比較,TNBC 組織中p-JNK 的表達水平降低,提示JNK 磷酸化不足與TNBC 的發病有關;進一步在TNBC 細胞系MDAMB-231 中進行實驗,JNK 激動劑ANISO 處理后細胞的增殖抑制率及凋亡率均明顯增加,表明激活TNBC細胞系中JNK起到抑制增殖、促進凋亡的作用,進而提示JNK通路在TNBC的發病中起抑癌作用。
JNK 通路在細胞中參與內質網應激、細胞自噬、細胞鐵死亡等生物學環節的調控[20-23]。近些年乳腺癌相關的基礎研究認為鐵死亡異常可能是TNBC 發病的重要環節,誘導TNBC 癌細胞發生鐵死亡可以有效抑制乳腺癌的進程[6,24-25]。TFR1和GPX4是鐵死亡標志基因,既往研究發現TFR1 介導了三價鐵進入細胞并促進脂質過氧化物生成、導致鐵死亡的發生[26-27],GPX4能夠將有毒性的脂質過氧化物還原為無毒性的脂醇并抑制鐵死亡[28-30]。本研究對以上兩種鐵死亡標志基因的檢測結果顯示,TNBC 中TFR1 的表達降低且與p-JNK 呈正相關、GPX4 的表達增加且p-JNK 呈負相關,提示TNBC 病灶中鐵死亡受到抑制且可能受到上游JNK 通路的調控。本文進一步通過細胞實驗證實,JNK 激動劑ANISO 處理TNBC 細胞后TFR1 的表達增加、GPX4 的表達降低。這一結果表明激活JNK 使TNBC細胞的鐵死亡加劇,進而提示TNBC中JNK通路對鐵死亡具有促進作用。
為了深入認識JNK 調控鐵死亡在TNBC 細胞增殖和凋亡中的作用,本研究在JNK 激動劑處理TNBC 細胞的同時聯合使用了鐵死亡抑制劑,結果表明JNK激動劑+鐵死亡抑制劑聯用較單用JNK 激動劑抑制增殖、促進凋亡的作用明顯減弱,表明JNK 通路對TNBC 細胞增殖和凋亡的調控作用部分依賴于激活細胞鐵死亡。鐵死亡的另一特征是ROS大量生成所導致的MDA 含量增多、GSH 和SOD 活性降低,本研究實驗結果發現JNK激動劑后出現了相應的MDA、GSH和SOD 變化,聯合使用鐵死亡抑制劑則明顯削弱JNK 激動劑對MDA、GSH和SOD的影響,由此進一步驗證了JNK通路對TNBC鐵死亡的調控作用。
綜上所述,JNK 通路通過激活鐵死亡的方式抑制TNBC 細胞增殖,促進細胞凋亡,JNK 通路調控鐵死亡可能成為研究TNBC發病機制及治療手段的新靶點。

