轉化生長因子β誘導蛋白在膠質瘤中的表達及生物學功能
咼文靜,鄧 慧,宋 萍,張孟賢,*
(1.湖北文理學院附屬醫院/襄陽市中心醫院腫瘤科,湖北 襄陽 441000;2.華中科技大學同濟醫學院附屬同濟醫院腫瘤科,湖北 武漢 430030)
彌漫性膠質瘤是成人最常見的中樞神經系統惡性腫瘤,約占所有腦腫瘤的30%,腦惡性腫瘤的80%。彌漫性較低級別膠質瘤約占所有膠質瘤的15%,5 年生存率在30%~80%,預后差異較大。膠質母細胞瘤(glioblastoma,GBM)是成人最常見的惡性程度最高的膠質瘤,占所有中樞神經系統腫瘤的15%,盡管目前存在包括手術、放療和替莫唑胺同步化療[1]以及近來發展起來的免疫治療、靶向治療和腫瘤電場治療等在內的多種標準治療模式,其5 年生存率仍低于5%[2]。因此,尋找有效的治療靶點和更加深入探討膠質瘤的發病機制非常必要。
轉化生長因子β 誘導蛋白(transforming growth factor β-induced protein,TGFBI),是一種能結合整合素和細胞外基質蛋白的連接蛋白,在胚胎發育、細胞增殖、黏附、遷移、分化和炎癥等過程中發揮著重要作用[3]。有研究表明TGFBI 在不同腫瘤中發揮不同的功能。TGFBI 在胃癌[4]、膀胱癌[5]和食管鱗癌[6]中異常過表達,提示其可能扮演促癌基因的角色;然而,在間皮瘤、乳腺癌和肺癌中,TGFBI 的表達水平明顯降低[7-8],因此它亦可能是一種抑癌基因。目前,關于TGFBI 在膠質瘤發生發展中作用的研究仍然很少,因此,本文旨在探討TGFBI 在膠質瘤發生發展中的作用及潛在機制。
本研究利用癌癥基因圖譜(The Cancer Genome Altas,TCGA)、中國腦膠質瘤圖譜(Chinese Glioma Genome Altas,CGGA)和腦腫瘤分子數據庫(Rembrandt)分析TGFBI 在膠質瘤中的表達及其對患者預后的影響,并通過免疫組化實驗對結果進行驗證。此外,本研究還采用體外實驗檢測了TGFBI 對膠質瘤細胞增殖、侵襲、凋亡和細胞周期的影響。然后采用基因集富集分析(gene set enrichment analysis,GSEA)研究TGFBI 在腫瘤中可能參與并調控的通路,為后續確定TGFBI 在膠質瘤中的預后價值及明確其在膠質瘤發生發展中的作用奠定基礎。
1 材料與方法
1.1 主要試劑
DMEM 培養液、胎牛血清(FBS)均購于美國Gibco公司;TGFBI 抗體購于美國Abcam 公司;二抗來自普諾森試劑盒;TRIzol 試劑購于上海普飛生物技術有限公司;RIPA裂解液、BCA試劑盒、顯色液均購于上海碧云天生物技術公司;CCK-8、PI均購于默克Sigma公司;Annexin Ⅴ-APC 凋亡檢測試劑盒購于eBioscience公司;侵襲實驗染色試劑盒購于美國Corning公司;內參基因和目的基因引物由吉凱基因設計和合成。
1.2 數據庫和組織標本
從TCGA、CGGA 和Rembrandt 數據庫下載膠質瘤患者的轉錄組數據和相應的臨床信息,然后利用Graphpad Prism 8.0 軟件整合分析并繪制TGFBI mRNA 在不同級別膠質瘤中的表達情況,分析TGFBI mRNA 與患者生存時間的關系并繪制Kaplan-Meier 曲線。本研究使用的腦膠質瘤組織芯片購自上海吉凱生物有限公司,陣列編號GL805b,該芯片包含35 例膠質母細胞瘤和5例正常腦組織。
1.3 免疫組化
組織芯片采用二甲苯脫蠟2 次,每次15 min,梯度乙醇水化,在微波爐里高火加熱檸檬酸鈉緩沖溶液(pH=6.0)至沸騰后低火維持20 min,待組織切片自然冷卻后PBS 洗一次,一抗4 ℃孵育過夜,TBS 洗2次,5 min/次,加二抗室溫孵育60 min,TBS 洗4次,5 min/次。DAB 染色,蘇木素復染30 s,中性樹膠封片。晾干,觀察結果,拍照。綜合考慮染色強度評分和染色陽性率評分,兩者相乘得到IHC 評分,用于評估TGFBI 的表達水平。染色強度評分:按顏色深淺分別賦予0(陰性)、1(弱)、2(中)、3 分(強);染色陽性率評分:陽性率0 為0 分,>0~25%為1 分,>25%~50%為2分,>50%~75%為3分,>75%為4分。IHC 評分=染色強度評分×染色陽性率評分,分數越高代表TGFBI表達水平越高。
1.4 細胞培養
本實驗所用的膠質母細胞瘤細胞系U87和U373均來自國家實驗細胞資源共享平臺。兩種細胞系均用含10%胎牛血清的DMEM 培養液,置于37 ℃、CO2體積分數為5%的培養箱中培養,根據細胞的生長情況分別進行換液或傳代。
1.5 慢病毒載體的構建和轉染目的細胞
從上海吉凱生物有限公司購買已設計好的針對TGFBI 序列的shRNA 慢病毒和相應的空載序列慢病毒,并轉染U87 和U373 細胞,轉染完畢后在37 ℃、CO2體積分數為5%的細胞培養箱中培養,嘌呤霉素篩選后用Western blot法驗證轉染是否成功。
1.6 CCK-8法檢測膠質瘤細胞增殖
取對數生長期的細胞胰酶消化后制成細胞懸液,分為實驗組和對照組:實驗組細胞為帶有針對TGFBI序列的shRNA的慢病毒,而對照組則為帶有轉染了相應的空載序列的慢病毒。隨后將其接種于96 孔板中,每孔培養基總量100 μL,每組設5個復孔。將接種細胞的培養板放入培養箱中,37 ℃、CO2體積分數為5%條件下,根據實驗需要,分別孵育24、48、72、96 和120 h。在每個時間點結束前,向每孔加入10 μL 的CCK-8 溶液,孵育結束后,用酶標儀測定其在450 nm波長處的吸光度值D(450)。
1.7 Transwell細胞侵襲試驗
分別將實驗組和對照組的U87和U373細胞置于侵襲小室上層,含有10%胎牛血清的DMEM培養液置于侵襲小室的下層,在37 ℃培養箱孵育48 h 后,用棉簽將小室上層細胞刮下去除,然后用4%多聚甲醛將小室下層細胞固定20 min,結晶紫染色后在顯微鏡下觀察,每個上室隨機取5 個100 倍視野拍照并進行細胞計數。
1.8 流式細胞術檢測細胞凋亡情況
收集實驗組和對照組的U87和U373細胞,用PBS洗滌2次后加入200 μL的結合緩沖液,加入10 μL的Annexin Ⅴ-APC 吹打混勻,室溫避光孵育30 min,上機檢測細胞凋亡情況。
1.9 流式細胞術進行細胞周期的檢測
將實驗組和對照組的U87和U373細胞分別用胰酶消化后制成細胞懸液,吸1 mL 細胞懸液離心后加入1 mL 70%的預冷乙醇,4 ℃固定過夜,PBS洗去乙醇后加入0.3 mL的PI,4 ℃避光孵育30 min,用流式細胞儀檢測細胞周期。
1.10 基因集富集分析
從TCGA 數據庫下載膠質瘤患者的mRNA 數據,按照TGFBI mRNA表達水平中位數分為TGFBI高表達組和低表達組并制做成表型數據文件(cls 格式),同時將mRNA 數據制作成與表型數據相對應的基因表達譜文件(gct 格式,矩陣形式)。然后,使用GSEA(http://software.broadinstitute.org/gsea/index.jsp)網站提供的基于IAVA環境的GSEA軟件(version 3.0)分析比較TGFBI高低表達組之間可能存在的差異表達基因及信號通路。在GSEA 分析中使用GSEA 官方提供的Molecular Signature Database(MsigDB)作為通路注釋源,通過1 000次循環的排列組合尋找顯著富集的信號通路。
1.11 統計學分析
本研究采用Graphpad Prism 6 進行數據統計和制圖,應用SPSS 18.0 軟件對實驗數據進行統計學處理,二獨立樣本t檢驗進行數據分析,Kaplan-Meier生存分析繪制生存曲線,P<0.05 表示差異具有統計學意義。
2 結果
2.1 基于數據庫分析TGFBI mRNA 的表達及其與臨床病理指標的相關性
從TCGA、CGGA和Rembrandt數據庫下載GBM和轉錄組數據和相應的臨床信息進行分析。如圖1 所示,TGFBI mRNA 的表達水平與世界衛生組織(World Health Organization,WHO)定義的膠質瘤分級相關,隨著腫瘤級別和惡性程度的增加,TGFBI mRNA 的表達水平也逐漸增加,差異具有統計學意義(P<0.05)。Kaplan-Meier 生存分析顯示TGFBI mRNA 的表達水平與患者的預后呈負相關(P<0.05,見圖2)。然后,本研究通過免疫組化檢測TGFBI 蛋白在腫瘤組織和正常腦組織中的表達水平,結果顯示,TGFBI 蛋白主要位于細胞質中,陽性表達呈棕黃色和棕褐色的顆粒(見圖3),35 例膠質母細胞瘤組織的免疫組化染色評分為5.96±4.01,高于對照組的評分0(P<0.05)。

圖1 TGFBI mRNA在膠質瘤中的表達水平

圖2 TGFBI mRNA不同表達水平膠質瘤患者的生存分析
2.2 TGFBI對膠質瘤細胞增殖的影響
采用慢病毒轉染干擾TGFBI 的表達,構建TGFBI低表達的U87 和U373 細胞系,Western blot 檢測結果顯示,相較于陰性對照組,實驗組sh-TGFBI中TGFBI蛋白的表達水平顯著下降,說明轉染成功(圖4A)。應用CCK-8 試劑盒分別對對照組和sh-TGFBI 組膠質瘤細胞在24、48、72、96和120 h時間點進行細胞增殖能力的檢測。結果顯示,sh-TGFBI 組U87 和U373 細胞增殖能力較對照組明顯降低(P<0.05,圖4B)。表明敲低TGFBI基因表達后可抑制腫瘤細胞的增殖。

圖4 TGFBI蛋白低表達可抑制膠質瘤細胞增殖
2.3 TGFBI對膠質瘤細胞侵襲的影響
Transwell實驗結果(圖5)顯示,不同光鏡視野中實驗組兩株膠質母細胞瘤細胞的數目明顯少于對照組(P<0.05),表明敲低TGFBI 的表達能顯著抑制U87 和U373膠質瘤細胞的侵襲能力。
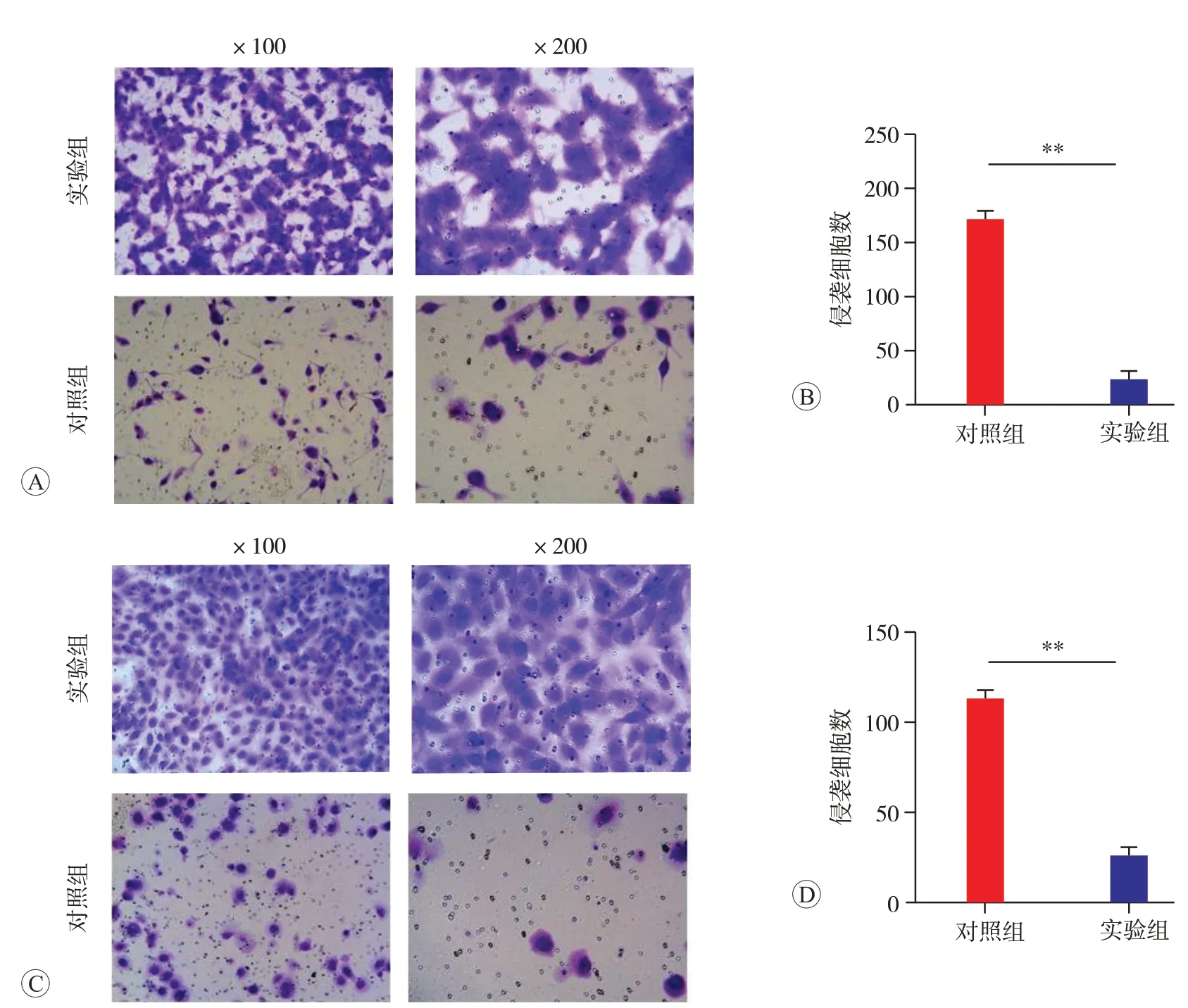
圖5 敲低TGFBI后對U87和U373膠質瘤細胞侵襲的影響
2.4 TGFBI對膠質瘤細胞凋亡和細胞周期的影響
流式細胞術檢測膠質瘤細胞凋亡和細胞周期分布情況(圖6),結果顯示,轉染了sh-TGFBI慢病毒顆粒的U87 和U373 細胞凋亡率分別為(7.92±0.57)%、(6.89±0.56)%,而陰性對照組細胞凋亡率分別為(3.94±0.23)%、(4.45±0.44)%。以上數據表明與對照組相比,實驗組細胞凋亡率明顯升高(P<0.05)。另外,本研究發現,與對照組比較,轉染了sh-TGFBI 慢病毒顆粒的U87和U373細胞處于S期的細胞數減少,G2/M期細胞數增多(均為P<0.05),而處于G1期的細胞無顯著變化。

圖6 U87和U373細胞敲低TGFBI對腫瘤細胞凋亡和細胞周期的影響
2.5 TGFBI的功能基因集富集分析
為了進一步研究TGFBI 參與腫瘤的調控機制,利用TCGA 數據庫,通過GSEA 方法分析了TGFBI 的表達所參與的信號通路,結果顯示,TGFBI 高表達可能通過TOLL 樣受體信號通路、NOD 樣受體信號通路和JAK-STAT信號通路參與膠質瘤的發生發展(圖7)。
3 討論
人腦膠質瘤是高度惡性的顱內腫瘤,它表現為對正常腦組織的破壞,對常規治療的抵抗以及廣泛侵襲整個大腦[9]。世界衛生組織根據膠質瘤的組織病理學特征將其分為四級(I~IV)。盡管有最佳的治療模式,膠質母細胞瘤(IV 級)患者的中位生存期仍只有15~18個月[10]。在本文中,我們討論了在膠質母細胞瘤中的一個潛在的分子標志物,可能為膠質母細胞瘤的研究帶來新的機遇。
研究證實TGF-β信號在癌前狀態下發揮腫瘤抑制因子的作用,而在晚期癌癥中則作為腫瘤促進劑發揮作用[11]。TGFBI,作為TGF-β信號通路的下游分子,有文獻報道其在腫瘤進程中發揮促進和抑制的雙重作用[12-13]。近年來,多項研究表明TGFBI 在不同類型腫瘤中的作用,如在卵巢癌[14]、食管鱗狀細胞癌[6]、腎細胞癌[15]、黑色素瘤[16]、結腸癌[17]和肺腺癌[18]中發揮促腫瘤作用,而在白血病[19]、間皮瘤、乳腺癌[8]和肺癌[7]中起抑癌作用,因此,TGFBI 可能是一個廣譜的生物標志物和治療靶點。然而,TGFBI 在膠質瘤中的表達模式和確切作用尚不清楚。

A:JAK-STAT信號通路;B:NOD樣受體信號通路;C:TOLL樣受體信號通路.
在本研究中,我們用生物信息學方法證實了TGFBI 的表達水平與膠質瘤的惡性程度分級存在顯著相關性,膠質瘤分級越高,其表達越豐富。并且TGFBI 高表達與膠質瘤患者的不良預后相關。隨后免疫組織化學染色結果顯示TGFBI 在膠質母細胞瘤組織中的表達水平顯著高于正常腦組織。基于上述結果我們推測TGFBI 在膠質瘤的發生發展中可能扮演了癌基因的角色,為了進一步了解TGFBI 在膠質瘤中的生物學功能,我們通過CCK-8、Transwell 小室實驗、流式細胞術檢測細胞增殖、凋亡和細胞周期的變化。結果顯示,敲低TGFBI基因表達后,膠質瘤細胞U87 和U373的增殖速度減慢,侵襲能力下降,細胞凋亡率升高,并促使細胞滯留于G2/M 期。這些結果均提示TGFBI 在膠質瘤中可能作為一個促癌因子存在。Guo等[20]的實驗通過pSUPER-shTGFBI 質粒轉染U87 和U251細胞,發現TGFBI表達增強可以促進膠質瘤細胞增殖和遷移,此與我們的實驗結果一致。Zhu 等[21]通過體外實驗初步證實了膠質母細胞瘤TGFBI主要由M2型腫瘤相關巨噬細胞分泌,并作用于膠質瘤干細胞,促進干細胞特性而發揮作用。這些結果進一步顯示TGFBI可能作為膠質瘤的潛在治療靶點。
為了進一步探索TGFBI在GBM惡性進展中可能存在的分子機制,我們采用了GSEA 富集分析,結果顯示TGFBI 在人膠質瘤中的作用機制可能與Toll 樣受體(Toll-like receptors,TLRs)信號通路、NOD 樣受體(Nod-like receptors,NLRs)信號通路和JAK-STAT信號通路密切相關。TLRs是一類重要的模式識別受體,參與人類自身免疫性疾病和惡性腫瘤的發生發展[22-23]。有研究發現TLRs 和相關的信號通路能夠介導膠質瘤和其微環境中浸潤的巨噬細胞之間的相互作用,聯合激活巨噬細胞中TLR3/9可以更有效的抑制膠質瘤的惡性進展[24]。故而我們推測TGFBI可能由M2型巨噬細胞自分泌后與自身TLRs 結合從而調控膠質瘤的惡性生物學行為。NLRs同樣是一種胞內模式識別受體,在介導免疫和腫瘤發生發展過程中具有重要作用[25]。已有研究報道NLRs參與膠質瘤血管生成[26]并且Nod樣受體家族的分子NLRP3可通過白介素-1β和NF-κB通路促進膠質瘤的增殖和侵襲[27],提示TGFBI 可能通過與NLRs相互作用參與膠質瘤的惡性進展。TLRs和NLRs均是啟動固有免疫應答的關鍵分子,因此我們推測TGFBI 可能通過影響膠質瘤的免疫微環境或者系統或局部的免疫反應參與調控腫瘤的惡性生物學行為,具體作用機制需要進一步通過實驗驗證。JAK-STAT 信號通路在個體發育、細胞分化和維持體內穩態方面至關重要,該通路的失調通常與人類惡性腫瘤相關[28]。近來有研究發現JAK-STAT 通路參與免疫調節過程,包括對腫瘤細胞的識別和介導腫瘤細胞的免疫逃逸。Henrik 等[29]發現抑制膠質母細胞瘤反應性星形膠質細胞中JAK-STAT 通路后可以將促炎/抗炎的平衡轉向促炎環境,提示TGFBI 可能通過該通路影響微環境而對膠質瘤的生物學行為進行調控,這些結果為后續研究TGFBI如何影響膠質瘤惡性進展提供了方向。
綜上所述,我們的研究強調了TGFBI 表達水平的升高與高的腫瘤分級和較差的腫瘤預后有關,同時體外實驗證實了TGFBI 的高表達能夠促進膠質瘤細胞惡性增殖,增強其侵襲性,抑制凋亡和改變細胞周期的作用。然而TGFBI 對促進膠質瘤惡性進展的機制尚需進一步探索,此外,對于TGFBI 的促癌作用尚需在人腦的其他細胞系、膠質瘤原代細胞和體內動物實驗中獲得更多的實驗證據加以證實。

