參杞強精顆粒對H2O2誘導小鼠睪丸間質細胞氧化應激損傷的作用*
唐愛存, 馬家寶, 賴克道, 劉金花, 盧秋玉
(1.廣西中醫藥大學第一附屬醫院, 廣西 南寧 530023; 2.廣西壯族自治區中醫藥研究院,廣西 南寧 530022; 3.廣西壯族自治區人民醫院 藥學部, 廣西 南寧 530021)
目前,隨著我國生育政策的變化,越來越多的家庭選擇二胎或三胎,但受環境污染、工作壓力、生活方式改變等因素的影響,男性的生育能力逐漸下降,這一矛盾嚴重影響了社會穩定和家庭和睦,同時也影響國家人口政策的實施。其中少弱精子癥是男性不育最常見的原因之一,目前其機制尚未完全闡明。睪丸間質細胞是維持雄性動物正常生殖生理的重要生殖細胞之一,具有營養和支持生殖細胞、合成分泌雄性激素、促進精子的發生和男性生殖器官發育等作用。研究表明,氧化應激損傷是導致睪丸間質細胞受損的重要原因之一,因此,抑制損傷細胞的氧化應激作用,保護氧化損傷睪丸間質細胞的功能,對提高生育率具有重要的臨床意義[1]。睪丸間質細胞是分泌和產生睪酮的主要細胞。研究表明,氧化應激能引起睪丸間質細胞損傷,從而引起睪酮等雄性激素分泌減少,影響精子發育[2]。另外,睪酮合成受睪酮合成酶的調控。研究表明,類固醇合成快速調節蛋白(steroidogenic acute regulatory protein, StAR)、P450 膽固醇側鏈裂解酶(cholesterol side-chain cleavage enzyme, P450scc)、17β - 羥基固醇脫氫酶(17β -hydroxysteroid dehydrogenase, 17β-HSD)是睪酮合成與分泌的關鍵酶[3]。參杞強精顆粒由黨參、枸杞子、黃芪、菟絲子、五味子、當歸等組成,具有補腎健脾、活血養血、清熱利濕、增強免疫作用,其傳統湯劑已在臨床應用10 年以上,是治療少弱精癥的有效方劑。前期研究發現,參杞強精傳統湯劑對少弱精子癥有較好的療效,能顯著提高少弱精子癥患者的精子密度、活力及活率[4-5]。能夠降低環磷酰胺所致脾腎兩虛型睪丸生精障礙模型小鼠的生精細胞凋亡率,修復睪丸的病理損傷,恢復其生精功能[6]。但其在H2O2誘導睪丸間質細胞氧化應激損傷保護作用方面未見報道,因此,本研究采用H2O2誘導損傷睪丸間質細胞構建氧化應激損傷模型,探討參杞強精顆粒對H2O2誘導睪丸間質細胞氧化應激損傷的保護作用。
1 材料與方法
1.1 細胞株與藥物
小鼠睪丸間質細胞TM3 購自中國科學院細胞庫,本研究室自行傳代培養,維生素E 軟膠囊由浙江醫藥股份有限公司新昌制藥廠生產(批號:H33020187),參杞強精顆粒由廣西中醫藥大學第一附屬醫院制劑中心提供(批號:20210915,中藥民族藥制劑備案號:桂藥制備字Z20200023000,每1 g 顆粒相當于原生藥2 g),實驗時采用純化蒸餾水超聲溶解,經0.22 μm 孔徑濾膜過濾除菌,再用細胞培養液稀釋成所需濃度,4 ℃保存備用。
1.2 試劑
DMEM 培養基和胎牛血清(fetal bovine serum,FBS)購自美國Gibco 公司,胰蛋白酶和四甲基偶氮唑鹽(MTT)購自美國Amersco 公司,CCK-8 試劑盒購自上海碧云天生物技術有限公司,TRIzol 試劑購自美國Invitrogen 公司,逆轉錄試劑購自德國Thermo 公司,磷酸鹽緩沖液(phosphate buffer saline, PBS)購自福州邁新生物技術開發有限公司,SYBR 熒光定量聚合酶鏈反應試劑盒購自日本TaKaRa 公司,RIPA裂解液(含1 %蛋白酶抑制劑)購自上海碧云天生物技術有限公司,過氧化氫H2O2購于廣東南國藥業有限公司,睪酮、一氧化氮NO、乳酸脫氫酶(lactate dehydrogenase, LDH)、8- 羥基脫氧鳥苷(8-hydroxy-deoxyguanosine, 8-OHdG)、超氧化物歧化酶(superoxide dismutase, SOD)、谷胱甘肽-S 轉移酶(glutathione-S-transferase, GST)、活性氧(reactive oxygen species, ROS)、丙二醛(Malondialdehyde, MDA)、過氧化氫酶(Catalase, CAT)及總抗氧化能力(total antioxidant capacity, TAOC)試劑盒均購自南京建成生物工程研究所。其他試劑均為分析純。
1.3 儀器
Model 311 型二氧化碳孵箱(美國Thermo Forma公司),XD-101 型倒置光學顯微鏡(日本Olympus 公司),SW-CJ-1F 型超凈工作臺(蘇凈安泰生物科技有限公司),722S 型可見分光光度計(上海精密科學儀器有限公司),ABI 9700 型聚合酶鏈反應(PCR)擴增儀,Model 450 型自動酶標儀(美國Bio-Rad 公司),Tanon 5200 型全自動化學發光圖像分析系統(上海天能科技有限公司),TGL-16G-A 型高速冷凍離心機(上海安亭科學儀器廠)。
1.4 方法
1.4.1 TM3 細胞培養 用含10% FBS 的DMEM 作為培養液,將TM3 細胞置于37 ℃,5%二氧化碳培養箱中靜置培養,每天觀察細胞生長情況,每兩天更換1 次細胞培養液,采用0.25%胰酶對長滿細胞進行消化傳代,取對數生長期的細胞進行后續試驗。
1.4.2 MTT 法檢測參杞強精顆粒對TM3 細胞的毒性作用 采用0.25%胰酶將對數生長期TM3 細胞消化制成濃度為1×105/mL 的細胞懸液,并接種到96 孔培養板中,每孔200 μL,置于37 ℃,5%二氧化碳孵箱中繼續培養24 h 貼壁后,丟棄培養液,加入含參杞強精顆粒的給藥組,終濃度分別為0.05、0.50、2.50、5.00 和10.00 mg/mL,繼續培養24 h,然后每孔加入MTT 20 μL,繼續在37 ℃,5%二氧化碳孵箱中培養4 h,吸棄全部上清液,再在每孔加入二甲亞砜(Dimethylsulphoxide, DMSO)200 μL,在微量振蕩器上振蕩5 min,最后在酶標儀450 nm 波長處測定吸光度值,測定各組細胞活力。
1.4.3 H2O2損傷模型的構建及藥物濃度篩選 參照參考文獻[7]和前期預實驗,采用0.25 %胰酶將對數生長期TM3 細胞消化制成濃度為1×105/mL 的細胞懸液,并接種到96 孔培養板中,每孔200 μL,分為8 組,每組6 個復孔,分別為正常組、H2O2損傷模型組、陽性對照組(10 μg/mL 維生素E)、參杞強精顆粒組(0.05、0.40、0.80、1.60、5.00 mg/mL),置于37 ℃,5%二氧化碳孵箱中繼續培養24 h 貼壁后,丟棄培養液,正常組換用含10%胎牛血清的DMEM 培養液,其余各組加入終濃度為500 μmol/L H2O2完全培養液誘導建立氧化應激損傷模型,繼續培養4 h 后,吸棄全部上清液,正常組和模型組加入200 μL 完全培養液,陽性對照組加入終濃度10 μg/mL 維生素E 的培養液,其余給藥組加入等體積終濃度分別為0.05、0.40、0.80、1.60 和5.00 mg/mL 的參杞強精顆粒藥液,繼續培養24 h 后,每孔加入10 μL CCK-8,混勻后置37 ℃,5%二氧化碳培養箱中孵育2 h,最后采用自動酶標儀(檢測波長為450 nm)檢測各組OD 值,篩選最佳給藥濃度。
1.4.4 分組給藥 采用0.25%胰酶將對數生長期TM3 細胞消化制成濃度為1×105/mL 的細胞懸液,并接種到96 孔培養板中,每孔200 μL,分為5 組,分別為正常組、H2O2損傷模型組、參杞強精顆粒低中高劑量組(0.4、0.8 和1.6 mg/mL),每組6 個復孔,置于37 ℃,5%二氧化碳孵箱中繼續培養24 h 貼壁后,丟棄培養液,正常組換用含10 %胎牛血清的DMEM 培養液,模型組和參杞強精顆粒給藥組加入終濃度為500 μmol/L H2O2完全培養液誘導建立氧化應激損傷模型,繼續培養4 h 后,吸棄全部上清液,正常組和模型組加入200 μL 完全培養液,其余給藥組加入等體積終濃度分別為0.4,0.8 和1.6 mg/mL 的參杞強精顆粒藥液,繼續培養24 h 后,收集各組細胞上清液和細胞,待后續進一步檢測。
1.4.5 酶聯免疫吸附試驗(enzyme linked immunosorbent assay, ELISA)檢測細胞上清液中睪酮、NO、LDH、8-OHdG、GST 的活性 按照1.4.4 復制H2O2損傷模型并分組給藥,收集各組細胞上清液,同時根據睪酮、NO、LDH、8-OHdG、GST試劑盒說明書配置好相關工作液,向稀釋后的標準品中加入各組細胞上清液50 μL,混勻后于恒溫水浴鍋中溫育0.5 h,分別加入50 μL 酶標志物、顯色劑A 和顯色劑B 各50 μL,混勻后,37 ℃避光顯色15 min,最后加入50 μL終止液,用酶標儀檢測各孔450 nm波長處吸光度值。
1.4.6 ELISA 檢測細胞內ROS、MDA、CAT、SOD、TAOC 的含量 按照1.4.4 復制H2O2損傷模型并分組給藥,連續培養24 h 后,去上清液,胰蛋白酶消化后制成細胞懸液,4 000 r /min 離心5 min 收集細胞,采用超聲破碎法收集各組細胞裂解液,2 500 r /min離心10 min,取上清液,嚴格按ELISA 試劑盒說明書方法(同1.4.5 ELISA 操作方法),分別檢測細胞內ROS、MDA、CAT、SOD、TAOC 的含量。
1.4.7 實時熒光定量聚合酶鏈反應(quantitative realtime polymerase chain reaction, qRT-PCR)檢測睪酮合成酶StAR、P450scc、17β-HSD mRNA 表達 按照1.4.4 復制H2O2損傷模型并分組給藥,連續培養24 h后,去上清液,胰蛋白酶消化后制成細胞懸液,4 000 r/min 離心5 min 收集細胞,嚴格按照TRIzol試劑盒說明書提取細胞總RNA,測定總RNA 純度及濃度,并將RNA 逆轉錄成cDNA,然后以cDNA 為模板進行qRT-PCR 反應,反應體系:SYBR Premix Ex Taq(2×)10 μL,正向引物(10 μmol/L)0.2 μL,反向引物(10 μmol/L)0.2 μL,cDNA 模板1 μL,ROX reference dye(50×)0.4 μL,ddH2O 補足體系至20 μL。反應條件:95 ℃預變性10 min,95 ℃變性15 s,60 ℃退火15s,72 ℃延伸30 s,共40 個循環。本實驗中StAR、P450scc、17β-HSD 基因的引物設計合成及驗證均由大連寶生生物工程有限公司完成。以β-actin 為內參基因,采用2-ΔΔCt法分析各基因在細胞中的相對表達量。各引物序列見表1。

表1 qRT-PCR引物序列
1.5 統計學方法
數據分析采用SPSS 20.0 統計軟件。計量資料以均數±標準差(±s)表示,比較用單因素方差分析,進一步兩兩比較用LSD-t檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 參杞強精顆粒對正常TM3細胞毒性作用
MTT 結果顯示,各組細胞存活率的比較,經方差分析,差異有統計學意義(P<0.05)。與正常組比較,參杞強精顆粒在濃度為0.05~2.50 mg/mL 時對正常TM3 細胞增殖活性無明顯毒性作用(P>0.05);當參杞強精顆粒濃度為5.00~10.00 mg/mL 時對正常TM3 細胞增殖活性有一定的毒性作用(P<0.05)。見表2。
表2 不同濃度參杞強精顆粒對正常TM3細胞毒性的影響(±s)

表2 不同濃度參杞強精顆粒對正常TM3細胞毒性的影響(±s)
注 : ?與正常組比較,P <0.05。
組別正常組參杞強精顆粒0.05 mg/mL參杞強精顆粒0.50 mg/mL參杞強精顆粒2.50 mg/mL參杞強精顆粒5.00 mg/mL參杞強精顆粒10.00 mg/mL F 值P 值OD值0.98±0.08 1.02±0.12 0.94±0.09 0.92±0.08 0.79±0.06?0.68±0.07?108.655 0.000
2.2 參杞強精顆粒對H2O2損傷的TM3細胞增殖活力的影響
MTT 實驗結果顯示,各組細胞存活率比較,經方差分析,差異有統計學意義(P<0.05)。與正常組比較,H2O2損傷模型組中TM3 細胞增殖活力下降(P<0.05),與H2O2損傷模型組比較,參杞強精顆粒在濃度為0.05~5.00 mg/mL 時能提高TM3 細胞的增殖活力(P<0.05),且在0.05~1.60 mg/mL 范圍內,TM3 細胞的增殖活力隨藥物濃度的升高而增強(見表3)。后續藥效試驗選擇0.40、0.80 和1.60 mg/mL作為參杞強精顆粒低劑量組、中劑量組和高劑量組。
表3 參杞強精顆粒對H2O2損傷的TM3細胞增殖活力的影響 (±s)
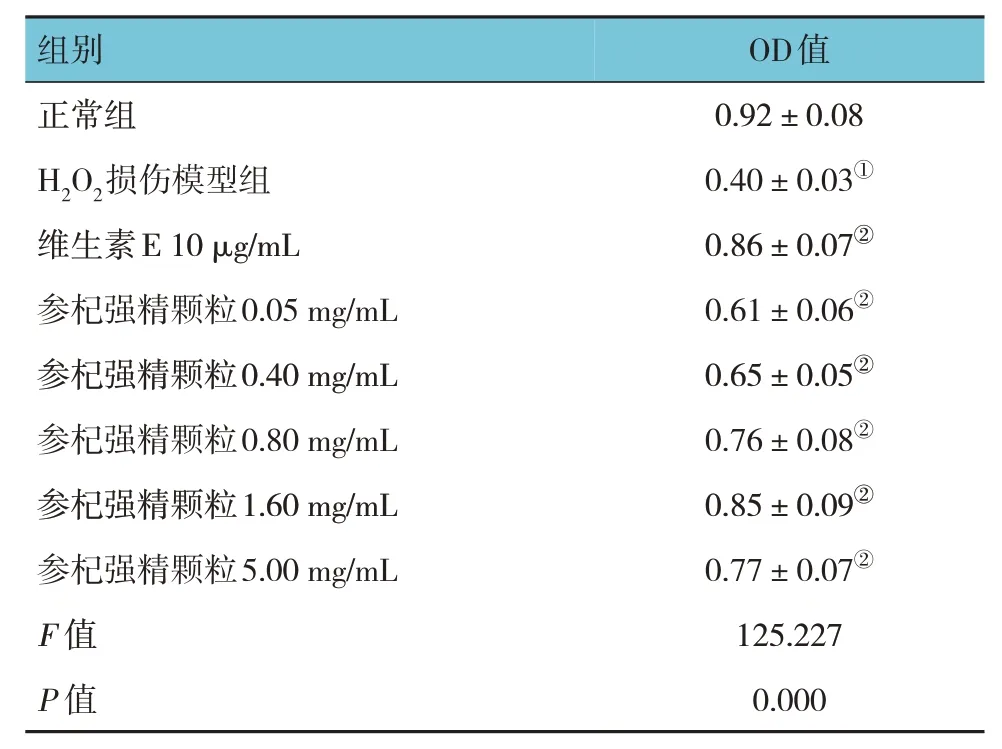
表3 參杞強精顆粒對H2O2損傷的TM3細胞增殖活力的影響 (±s)
注 : ①與正常組比較,P <0.05; ②與H2O2損傷模型組比較,P <0.05。
OD值0.92±0.08 0.40±0.03①0.86±0.07②0.61±0.06②0.65±0.05②0.76±0.08②0.85±0.09②0.77±0.07②125.227 0.000組別正常組H2O2損傷模型組維生素E 10 μg/mL參杞強精顆粒0.05 mg/mL參杞強精顆粒0.40 mg/mL參杞強精顆粒0.80 mg/mL參杞強精顆粒1.60 mg/mL參杞強精顆粒5.00 mg/mL F 值P 值
2.3 參杞強精顆粒對細胞上清液中睪酮、NO、LDH、8-OHdG、GST活性影響
ELISA 結果顯示,各組細胞上清液中睪酮、NO、LDH、8-OHdG、GST 活性比較,經方差分析,差異均有統計學意義(P<0.05)。與正常組比較,H2O2損傷模型組睪酮水平、NO 含量、GST 活性降低(P<0.05),LDH 和8-OHdG 含量升高(P<0.05);與H2O2損傷模型組比較,參杞強精顆粒各劑量組均能提高睪酮水平、NO 含量(P<0.05),增加GST 活性(P<0.05),同時降低LDH 和8-OHdG 含量(P<0.05);參杞強精顆粒低、中、高劑量組(0.40、0.80 和1.60 mg/mL)兩兩比較,差異均有統計學意義(P<0.05)。見表4。
表4 參杞強精顆粒對上清液中睪酮、NO、LDH、8-OHdG、GST活性影響 (±s)

表4 參杞強精顆粒對上清液中睪酮、NO、LDH、8-OHdG、GST活性影響 (±s)
注 : ①與正常組比較,P <0.05; ②與H2O2損傷模型組比較,P <0.05; ③與參杞強精顆粒0.40 mg/mL 組比較,P <0.05; ④與參杞強精顆粒0.80 mg/mL組比較,P <0.05。
組別正常組H2O2損傷模型組參杞強精顆粒0.40 mg/mL參杞強精顆粒0.80 mg/mL參杞強精顆粒1.60 mg/mL F 值P 值NO/(μmol/mL)8.22±0.79 4.79±0.50①5.26±0.46①②6.63±0.61①②③7.94±0.80①②③④104.854 0.000 LDH/(u/mL)50.13±5.07 136.77±15.01①91.09±9.38①②80.04±9.05①②③65.33±5.82①②③④174.338 0.000 GST/(u/mL)45.66±4.73 20.71±2.11①29.56±3.06①②35.88±4.13①②③40.05±4.46①②③④155.219 0.000睪酮/(ng/mL)4.85±0.54 2.06±0.16①2.99±0.31①②3.81±0.35①②③4.07±0.39①②③④91.006 0.000 8-OHdG/(ng/mL)5.25±0.49 12.17±1.63①9.01±0.88①②7.83±0.74①②③6.14±0.65①②③④115.960 0.000
2.4 參杞強精顆粒對細胞內ROS、MDA、CAT、SOD、TAOC含量的影響
ELISA 結果顯示,各組細胞內ROS、MDA、CAT、SOD、TAOC 含量比較,經方差分析,差異均有統計學意義(P<0.05)。與正常組比較,H2O2損傷模型組細胞內ROS、MDA 含量均升高(P<0.05),CAT、SOD 和總抗TAOC 的活性均下降(P<0.05);與H2O2損傷模型組比較,參杞強精顆粒各劑量組均降低細胞內ROS 和MDA 含量(P<0.05),均增強CAT、SOD 和TAOC 的活性(P<0.05);參杞強精顆粒低劑量組、中劑量組、高劑量組(0.40、0.80 和1.60 mg/mL)兩兩比較,差異均有統計學意義(P<0.05)。見表5。
表5 參杞強精顆粒對細胞內ROS、MDA、CAT、SOD、TAOC含量的影響 (±s)

表5 參杞強精顆粒對細胞內ROS、MDA、CAT、SOD、TAOC含量的影響 (±s)
注 : ①與正常組比較,P <0.05; ②與H2O2損傷模型組比較,P <0.05; ③與參杞強精顆粒0.40 mg/mL 組比較,P <0.05; ④與參杞強精顆粒0.80 mg/mL組比較,P <0.05。
組別正常組H2O2損傷模型組參杞強精顆粒0.40 mg/mL參杞強精顆粒0.80 mg/mL參杞強精顆粒1.60 mg/mL F 值P 值MDA/(u/mg)2.47±0.14 6.05±0.58①5.12±0.42①②4.27±0.39①②③3.03±0.35①②③④85.911 0.000 CAT/(u/mg)15.06±1.66 6.46±0.59①7.90±0.73①②9.58±0.85①②③11.87±1.22①②③④90.424 0.000 TAOC/(u/mg)18.55±2.00 9.94±1.04①11.86±1.25①②13.45±1.47①②③15.01±1.39①②③④103.553 0.000 ROS熒光強度/%0.82±0.06 2.57±0.21①2.09±0.17①②1.84±0.18①②③1.05±0.11①②③④73.227 0.000 SOD/(u/mg)7.25±0.71 2.76±0.30①4.09±0.39①②5.71±0.55①②③6.33±0.58①②③④80.632 0.000
2.5 參杞強精顆粒對睪酮合成酶StAR、P450scc、17β-HSD mRNA表達的影響
qRT-PCR 結果顯示,各組細胞內睪酮合成酶StAR、P450scc、17β-HSD mRNA 相對表達量比較,經方差分析,差異均有統計學意義(P<0.05)。與正常組比較,H2O2損傷模型組中睪酮合成酶StAR、P450scc、17β-HSD mRNA 相對表達量下降(P<0.05);與H2O2損傷模型組比較,參杞強精顆粒各劑量組能提高睪酮合成酶StAR、P450scc、17β-HSD mRNA 相對表達量(P<0.05);參杞強精顆粒低、中、高劑量組(0.40、0.80 和1.60 mg/mL)兩兩比較,差異均有統計學意義(P<0.05)。見表6。
表6 參杞強精顆粒對睪酮合成酶StAR、P450scc、17β-HSD mRNA相對表達量的影響 (±s)

表6 參杞強精顆粒對睪酮合成酶StAR、P450scc、17β-HSD mRNA相對表達量的影響 (±s)
注 : ①與正常組比較,P <0.05; ②與H2O2損傷模型組比較,P <0.05; ③與參杞強精顆粒0.40 mg/mL 組比較,P <0.05; ④與參杞強精顆粒0.80 mg/mL組比較,P <0.05。
17β-HSD mRNA 1.00±0.06 0.61±0.06①0.69±0.07①0.82±0.06①②③0.93±0.08②③④98.611 0.000組別正常組H2O2損傷模型組參杞強精顆粒0.4 mg/mL參杞強精顆粒0.8 mg/mL參杞強精顆粒1.6 mg/mL F 值P 值StAR mRNA 1.00±0.05 0.50±0.07①0.70±0.06①②0.83±0.08①②③0.91±0.08①②③④90.153 0.000 P450scc mRNA 1.00±0.04 0.42±0.05①0.64±0.07①②0.77±0.09①②③0.89±0.07①②③④115.866 0.000
3 討論
睪丸間質細胞是睪丸中一種能特異性產生男性雄激素的細胞,受垂體前葉嗜堿性細胞分泌的間質細胞刺激素的作用,可促進精子的發生和男性生殖器官發育,并維持第二性征和性功能[8]。氧化應激是細胞暴露于高濃度氧分子或氧的化學衍生物而引起的細胞損傷,導致炎癥細胞浸潤,蛋白酶分泌增加,產生大量氧化中間產物。研究表明,睪丸間質細胞氧化應激損傷是導致男性不育的重要原因之一[9]。因此,通過抑制氧化應激損傷及清除睪丸間質細胞內活性氧,對保護睪丸間質細胞具有重要意義。
H2O2是機體內代謝產生的一種ROS,是機體自由基產生的重要環節,在正常的生理條件下,機體內ROS 的產生和清除維持正常生理平衡,當在病理條件下,這種正常平衡被打破,導致大量ROS 的產生,引發細胞膜中不飽和脂肪酸發生過氧化,使機體長期處于氧化應激狀態,進而氧化細胞DNA、脂類、蛋白質等,誘導細胞凋亡,導致某些酶失活,從而導致細胞功能損傷[10]。目前TM3 細胞氧化應激損傷的模型主要有H2O2誘導、重金屬誘導、偶氮二異丁脒鹽酸鹽(AAPH)誘導等,其中,H2O2誘導是最為常見且成熟的模型,其作為一種ROS,能抑制細胞增殖,造成細胞內大分子氧化損傷,最終導致細胞衰老、死亡、突變等嚴重后果。因此,H2O2誘導的氧化應激細胞模型普遍用于探究自由基介導的細胞損傷機制及抗氧化劑對氧化損傷的保護和修復機制。因此,本實驗研究表明在給予500 μmol/L H2O2誘導損傷睪丸間質細胞4 h 后,TM3 細胞分泌睪酮的功能逐漸下降,細胞內ROS 增加,引起氧化應激和過氧化損傷。
睪酮又稱睪丸素,是男性最重要的雄激素,男性睪酮全部在睪丸間質細胞線粒體內合成,具有促進生殖器官發育和生長,維持男性第二性征發育,同時維持前列腺和精囊生精功能的作用,能促進蛋白質合成和骨骼生長。研究表明,睪丸間質細胞合成睪酮是一系列酶促反應的結果[11]。睪酮合成酶主要包括StAR、P450scc、17β-HSD,其中P450scc 在線粒體是睪酮合成的關鍵限速酶,而StAR 主要將睪酮的前體膽固醇從線粒體膜外轉運至膜內[12],17β-HSD 在靶組織中起著甾體類激素受體前調節的分子開關作用,其能催化睪酮的類固醇激素生物合成,促進睪酮合成。本研究結果表明,參杞強精顆粒能明顯提高TM3 細胞存活率,提高細胞上清液睪酮水平,且能提高睪酮合成酶StAR、P450scc、17β-HSD mRNA 相對表達量。8-OHdG 是ROS 自由基如羥自由基、單線態氧等攻擊DNA 分子中的鳥嘌呤堿基第8 位碳原子而產生的一種氧化性加合物,其作為內源性及外源性因素對DNA 氧化損傷作用的生物標志物,其含量的高低是評估體內氧化損傷程度,以及氧化應激與DNA損傷相互關系的重要指標之一[13]。本研究結果顯示參杞強精顆粒能顯著降低8-OHdG 含量,表明其能改善TM3 細胞氧化應激及過氧化損傷。
以上研究結果表明,參杞強精顆粒對正常TM3細胞無毒性作用,參杞強精顆粒對H2O2誘導睪丸間質細胞氧化應激損傷具有保護作用,其機制可能與清除氧自由基、抗氧化應激損傷及促進睪酮合成有關。本研究為睪丸間質細胞氧化應激損傷導致男性不育的臨床治療提供了新思路,為參杞強精顆粒在臨床的開發應用提供可靠的科學依據,但其作用機制仍需進一步深入研究。

