抗菌肽作為免疫調節劑治療細菌感染的潛力
梁國柱,阮詩媚,何艷梅,楊海龍
(昆明醫科大學基礎醫學院,云南 昆明 650500)
抗菌肽在先天宿主免疫調節的背景下已被研究了40 多年。初步研究的重點是了解抗菌肽的抗菌機制,確定其對抗菌功能至關重要的共同結構和理化特征[1]。在過去10 多年中,人們在闡明抗菌肽如何與宿主固有免疫和適應性免疫系統相互作用方面取得了很大進展[2]。抗菌肽可以利用宿主自身的免疫系統,抑制潛在的有害炎癥反應[3]。同時許多研究表明,抗菌肽可以通過調節宿主固有免疫和適應性免疫來清除病原體[4-7]。
抗菌肽(antimicrobial peptides,AMPs),也稱為宿主防御肽(host defense peptides,HDPs),是一種通常帶正電荷的短肽,存在于多種生命形式中。在一定條件下,大部分陽離子抗菌肽在體外都具有抗菌作用。然而,在宿主體內,許多陽離子抗菌肽的直接抗菌活性往往被一定濃度的肽抑制和/或被生理濃度的單價和二價陽離子、血清和陰離子大分子如糖胺聚糖所拮抗[8]。因此,陽離子抗菌肽在體內實際上可能并不是通過直接殺死微生物來增強宿主的防御作用,而是通過選擇性地增強或調節宿主自身免疫機制,以促進宿主對微生物感染的保護[9]。AMPs 在體內的抗菌作用也不能完全被忽略,如:AMPs 通常與中性粒細胞胞外陷阱(neutrophil extracellular traps,NETs)相關,并有助于其形成。NETs 是中性粒細胞活化后在炎癥部位釋放的由DNA 和蛋白質組成的網狀結構,其主要功能是捕獲和殺死病原體[10-11]。
截止到目前,AMPs 已經被報道具有多種免疫調節活性。如首次報道的AMPs 免疫調節活性與其可以趨化白細胞的能力有關[12]。自此之后,AMPs 的許多其他免疫調節活性陸續被報道,包括增加趨化因子的表達,調節抗炎細胞因子、促炎細胞因子、活性氧(reactive oxygen species,ROS)、一氧化氮合酶(nitric oxide synthase,NOS)的產生,促進傷口愈合,誘導血管生成,促進白細胞的激活和分化,抗原呈遞和適應性免疫的調節等[13-16]。此外,一些AMPs 還可以通過結合蛋白質分子以及靶向固有免疫受體來發揮免疫調節活性[2,17]。因此,了解AMPs 如何通過免疫調節活性來治療細菌感染,平衡炎癥以及促進免疫穩態,對AMPs 的開發具有重要意義。
1 抗菌肽的免疫調節活性
1.1 白細胞的免疫趨化
AMPs 調節免疫系統的重要機制之一是對免疫細胞表現出直接的趨化活性,以及通過誘導趨化因子釋放來增強免疫細胞的募集[18]。接下來筆者將對AMPs 的直接趨化活性,以及間接趨化活性進行概述。
1.1.1 直接趨化活性來自不同物種的大量AMPs 已被證明可作為固有免疫細胞和適應性免疫細胞的趨化劑[19]。人cathelicidin LL-37 被認為是具有多種免疫調節活性的AMPs。LL-37 可以通過甲酰肽受體1(recombinant formyl peptide receptor,FPRL1)吸引中性粒細胞,嗜酸性粒細胞,單核細胞,CD4+T 細胞到微生物入侵的部位,從而激活先天性和適應性免疫系統[20-21]。此外,LL-37 還可以通過G 蛋白偶聯受體吸引肥大細胞到細菌感染部位[22]。然而LL-37 不會吸引單核細胞來源的未成熟樹突狀細胞,因為它們在分化過程中下調了FPRL1[23]。此外,在耐藥菌感染的小鼠模型中,合成肽IDR-1 通過FPRL1 化學吸引中性粒細胞來起到預防和治療小鼠耐藥菌感染的目的[24-25]。
1.1.2 間接趨化活性AMPs 可以通過刺激趨化因子和趨化因子受體的表達來發揮間接趨化功能。如:LL37 可以通過調節趨化因子的分泌來發揮其間接趨化活性。LL37 能夠單獨誘導CXCL8/ IL8的轉錄,并且可以與TNF-ɑ協同介導CXCL8/IL8 的表達[26],而CXCL8/ IL8 可以刺激中性粒細胞的遷移。LL37 還可以通過誘導CXCL10/IP10的表達來募集巨噬細胞、T 細胞、NK 細胞和樹突狀細胞[27]。MCP-1/CCL-2 也可以被LL37 刺激后以劑量依賴的方式分泌,并且MCP-1 可以吸引單核細胞,T 細胞和樹突狀細胞到達細菌感染部位[25]。CCL5 可以被LL37 上調來增強嗜酸性粒細胞、嗜堿性粒細胞和T 細胞的趨化性[28]。除此之外,CXCL1/KC、CCL7/ MCP-3、CCL4、CCL20/MIP3a的表達都可以被 LL-37 上調[29]。LL37 還可以通過刺激趨化因子受體來發揮趨化功能,50 μg/mL LL-37 可以上調小鼠巨噬細胞趨化因子受體的表達,如IL-8 受體、CXCR4、CCR2 和LFA-1[30]。
1.2 抗原呈遞和適應性免疫的調節
除了具有調節固有免疫效應功能外,AMPs還可以作為固有免疫和適應性免疫之間的橋梁,因為其可以將抗原呈遞細胞(antigen-presenting cells,APCs)如樹突狀細胞和單核細胞/巨噬細胞募集到感染部位。樹突狀細胞是獨特有效的前哨白細胞,可以捕獲周圍組織中的抗原,然后啟動和協調原代Th 細胞反應[31]。這一過程對于成功防御非自身有害微生物是至關重要的,并且取決于樹突狀細胞對抗原捕獲和呈遞能力[32]。LL-37可促進循環造血前體細胞和前體樹突細胞向樹突狀細胞分化,并通過與未成熟樹狀細胞相互作用影響適應性免疫。LL-37 是樹突狀細胞分化和激活過程的調節劑,可以上調未成熟樹狀細胞的吞噬能力,調節吞噬受體的表達,上調共刺激分子的表達,促進Th1 誘導因子的分泌,并增強Th1反應[33]。除此之外,LL37 可以通過活化濾泡樹突細胞來增強B 細胞的激活/增殖[34]。
1.3 脫顆粒
AMPs 可以刺激免疫細胞脫顆粒,然后釋放大量促炎和抗菌物質,包括更多AMPs。LL-37通過G 蛋白偶聯受體誘導肥大細胞持續的鈣動員以及大量的脫顆粒[35-36],這會導致組胺和前列腺素D2(prostaglandin D2,PGD2)的釋放[37]。PGD2在炎癥后期,可以通過調節促炎細胞因子與抗炎細胞因子的平衡來調節炎癥[38]。同時,TLR2 配體可以修飾被LL-37 激活的肥大細胞,并且肥大細胞的功能由過敏反應轉變為固有免疫反應[39]。這可能暗示了在感染的情況下LL37 會抑制肥大細胞的過敏反應。
1.4 活性氧(ROS)和活性氮(RNS)產生的調節
一氧化氮(nitric oxide,NO)和ROS 具有消除入侵病原體的能力,并且在固有免疫中發揮重要作用[40]。在吞噬細胞內,AMPs 可以增強中性粒細胞的呼吸爆發并增加ROS 的釋放,該過程由黃素酶介導,并通過細胞內Ca2+濃度的增加來實現[41]。除此之外,AMPs 能以劑量依賴性的方式中和被內毒素誘導的巨噬細胞中NO 和TNF-α的釋放[14]。
1.5 炎癥反應的調節
如前所述,AMPs 具有激活免疫系統的多種功能,可以將其歸類為有助于清除病原體的促炎反應。現在有相當多的證據表明,AMPs 可以改變炎癥反應的性質,增強了傳統上被認為是促炎的某些活性,同時抑制了微生物的特異性分子對促炎細胞因子的有效誘導[42-43]。AMPs 的主要特征可能是細菌特異性誘導炎癥后調節炎癥,并有助于過渡到更平衡的炎癥反應中[44]。因此,將它們描述為促炎或抗炎分子,不如將AMPs 定義為可以促進免疫穩態的分子[45]。AMPs 還可以抑制內毒素和其他TLR 激動劑誘導的促炎反應[46],如:LL-37 可以通過以下方式抑制LPS 誘導的人巨噬細胞中的促炎反應:(1)直接與LPS 相互作用以減少其與LPS 結合蛋白(lipopolysaccharide bindingprotein,LBP),淋巴細胞抗原96(lymphocyte antigen 96,LY96)或TLR-4 受體復合物的結合,從而減少下游途徑的激活;(2)抑制LPS 誘導的NF-κB 中p65、p50 的活化,并通過MyD88 減少LPS 誘導的TREM-1 上調[47];(3)通過抑制某些促炎基因,包括NF-κB1(P105/P50)和TNFα 誘導蛋白2(recombinant tumor necrosis factor alpha induced protein 2,TNFαIP2),同時上調抗炎細胞因子,例如:IL-10 和TNF-α 誘導的蛋白3(recombinant tumor necrosis factor alpha induced protein 3,TNFαIP3)來選擇性地調節基因轉錄;(4)激活MAPK 和PI3K 途徑來影響促炎途徑;(5)可能直接或間接影響TNF-α 蛋白的翻譯,穩定或加工。然而,在特定情況下,LPS 和LL37 之間的相互作用可以導致細胞激活,如:LL37-LPS復合物在體外被人支氣管上皮細胞更有效地識別,隨后導致細胞內TLR4 活化增強和IL-6 產生增加[48];同樣,與LPS 本身相比,人類腺癌結腸上皮細胞系也對LL37-LPS 復合物的炎癥反應增強[49]。LL37 還可以抑制IL-32 誘導的炎性單核細胞產生IL-1β、TNF-α、IL-6[50]。除巨噬細胞外,LL37 可以降低LPS 導致的人中性粒細胞[51],樹突狀細胞[52]和B 淋巴細胞[53]的促炎細胞因子水平,并且其還可以抑制LTA 誘導的外周血單個核細胞[27]和樹突狀細胞[52]中促炎細胞因子TNF、IL-6 的釋放。
綜上所述,AMPs 的免疫調節活性,見圖1。
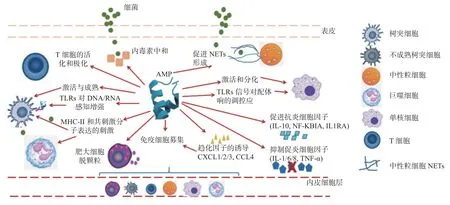
圖1 抗菌肽的免疫調節活性Fig.1 Immunomodulatory activity of AMPs
2 臨床治療的應用和挑戰
隨著細菌對常規抗生素耐藥性的增加,以及缺乏針對耐藥菌感染的新療法[54-55]。人們越來越關注利用AMPs 的免疫調節活性來靶向治療多重耐藥菌。許多具有抗菌和/或免疫調節特性的肽已在臨床上研究了對多重耐藥菌的療效。然而,到目前為止,只有少數AMPs 衍生的化合物進入了臨床,并且大多數臨床試驗側重于局部而不是系統應用[56]。除此之外,AMPs 的臨床應用還與很多因素相關,例如給藥途徑、穩定性、生物利用度、毒性、免疫原性,還與它們昂貴的生產成本有關[57-58]。同時,已有報道顯示AMPs 可以對細菌產生耐藥性[59]。然而,對于具有免疫調節活性的AMPs,其針對的是免疫系統而不是病原體,所以免疫調節肽可以避免細菌耐藥性的問題[54]。
為了使AMPs 在臨床上有更好的應用,有以下幾種方法可以克服AMPs 的蛋白水解敏感性,并改善其穩定性。在化學修飾方面,異構化即用D-氨基酸替換一種或多種L-氨基酸[60];環化即通過引入二硫鍵或連接N 和C 末端來實現[61];脂化即將一個或多個脂肪酸鏈連接到AMPs 的N 末端或賴氨酸殘基的氨基上[62]。除此之外,已經開發了多種遞送系統或納米載體,以提高AMPs 的穩定性和生物利用度,并且可以將其遞送到臨床關注的特定部位,以可控的方式釋放它們[63]。研究最多的AMPs 遞送系統包括脂質體制劑,聚合物納米結構,透明質酸納米凝膠,DNA“籠子”,聚乳酸羥基乙酸共聚物和介孔二氧化硅納米微球等[64-68]。AMPs 還可以與生物聚合物(例如殼聚糖和透明質酸)結合,這些生物聚合物具有多個用于連接肽的官能團,來增加其生物相容性以及抗菌活性[69]。
3 小結
抗生素耐藥性的增加以及缺乏新的治療耐藥菌感染的方法,這使得耐藥菌感染嚴重威脅著人類的生命健康安全。而抗菌肽是一種獨特的分子,有望成為治療多重耐藥菌感染的生物候選者。現在AMPs 已經被證明在機體免疫調節中起著至關重要的作用,如:固有免疫的激活,抗原呈遞和吞噬作用的增強,影響適應性免疫以及強大的抗炎功能。因此,利用AMPs 的免疫調節活性來治療耐藥菌感染被認為是一種新的抗感染治療方法。此外,正在開發許多新方法來改善AMPs 的生物相容性、穩定性以及毒性等。使用這些新方法可以改善AMPs 的局限性,并考慮到現在有大量可用的肽序列,所以可以合理的預測AMPs 將成為未來治療多重耐藥病原體感染的有效藥物。

