妊娠期糖尿病與正常足月兒母親胎盤菌群DNA 的差異
陽情姚,曾 潔,張衛權,寧 月,李 檬,李湛華,劉 梅,熊晶晶,黃永坤
(昆明醫科大學第一附屬醫院兒科,云南 昆明 650032)
微生物群是特定環境中所有微生物的集合,在人體不同部位各不相同,研究發現人體微生物群在代謝、免疫和內分泌等系統中發揮重要作[1-4]。胎盤是母親與胎兒之間重要的紐帶,研究發現當產婦合并妊娠期糖尿病(gestational diabetes mellitus,GDM)時,胎盤組織中的菌群組成和結構可能會發生改變[5-6],而這種菌群的改變可能會導致不良的結果[7-8]。
近年來,GDM 的發生率逐漸升高,預防GDM 的發生、防治其并發癥已成為臨床研究的重要任務。本研究通過16S rDNA 技術檢測和分析足月兒母親的胎盤菌群DNA,探討妊娠期糖尿病與正常足月兒母親之間的胎盤菌群的差異,為研究和防治妊娠期糖尿病提供新思路和參考數據。
1 資料與方法
1.1 研究對象
收集了30 例2018 年2~9 月期間在昆明醫科大學第一附屬醫院產科分娩的足月孕婦胎盤組織。嚴格按照以下入組標準,根據產婦妊娠期間是否伴有妊娠期糖尿病進行分組后得到妊娠期糖尿病組(A 組)4 例(A1~A4)與正常足月兒組(B 組)6例(B1~B6)。
(1)產婦的納入及排除標準[9]:納入標準:規律產檢,年齡為20~45 歲。排除標準:①伴有多胎妊娠、慢性高血壓、內分泌失調、鏈球菌感染、胎膜早破、腫瘤和其他嚴重母體疾病;②伴有吸煙、飲酒、濫用藥物等不良習慣等。(2)新生兒的納入及排除標準[10]:納入標準:37 周≤胎齡 <42 周。排除標準:①胎齡 <37 周或≥42 周;②伴有出生重度窒息、敗血癥等嚴重疾病史。
本研究通過昆明醫科大學第一附屬醫院倫理委員會批準[倫理批號:(2023)倫理L 第38 號],所有研究對象均簽署了知情同意書。
1.2 研究方法
1.2.1 臨床資料收集由專人收集母嬰的臨床數據特征。包括母嬰病史、年齡和孕前BMI、胎齡、出生體重、出生方式、出生時的身長及頭圍、新生兒評分和臍動、靜脈PH 及乳酸等實驗室檢查結果等。
1.2.2 胎盤標本的采集由專人收集標本,胎盤娩出后,將近臍端的羊膜用無菌剪剪除,另換一把無菌剪剪取下方的絨毛狀胎盤膜約1 cm3,隨后放入無菌試管中,并立即保存到-80℃冰箱。所有操作在產后/剖宮產術后1 h 內完成,整個過程遵循無菌操作原則。
1.2.3 胎盤組織中細菌DNA 的提取及測序見圖1。
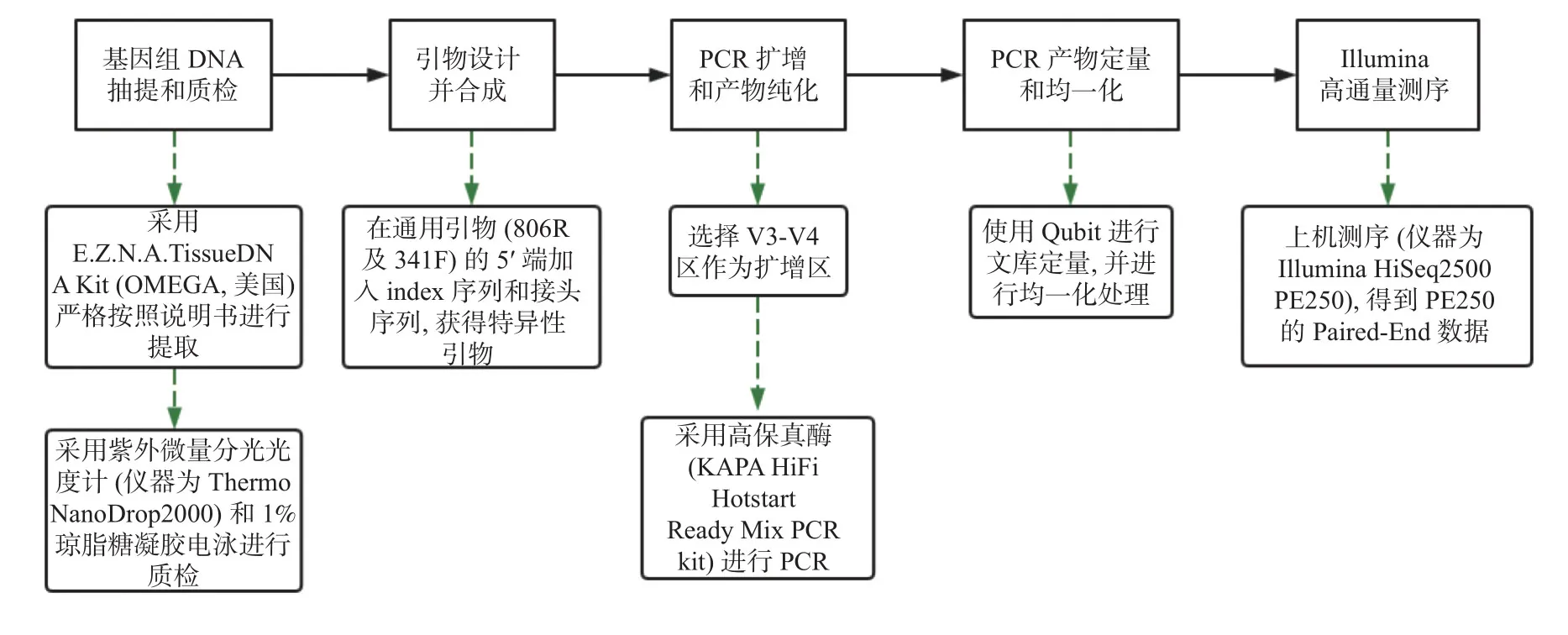
圖1 細菌DNA 的提取及illumina 測序實驗流程圖Fig.1 Experimental flow chart of bacterial DNA extraction and illumina sequencing
1.2.4 對測序序列進行生物信息學處理按97%相似度進行聚類,得到代表物種的OTU,隨后使用Qiime 軟件進行分析,通過與16S 數據庫(RDP,http://rdp.cme.msu.edu)進行比對、分類后得到OTU 豐度表,分別在門(Phylum)水平選取豐度前十五、屬(Genus)水平選取豐度前二十的物種進行統計繪制菌落結構柱狀圖并根據豐度表進行樣本及組間物種的分析。
1.3 統計學處理
2 結果
2.1 一般情況
符合納入標準的對象基本特征,見表1。2 組間嬰兒性別、分娩方式、臍動脈pH 及乳酸、臍靜脈pH 及乳酸、母親年齡、胎齡、出生體重、身長及頭圍間的差異無統計學意義(P>0.05);妊娠期糖尿病組(A 組)母親孕前BMI 高于正常足月兒組(B 組),組間母親孕前BMI 差異有統計學意義(P<0.05)。
表1 A 組與B 組母嬰一般情況比較()Tab.1 Comparison of maternal and infant general conditions between group A and B()
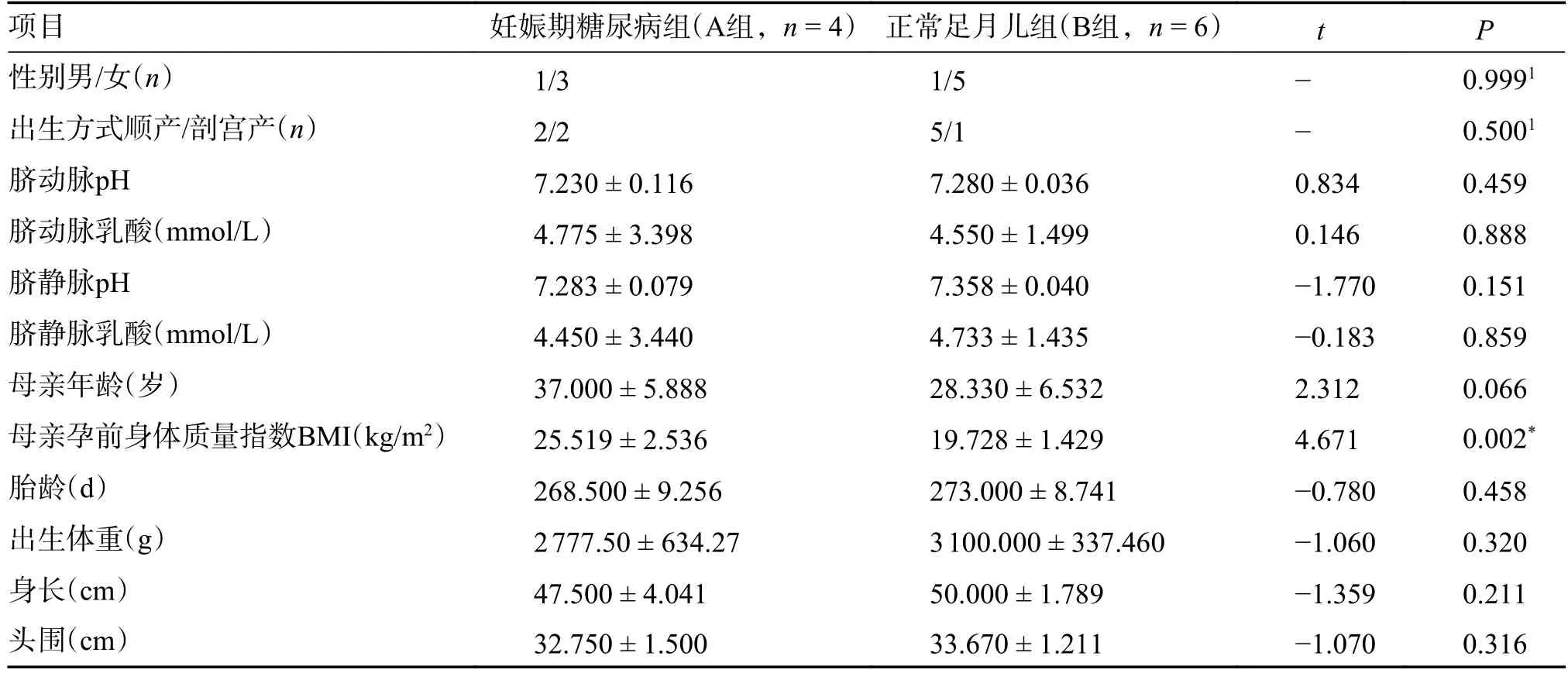
表1 A 組與B 組母嬰一般情況比較()Tab.1 Comparison of maternal and infant general conditions between group A and B()
1為Fisher確切概率法計算的P值,*P <0.05。
2.2 測序數據結果
經過16S rDNA 基因高通量測序,10 個樣本共得到601 794 條有效序列(Clean Reads),平均有效序列數為60 179.4 條,其中最大序列數為64 431 條,最少序列數為55 961 條。
2.3 胎盤菌群OTU 聚類及物種注釋分析
2.3.1 OTU 聚類分析按97%相似度進行聚類,各樣本OUT 數量柱狀圖,平均每個樣本含有171.4 個OTU 數,2 組OTU 數量,差異無統計學意義(P>0.05),見圖2a。所有樣本共檢測出783個OTU,其中妊娠期糖尿病組有427 個OTU,特有OTU 數為154 個,而正常足月兒組有576 個,特有的OTU 為303 個,2 組共有OUT 數量為273 個,見圖2b。

圖2 OTU 數據統計圖(a)和OTU Venn 圖(b)Fig.2 Statistical chart of otu data(a)and OTU Venn chart(b)
2.3.2 物種豐度分析(1)門水平上的物種豐度分析:在門水平上,全樣本豐度明顯占優勢的菌門有Proteobacteria(變形菌門)、Actinobacteria(放線菌門)、Firmicutes(厚壁菌門)、Bacteroidetes(擬桿菌門)、Verrucomicrobia(疣微菌門)、Fusobacteria(梭桿菌門)、Deinococcus-Thermus(異常球菌-棲熱菌門)等,其中變形菌門、放線菌門、厚壁菌門、擬桿菌門的豐度占總樣本豐度的95%以上,見圖3。

圖3 門水平菌落結構柱狀圖Fig.3 Barplot of colony structure at phylum level
(2)屬水平上的物種豐度分析 在屬水平上,全樣本豐度明顯占優勢的菌屬有Arthrobacter(節細菌屬)、Pseudomonas(假單胞菌屬)、Bacteroides(多形桿狀菌屬)、Deiftia、Brevundimonas(短波單胞菌屬)、Lactobacillus(乳桿菌屬)、Chryseobacterium、Acinetobacter(不動桿菌屬)、Klebsiella(克雷伯氏桿菌屬)、Stenotrophomonas(單胞菌屬)、Sphingobacterium(鞘氨醇桿菌屬)、Escherichia/Shigella(埃希氏菌屬/志賀氏菌屬)等,見圖4。
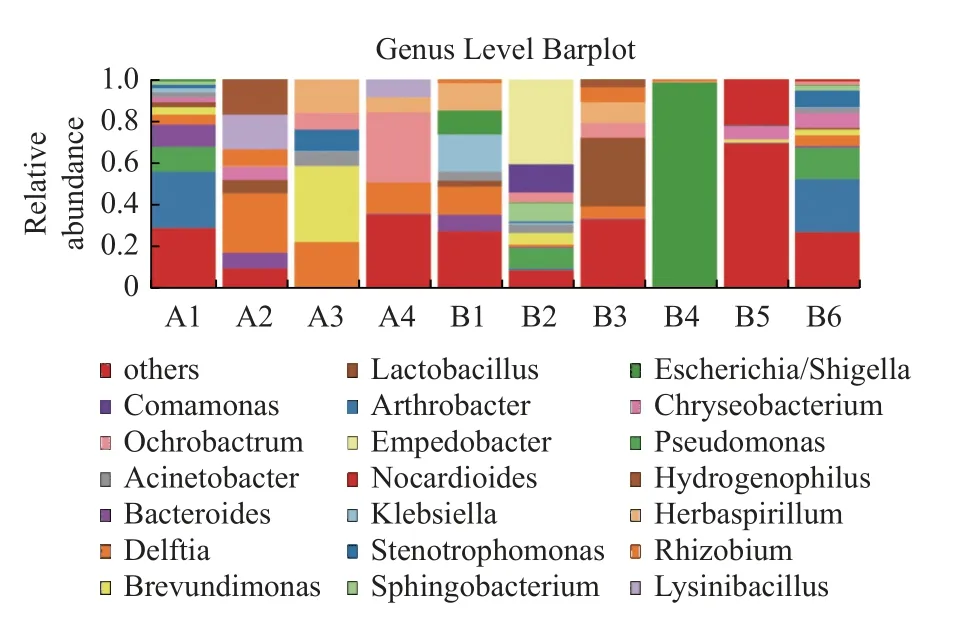
圖4 屬水平菌落結構柱狀圖Fig.4 Barplot of colony structure at genus level
2.3.3 物種豐度聚類熱圖根據物種豐度信息,選取豐度前二十的物種,對樣本和物種進行聚類,并繪制成熱圖。2 組間物種組成及豐度相似,每個物種在各樣本中的豐度如下圖所示,見圖5。
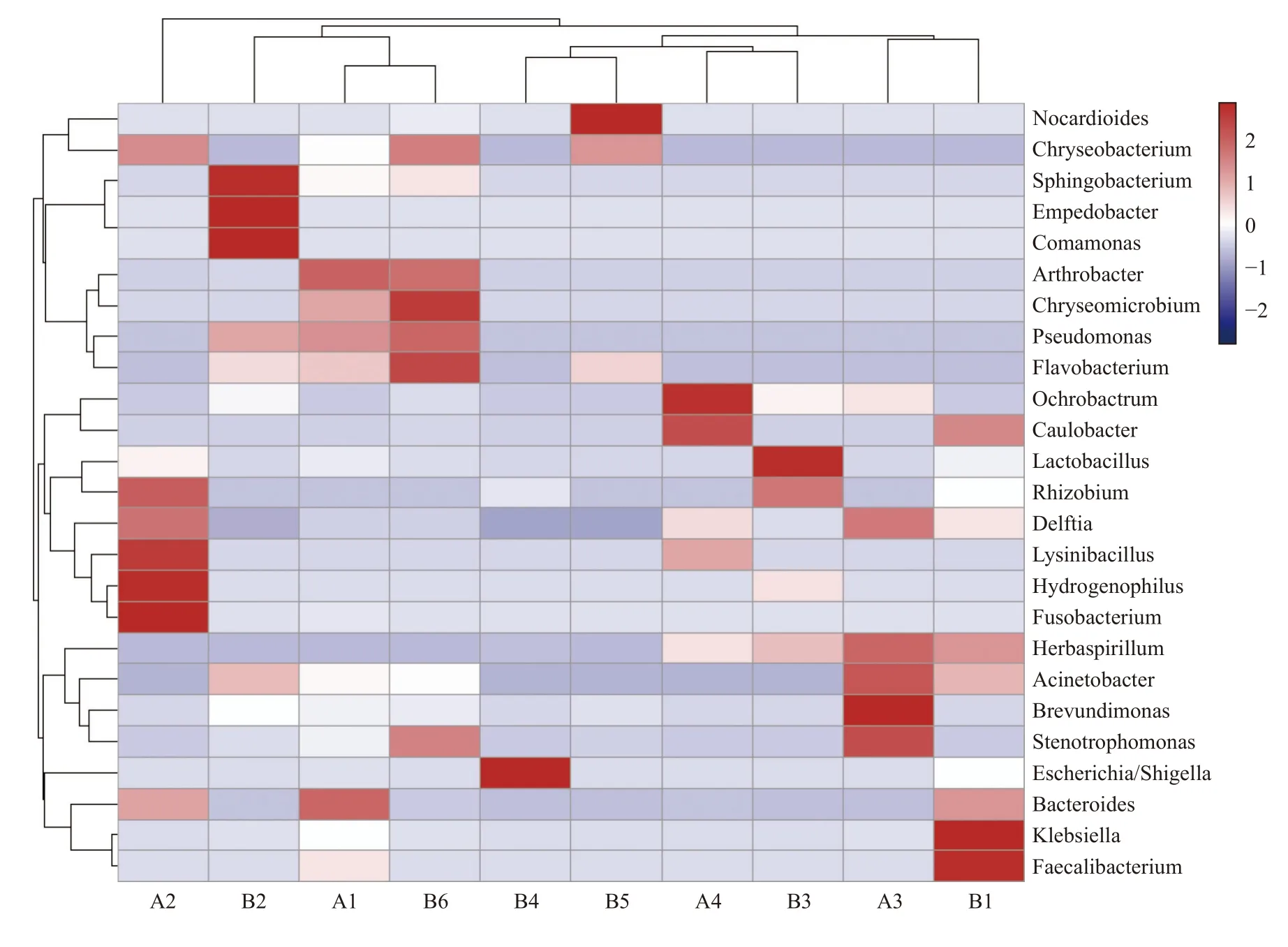
圖5 屬水平物種豐度熱圖Fig.5 Heatmap of species abundance at genus level
橫向聚類表示該物種在各樣本中的豐度相似情況,縱向聚類表示所有物種在不同樣本間表達的相似情況,距離越近,枝長越短,說明越相似;2 到-2 對應顏色變化表示物種豐度逐漸降低。
2.4 胎盤組織菌群多樣性分析
2.4.1 測序量的評估根據曲線跨度和下降趨勢可知,每個樣品中物種的豐富度和均勻度,見圖6;物種積累曲線急劇上升后趨于平緩,說明研究中樣本測序量已經能夠反映樣品中絕大多數的微生物信息,見圖7。
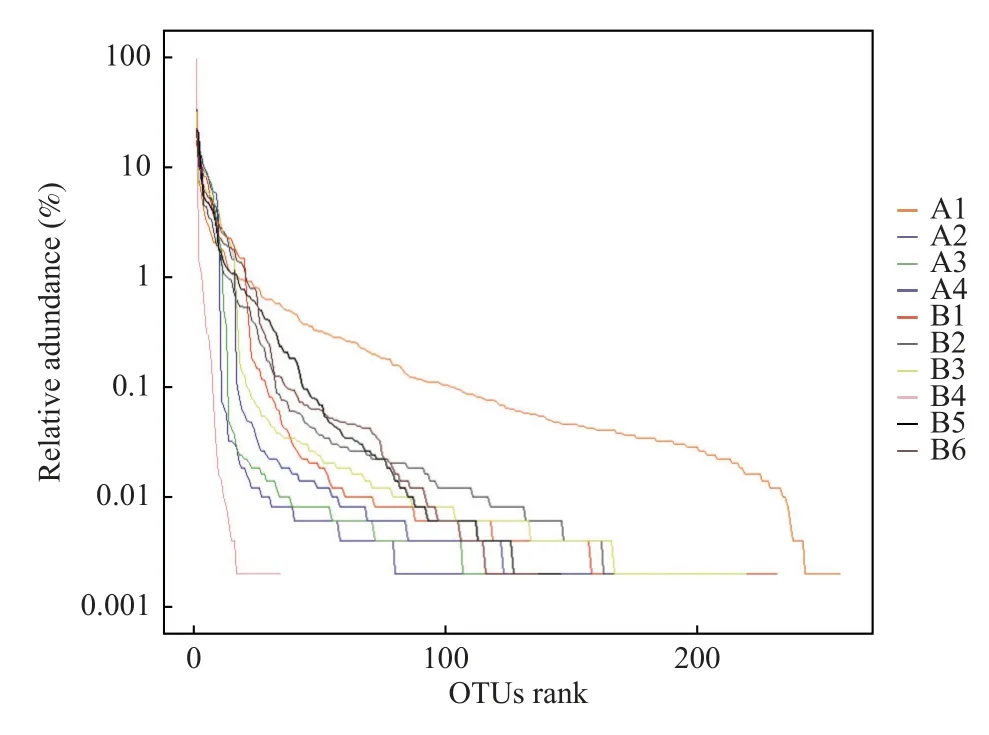
圖6 Rank-abundance 曲線Fig.6 Rank-abundance curves
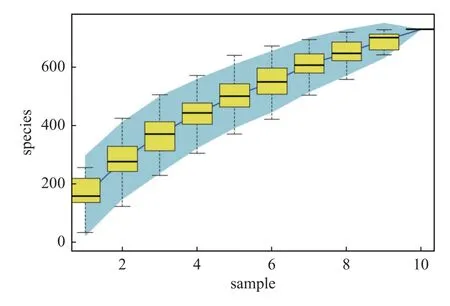
圖7 物種累積曲線Fig.7 Species accumulation curves
物種的豐富度越高,曲線在橫軸上的跨度越大;曲線下降越平緩,物種分布越均勻。
2.4.2 Alpha 多樣性分析A 組與B 組之間的Alpha 多樣性指數差異無統計學意義(P>0.05),見圖8。
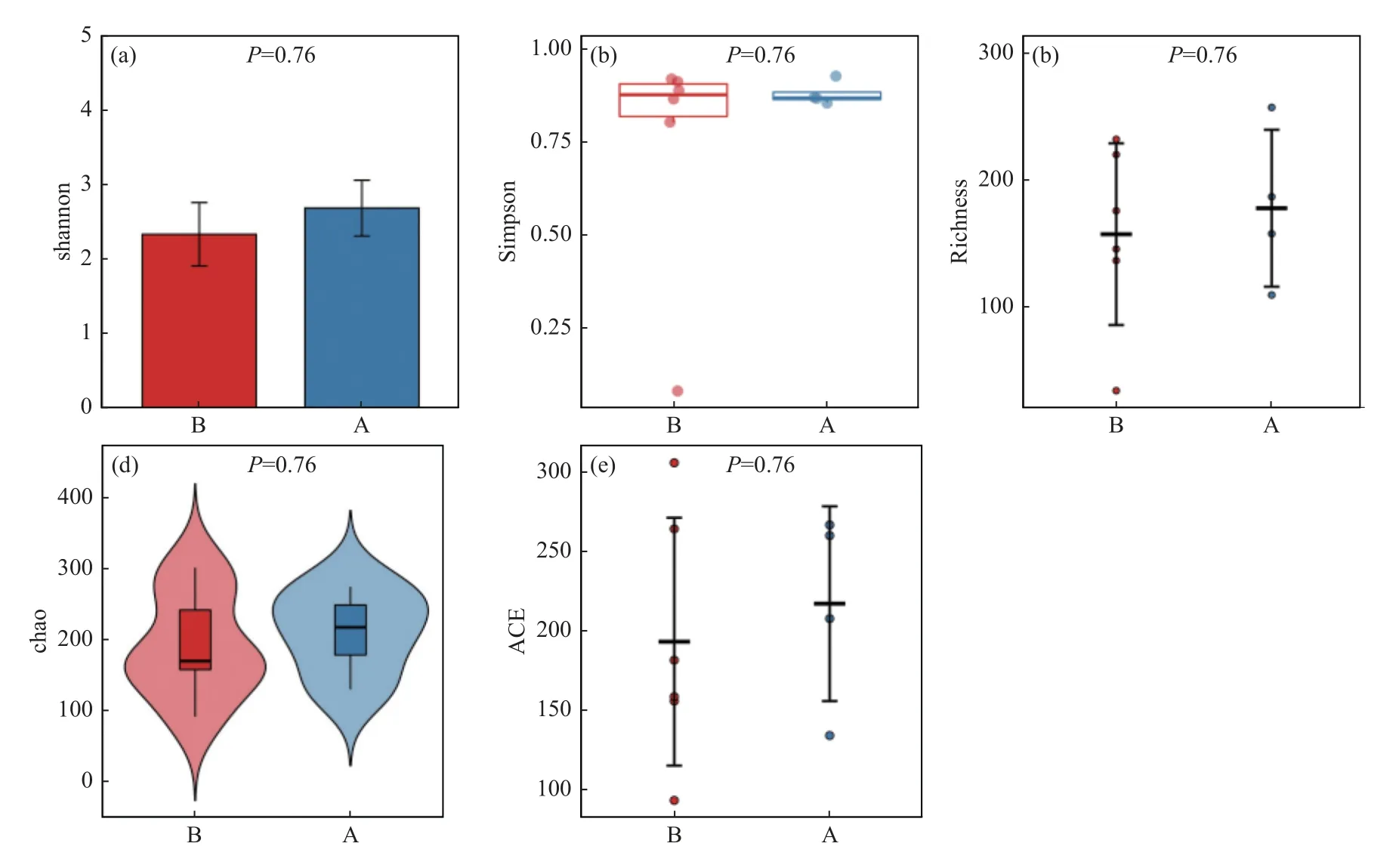
圖8 組間Alpha 多樣性指數差異圖Fig.8 Difference diagram of Alpha diversity index between groups
2.4.3 Beta 多樣性分析(1)NMDS 分析A 組與B 組之間胎盤菌群的物種組成有一定差異,但差異無統計學意義(P>0.05),見圖9。
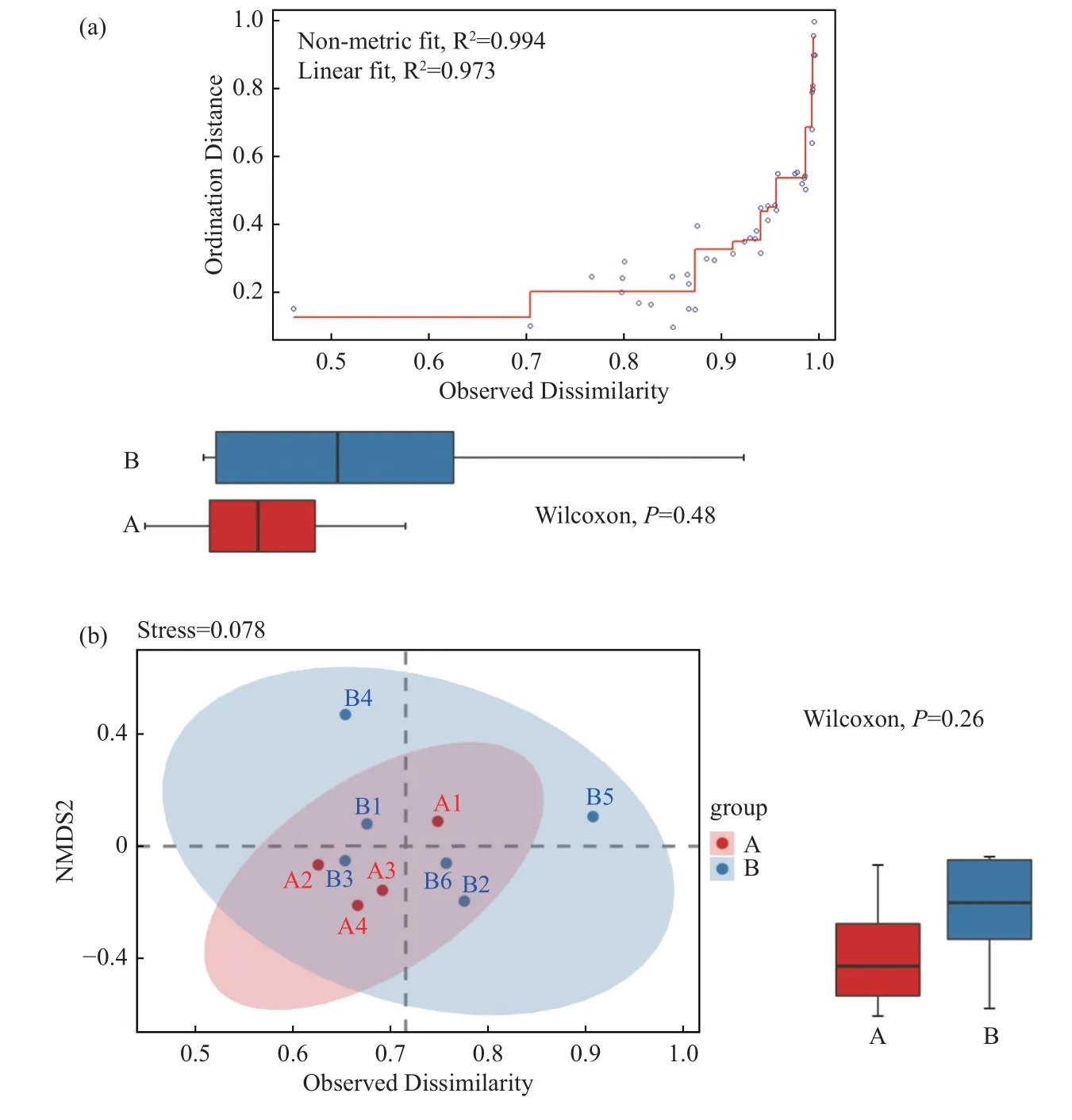
圖9 Shepard 圖(a);NMDS 圖(b)Fig.9 Shepard diagram(a);NMDS diagram(b)
R^2 越大越好/2 個R^2 值越一致越好;Stress <0.2 說明有一定可靠性。
(2)PCoA 分析 A 組與B 組之間胎盤菌群的物種組成有差異,但差異無統計學意義(P>0.05),見圖10。
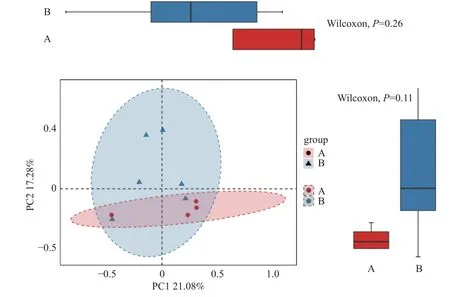
圖10 主坐標分析PCoA 圖Fig.10 Principal Coordinate Analysis Diagram
2.5 組間物種LEfSe 差異分析
組間具有顯著性差異的物種的進化情況,見圖11a;具有顯著性差異的物種有Propionibacteriaceae(丙酸桿菌科)、Propionibacterium(丙酸桿菌屬)、Thermales(棲熱菌目)、Thermaceae(棲熱菌科 )、Thermus(棲熱菌屬)、Collinsella(柯林斯菌屬)、ClostridiumIV(梭狀芽胞桿屬)、Rikenellaceae、Alistipes(另枝菌屬)、Anaerostipes(厭氧棒狀菌屬)(LDA >2),見圖11b。
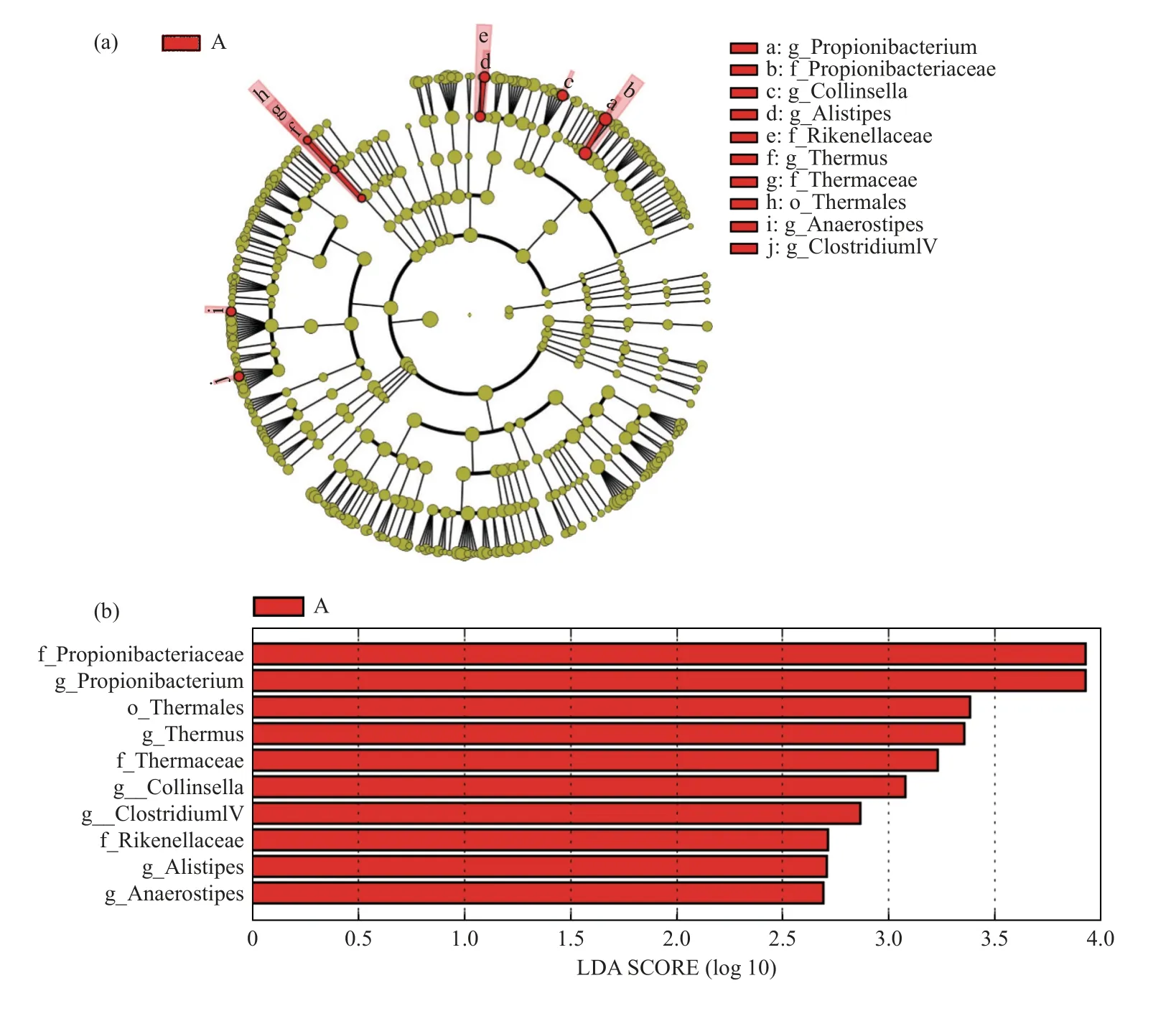
圖11 物種進化樹圖(a);組間 LDA 分值分布圖(b)Fig.11 Phylogenetic tree diagram(a);Distribution chart of LDA scores between groups(b)
3 討論
GDM 是妊娠期最常見的代謝紊亂疾病,近年來中國GDM 患病率呈急劇上升趨勢(8.1%~24.2%)[11]。GDM 的發生受到產婦體重、年齡、遺傳和環境等多方面影響[12-13],Sun 等[14]發現孕前BMI 是GDM 的相關風險因素,本研究同樣發現伴有GDM 與正常妊娠相比較,母親孕前BMI差異有統計學意義。GDM 妊娠與正常妊娠相比,胎盤大小增加,絨毛不成熟和一系列血管病變[15],還可能導致胎盤菌群發生改變[5],給母體、胎兒及后代帶來嚴重的短期和長期健康危害[16-18],然而母親的GDM 狀態如何影響胎盤微生物群的相關機制尚不清楚,可能通過炎癥和氧化應激與GDM 誘導的高血糖狀態相互作用,或通過口腔-胎盤途徑影響胎盤菌群[5]。目前飲食+身體活動干預是預防GDM 的主要方法[19],也有許多針對GDM 的藥物治療,但越來越多的證據表明,孕期使用二甲雙胍這類降糖藥物可能對胎兒生后產生長期的不良后果[20-21]。近年來,益生菌作為一種新的干預措施,在預防妊娠期糖尿病上嶄露頭角[22-24],它能使胰島素抵抗(HOMA-IR)和HOMAB 標記物減少并促進胰島素的分泌[25],影響GDM 孕婦的葡萄糖代謝和體重增加[26],通過調節孕期的微生物組成從而改善產婦健康和妊娠結局[27]。雖然目前大量研究表明服用益生菌對GDM 有一定預防作用,但仍有研究指出益生菌的應用會增加先兆子癇的風險[28]。因而,目前仍然需要個更多的研究來揭示在GDM 中起關鍵作用的菌群、載量及其在誘導疾病中的作用機制,以及需要更高質量、大規模的臨床試驗來評估益生菌的最佳劑量和理想細菌組成,從而促進孕期母嬰的健康。
本研究檢測的胎盤組織中的微生物群主要由變形菌門、放線菌門、厚壁菌門、擬桿菌門等菌門組成,其中變形菌門的相對豐度最高,這與Zheng 等[29]、Bassols 等[30]研究結果一致。屬水平上以節細菌屬、假單胞菌屬、多形桿狀菌屬、Deiftia、短波單胞菌屬、乳桿菌屬、Chryseobacterium、不動桿菌屬、克雷伯氏桿菌屬、單胞菌屬、鞘氨醇桿菌屬、埃希氏菌屬/志賀氏菌屬等菌屬為主的菌群,Zakis 等[31]、Tang 等[6]及本課題前期研究[10]發現的菌屬大致相同。
本研究2 組菌群的物種豐度在門、綱水平上無顯著差異,而在目至屬水平上,發現棲熱菌目、丙酸桿菌科、棲熱菌科、Rikenellaceae、丙酸桿菌屬、棲熱菌屬、柯林斯菌屬、梭狀芽胞桿屬IV、另枝菌屬、厭氧菌屬的豐度在妊娠期糖尿病組中較正常足月兒組顯著升高,暫未發現有顯著豐度降低的菌類。Bassols[30]等發現GDM 婦女的胎盤微生物群中假單胞菌目和不動桿菌屬的相對豐度較低,另一研究[7]發現雙歧桿菌屬,Duncaniella,及瘤胃球菌屬在GDM 中顯著升高,Tang 等[6]發現GDM 婦女的胎盤菌群多樣性增加,其中Anaerotruncus 瘤胃球菌屬、糞球菌屬、副普雷沃菌屬及乳酸桿菌屬的豐度在GDM 中升高,然而韋榮氏菌屬豐度降低。綜上,多個學者證實GDM 婦女的胎盤菌群與正常婦女對比存在差異,但具體顯著性差異的菌類各不相同,一方面可能樣本量相對較小,也有可能是胎盤菌群本身的個體差異。
本研究通過Illumina MiSeq 測序系統對胎盤組織的菌群DNA 進行檢測和分析,嚴格執行無菌操作,從胎盤組織中成功分離和鑒定了微生物序列,證明了胎盤組織中存在著一定量的細菌群落DNA,而胎盤菌群的組成、豐度在妊娠期糖尿病與正常足月兒中有顯著性差異,而這些顯著性差異的菌類可能是妊娠期糖尿病的潛在致病菌并長期影響母嬰的健康。本研究也為全面、準確地獲得胎盤菌群的信息做出了貢獻,為妊娠期糖尿病婦女的胎盤宏基因組研究奠定了重要的理論基礎。

