抗桃樹細菌性穿孔病植物內生菌的篩選及其抑菌機制研究
曹鵬飛 吳華芬 陳銀華
摘要:桃樹細菌性穿孔病發生普遍,嚴重制約了桃產業的發展。為研究植物內生菌對桃樹細菌性穿孔病病原菌的抑制作用,從健康桃樹、博落回、金銀花、板栗等健康植物材料中分離篩選出優勢拮抗內生菌株,并測定其胞外代謝產物對病原菌細胞膜與細胞壁通透性、纖維素酶活性、胞外多糖(EPS)含量、呼吸代謝、核酸含量的影響。結果表明,分離得到的45株內生菌中,從金銀花植株中分離的曲霉屬JYY-3菌株抑菌效果最好,其最小抑菌濃度(MIC)、最低殺菌濃度(MBC)分別為50、200 mg/mL。經該菌株胞外代謝產物處理后,桃樹細菌穿孔病病原菌核酸泄漏量、AKP活性和電導率顯著提高,且濃度越高效果越明顯。此外,JYY-3菌株胞外代謝產物能顯著降低病原菌纖維素酶活性、EPS含量、DNA和RNA含量,抑制其琥珀酸脫氫酶(SDH)、蘋果酸脫氫酶(MDH)活性,且濃度越高作用越強,經2.0MIC 菌株JYY-3代謝產物處理12 h后,桃樹細菌穿孔病病原菌的SDH、MDH活性較對照組分別降低107.644、13.729 U/mg。可見,金銀花內生菌株JYY-3對桃樹細菌性穿孔病病原菌有顯著的抑制作用,可通過抑制纖維素酶活性及EPS合成以減弱病原菌入侵植物能力,增大細胞壁和細胞膜通透性使內容物外泄,抑制核酸合成以及呼吸酶活性等途徑抑制病原菌的繁殖。本研究結果為植物內生菌防治桃樹細菌性穿孔病的進一步研究奠定了理論基礎。
關鍵詞:桃樹細菌性穿孔病;植物內生菌;抑菌活性;抑菌機制;胞外代謝產物
中圖分類號:S436.621.1+9文獻標志碼:A文章編號:1002-1302(2023)17-0131-07
桃樹細菌性穿孔病是由黃單胞桿菌屬甘藍黑腐黃單胞菌(Xanthomonas campestris pv. pruni)侵染造成的劣性病害[1]。該病害在全國各地普遍發生,發病時間多在4—5月中旬,8月為發病盛期。若該病防治不及時,常造成大量落葉,營養累積減少,花芽形成異常,最終導致樹勢衰落,嚴重制約桃產業的發展。目前針對桃樹細菌性穿孔病的防治主要以傳統防治和化學防治為主,常用的化學農藥主要有葉枯唑可濕性粉劑、二氯異氰酸鈉、波爾多液及噻菌銅等[2]。這些化學農藥主要在植株發病初期使用才能達到較好的防效,但隨著病害的大面積暴發,防效會明顯降低。同時,隨著化學農藥的反復使用常造成農藥殘留、環境污染等一系列問題。因此,尋找低毒、高效的防治手段迫在眉睫。
植物內生菌(endophyte)是存活于健康植物組織內部、不引發宿主植物表現出明顯感染癥狀的微生物類群,是其微生態系統的重要組成部分[3-4]。據研究表明,許多內生菌能產生抗生素、水解酶類、黃酮和生物堿等次級代謝產物,可抵抗宿主植株中致病菌引起的病害發生[5]。目前已有學者對內生菌防治果樹細菌性病害做了一定的研究,如劉冰等從臍橙中分離獲得1株對柑橘潰瘍病防效達89.4%的內生細菌[6];崔麗紅等通過拮抗活性試驗從9株絞股藍根際內生菌中篩選出3株對獼猴桃潰瘍病致病菌有明顯抑制效果的內生菌,經盆栽試驗表明這3株菌均可降低致病菌入侵植物體內的概率[7]。近年來,雖已分離出一些拮抗作用較強的內生菌,但主要用于果樹潰瘍病的防治,對于桃樹細菌性穿孔病防治及其機制研究少有報道。因此,本研究從健康植株中分離篩選出對桃樹細菌性穿孔病有拮抗作用的菌株,并對其抑菌機制進行初步研究,旨在為桃樹細菌性穿孔病提供新的防治途徑,為內生菌防治桃樹細菌性穿孔病提供理論支撐。
1 材料與方法
1.1 植物材料與供試菌株
1.1.1 植物材料
健康的桃樹、板栗植株,采自浙江省麗水市蓮都區雙黃鄉雨傘崗;金銀花和博落回采自蓮都區白云山。以上樣品均于2022年3月5日采回進行內生菌的分離。
1.1.2 供試菌株
桃樹穿孔病病原菌甘藍黑腐黃單胞菌,從患病的桃樹莖部分離獲得。
1.2 培養基與試劑
1.2.1 培養基
試驗主要培養基有牛肉膏蛋白胨培養基、PDA培養基、高氏一號培養基,分別用于植物內生細菌、真菌和放線菌的分離與培養。
1.2.2 主要試劑
試驗主要試劑有堿性磷酸酶(AKP)、蘋果酸脫氫酶(MDH)、琥珀酸脫氫酶(SDH)等試劑盒均購自南京建成生物工程研究所,DAPI熒光染料購自Gen-View科技有限公司。
1.3 主要儀器
試驗主要儀器有熒光分光光度計(天津拓普儀器有限公司,F97)、顯微鏡(徠卡顯微系統,DMi8)、電導率儀(上海雷磁新涇儀器有限公司)、紫外可見分光光度計(上海光譜儀器有限公司,SP-756P)等。
1.4 植物內生菌的分離與優勢拮抗菌株的篩選
1.4.1 植物內生菌株的分離及其胞外代謝產物的制備
采用組織塊分離法[8],將健康桃樹、板栗、博落回、金銀花等植物的根、莖、葉消毒后,接種于牛肉膏蛋白胨、PDA、高氏一號培養基平板上,于適宜溫度培養1~7 d,每天觀察各平板上的菌落形態、顏色等特征,挑取菌落形態明顯不同的單菌落經純化后于4 ℃保存。將各菌株接入相應的培養液,于適宜溫度振蕩培養1~5 d,4 000 r/min離心10 min,取上清于55 ℃蒸發濃縮至20 mL后冷凍干燥,配成0.2 g/mL母液,用0.22 μm的無菌過濾器過濾除菌后低溫保存備用。
1.4.2 優勢拮抗菌株的篩選及MIC、MBC測定
取活化24 h的桃樹穿孔病病原菌甘藍黑腐黃單胞菌于牛肉膏液體培養基培養至對數期,稀釋成2×107 CFU/mL。用濾紙片法[9]測定各內生菌菌株對病原菌的抑菌圈大小,初步篩選出優勢菌株。用二倍稀釋法[10]將初篩菌株胞外代謝產物稀釋成1.562 5~400.000 0 mg/mL,每管加入2.5 mL對數期病原菌菌懸液(濃度為107 CFU/mL),以未接菌的培養液為對照,28 ℃ 振蕩培養24 h后加入配制好的 2,3,5-三苯基氯化四氮唑(TTC)染液? 5 μL,2 h后觀察培養液顏色的變化,以未出現顏色的最低濃度為該菌株的最小抑菌濃度(MIC)[11]。以MIC最小的菌株為優勢拮抗菌株。取優勢菌株無色菌懸液進行平板計數,以剛好無菌落生長的濃度為最低殺菌濃度(MBC)。
1.5 優勢拮抗菌株 JYY-3的鑒定
參考《真菌鑒定手冊》[12],通過觀察優勢拮抗菌株 JYY-3 菌落的形態、大小、顏色以及菌絲、孢子和產孢結構等顯微特征,以初步鑒定其種屬。
1.6 優勢拮抗菌株 JYY-3抑菌機制確定
1.6.1 菌株JYY-3胞外代謝產物對病原菌生長曲線的影響
將培養好的甘藍黑腐黃單胞菌菌懸液與菌株JYY-3胞外代謝產物等體積混合培養,使胞外代謝產物終濃度分別為0.5、1.0、2.0倍MIC,以不加胞外代謝產物為對照,28 ℃振蕩培養0、1、2、4、6、8、10、14、18、24 h后進行平板菌落計數[13],以培養時間為橫坐標、菌落數為縱坐標,繪制菌株 JYY-3不同濃度胞外代謝產物作用下病原菌的生長曲線。
1.6.2 菌株JYY-3胞外代謝產物對病原菌細胞膜、細胞壁的影響
取病原菌菌懸液加入胞外代謝產物,使其終濃度為分別為0.5、1.0、2.0倍MIC,振蕩培養0、1/6、1/3、1/2、2/3、5/6、1、2、8 h后取菌懸液,10 000 r/min、4 ℃離心10 min,取上清液測定電導率。取培養好的病原菌菌液于4 000 r/min離心 10 min,取沉淀用1×PBS緩沖液洗滌2次后用PBS緩沖液制成2×107CFU/mL菌懸液,加入胞外代謝產物,使其終濃度分別為0.5、1.0、2.0倍MIC,振蕩培養0、1、2、3、4、5、6 h后取菌懸液,離心取上清液于260 nm處測定吸光度。另外按上述方法配制混合培養液,培養 0、0.5、1.0、1.5、2.0、2.5、3.0、3.5、4.0 h后離心取上清,按試劑盒說明書測定堿性磷酸酶的活性。
1.6.3 菌株JYY-3胞外代謝產物對病原菌致病能力的影響
取病原菌菌液加入胞外代謝產物,配制混合培養液,培養2、4、12、24 h后取菌懸液,用二硝基水楊酸(DNS)法[14]測定纖維素酶活力。取病原菌菌液加入胞外代謝產物,使其終濃度分別為 1/128MIC、1/64MIC、1/32MIC,培養0、6、12、24、48 h后取菌懸液,3 000 r/min離心10 min,取沉淀,蒸餾水洗滌3次(10 000 r/min,10 min),合并上清液,取1 mL加入4 mL無水乙醇沉淀多糖,3 000 r/min離心10 min,1 mL 蒸餾水復溶多糖,采用濃硫酸苯酚法[15]測定病原菌的胞外多糖(EPS)含量。
1.6.4 菌株JYY-3胞外代謝產物對病原菌呼吸代謝的影響
取病原菌菌懸液加入胞外代謝產物,使其終濃度分別為0.5、1.0、2.0倍MIC,振蕩培養2、6、12、24 h后取菌懸液,于5 000 r/min,4 ℃條件下離心5 min,參照黃燕飛的方法[16]制備粗酶液,按試劑盒說明書測定琥珀酸脫氫酶(SDH)和蘋果酸脫氫酶(MDH)的活性,其活性以1 mg蛋白所含的活力單位數表示(U/mg)。
1.6.5 菌株JYY-3胞外代謝產物對病原菌核酸合成的影響 取病原菌菌懸液加入胞外代謝產物,使其終濃度分別為0.5、1.0、2.0倍MIC,振蕩培養4、12、24 h后取菌懸液稀釋至600 nm下吸光度為0.5,用4′,6-二脒基-2-苯基吲哚(DAPI)染色法[17]處理病原菌,于倒置熒光顯微鏡下觀察熒光強度;用熒光分光光度計分別于364、400 nm 下測定病原菌 DNA和RNA的熒光強度。
1.7 數據分析
試驗數據均用DPS數據處理系統軟件進行分析。
2 結果與分析
2.1 植物內生菌的分離與優勢拮抗菌株的篩選
本試驗從健康桃樹、博落回、板栗和金銀花中共分離出45株內生菌,其中內生細菌和內生真菌各19株,內生放線菌7株。在4種植株中,從桃樹上分離得到的內生細菌和內生真菌最多,分別為6、8株,內生放線菌于板栗中未有分離獲得,在其余植株中分離得也較少,總計僅7株。拮抗試驗結果表明,在這45株內生菌中共有38株對桃樹穿孔病病原菌甘藍黑腐黃單胞菌有抑制效果,其中15株內生細菌,18株內生真菌,5株內生放線菌。抑制效果較好的菌株分別為分離自桃樹的內生菌株TY-1和TG-6及金銀花內生菌株JYY-3,其抑菌圈直徑分別達9.98、10.18、20.50 mm。經TTC染色法分析可知,分別經1.562 5~400.000 0 mg/mL 內生菌株TY-1、TG-6、JYY-3 代謝產物處理后,桃樹細菌穿孔病病原菌培養液顏色隨胞外代謝產物濃度增大而變淺直至無色,其中JYY-3菌株處理組在 50 mg/mL 時開始出現無色,TY-1、TG-6菌株2個處理組均在400 mg/mL時才呈無色。這表明3個菌株的胞外代謝產物均能抑制桃樹細菌穿孔病病原菌生長,其中JYY-3菌株MIC為50 mg/mL,TY-1與TG-6菌株MIC均為400 mg/mL。MIC越小,說明其拮抗能力越強,故金銀花內生菌株JYY-3為優勢拮抗內生菌。由平板菌落計數結果可知,當菌株JYY-3代謝產物終濃度≥200 mg/mL時,平板上無菌落生長,因此其MBC為200 mg/mL。
2.2 優勢拮抗菌株JYY-3的鑒定
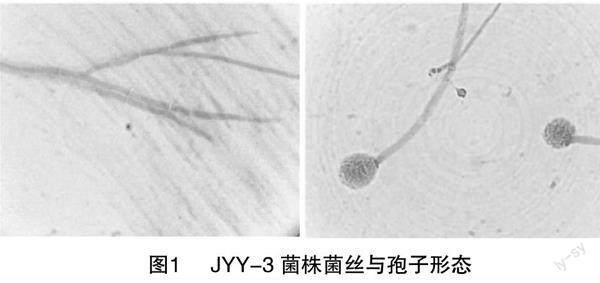
金銀花內生菌株JYY-3的菌絲白色,疏松,菌落形態為圓形,向四周擴散,產綠色孢子;孢子梗光滑,呈桿狀,頂端著生分生孢子團;孢子呈球形或卵狀(圖1),根據《真菌鑒定手冊》可初步確定JYY-3菌株為曲霉屬內生真菌。
2.3 優勢拮抗菌株JYY-3對甘藍黑腐黃單胞菌的抑菌機制
2.3.1 對桃樹細菌穿孔病病原菌生長曲線的影響
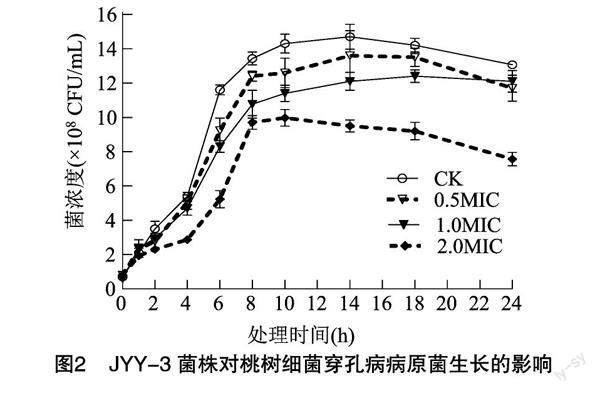
由圖2可知,對照組幾乎觀察不到遲緩期,在4 h處即開始進入對數期,病菌大量繁殖,菌體數量迅速增加。經各濃度JYY-3菌株胞外代謝產物處理后,病原菌菌體濃度較對照組極顯著下降(P<0.01),0.5MIC、1.0MIC 胞外代謝產物處理組的病原菌菌體均在4 h處進入對數期,但菌體數量增加較對照組小;2.0MIC處理組的病原菌增長最為緩慢,10 h后開始明顯下降。各濃度處理組在14 h時的病原菌菌濃度與對照差異較大,分別減少10.23%、21.42%、36.36%,表明金銀花內生菌株JYY-3胞外代謝產物可通過延長遲緩期或減弱穿孔病菌對數期,有效抑制菌體增長,達到抑菌效果,且濃度越大,抑制作用越明顯。
2.3.2 對桃樹細菌穿孔病病原菌細胞膜的影響
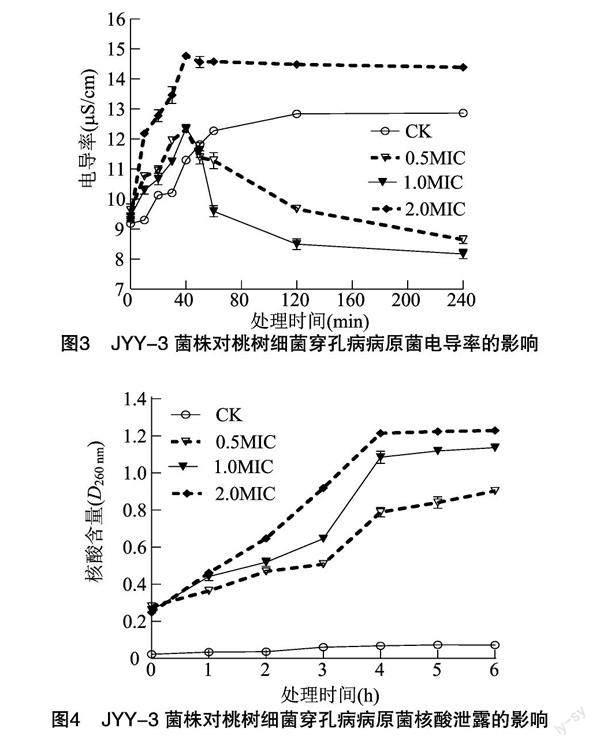
細胞通透性的改變會引起胞內成分如鉀離子、鈉離子、核酸等物質的釋放[18],因此,可通過測定 JYY-3 菌株胞外代謝產物作用后穿孔病病原菌培養液電導率和核酸含量的變化來研究其對菌體細胞膜的影響。由圖3可知,隨處理時間的延長,對照組電導率于80 min內穩步上升,之后趨于穩定,這可能與病原菌菌體濃度的升高有一定的關系[19]。而在0~40 min內,各濃度JYY-3菌株胞外代謝產物處理組的電導率較對照組極顯著上升(P<0.01),在40 min時達到最大,分別比對照組高0.94、1.06、3.47 μS/cm,說明高濃度的胞外代謝產物對細胞膜的影響較大,能使原生質及電解質外滲,增大細胞膜的通透性。之后隨作用時間延長,2.0MIC組電導率略有下降,但高于對照組。1.0MIC、0.5MIC組電導率顯著下降,明顯低于對照組,這可能是由于JYY-3菌株代謝產物濃度較小,致使后期隨著藥效下降使其對病原菌細胞膜的作用減弱;反而可能由于對金屬離子有螯合作用,使其電導率降低[19]。由圖4可知,隨著處理時間延長,對照組胞外大分子物質核酸含量維持在較低水平,而經JYY-3菌株胞外代謝產物處理后,菌體在260 nm處的吸光度顯著高于對照組(P<0.05),在6 h時0.5MIC、1.0MIC、2.0MIC 組分別較對照高0.85、1.06、1.16,可見JYY-3菌株胞外代謝產物濃度越高,從菌體內流出的 DNA、RNA 等大分子物質成分越多,菌體細胞膜受損越嚴重。
2.3.3 對桃樹細菌穿孔病病原菌細胞壁的影響
堿性磷酸酶(AKP)是存在于細菌細胞壁與細胞膜之間的一種酶,在菌體正常生長時胞外不能檢測到該酶活性,但當細胞壁破壞后,將大量泄漏到胞外[20]。由圖5可知,在0~4.0 h的處理時間內,對照組AKP活性始終較低,表明病原菌生長較好,細胞壁完整。但經不同濃度JYY-3菌株胞外代謝產物處理后,在最初的3.0 h內AKP活性迅速上升,之后趨于穩定,且胞外代謝產物濃度越高,AKP活性越高。這說明金銀花內生菌株JYY-3胞外代謝產物能破壞桃樹細菌穿孔病病原菌細胞壁的完整性,并且在較短的時間內就能造成菌體細胞壁通透性的增加。
2.3.4 對桃樹細菌穿孔病病原菌纖維素酶的影響
纖維素酶是病原物產生的、能引起植物致病的重要因子,可通過水解宿主植物細胞壁組分使病原菌穿入并侵染宿主組織[21]。因此可通過測定纖維素酶的活性來研究JYY-3菌株胞外代謝產物對穿孔病菌侵入能力的影響。由圖6可知,試驗組穿孔病菌纖維素酶活性極顯著低于對照組(P<0.01),且胞外代謝產物濃度越高,其活性越低。隨胞外代謝產物處理時間的延長,纖維素酶活性不斷下降,在12 h時與對照組差異最大,經0.5MIC、1.0MIC、2.0MIC胞外代謝產物作用后的菌體纖維素酶活性分別下降了50.43%、58.81%和74.87%。這表明金銀花內生菌株JYY-3胞外代謝產物能通過抑制纖維素酶的活性來減弱桃樹細菌穿孔病病原菌對宿主細胞細胞壁的破壞作用,從而削弱病原菌入侵能力,且胞外代謝產物濃度越高,效果越好。
2.3.5 對桃樹細菌穿孔病病原菌胞外多糖(EPS)的影響
EPS是病原菌的致病生化因子,可導致宿主局部組織壞死,有助于病原菌抵御宿主細胞產生的抗菌活性物質或氧化劑的攻擊,也能干擾宿主對病原菌的免疫識別[22]。由圖7可知,經JYY-3菌株胞外代謝產物處理后穿孔病病原菌菌體EPS含量極顯著的低于對照組。隨著濃度的升高,EPS含量逐漸降低,其中1/20MIC組含量最低。這說明金銀花內生菌株JYY-3胞外代謝產物能抑制桃樹細菌穿孔病病原菌胞外多糖的合成,使其毒性和擴散能力降低,起到抑制病原菌致病性的作用,且胞外代謝產物濃度越高,抑制作用越強。
2.3.6 對桃樹細菌穿孔病病原菌呼吸代謝的影響
琥珀酸脫氫酶(SDH) 和蘋果酸脫氫酶(MDH)存在于所有氧呼吸細胞中,是三羧酸循環中的2種關鍵酶類,在電子傳遞與能量轉換中起著關鍵作用[23-24]。由圖8、圖9可知,0~2 h內,不同濃度JYY-3菌株胞外代謝產物處理組的SDH、MDH活性極顯著低于對照組。在12 h,2種酶活性下降最大,其中2.0MIC處理組SDH、MDH的活性最低,較對照組分別降低107.644、13.729 U/mg。這表明金銀花內生菌株JYY-3可通過抑制SDH、MDH活性以抑制桃樹細菌穿孔病病原菌的呼吸作用,從而對能量代謝系統產生影響,且濃度越高,影響越大。
2.3.7 對桃樹細菌穿孔病病原菌胞內核酸含量的影響 蛋白質、DNA和RNA是衡量菌體生長狀況的重要生物大分子,三者合成若受到影響會造成代謝紊亂[24-25]。由圖10可知,經JYY-3菌株胞外代謝產物處理后,病原菌熒光強度明顯降低,且濃度越高,熒光亮度越弱。由圖11、圖12可知,胞外代謝產物處理組DNA、RNA含量均極顯著減少(P<0.01),經2.0MIC胞外代謝產物作用24 h后,穿孔病菌DNA、RNA含量分別減少了58.46%、77.8%,表明JYY-3菌株胞外代謝產物對桃樹細菌穿孔病病原菌DNA、RNA的合成有抑制作用,且胞外代謝產物濃度越大,對病原菌正常生長代謝影響越嚴重。
3 討論與結論
本試驗從健康金銀花、桃樹、博落回、板栗植株中共分離得到45株內生菌,包括19株內生細菌,19株內生真菌,7株內生放線菌,其中抑菌活性最強的為從金銀花植株中分離的JYY-3菌株,經鑒定為曲霉屬。李瑾也證實金銀花內生真菌JY-2也具有較好抑菌活性,但經鑒定其為鐮刀菌屬[26]。MIC測定結果表明,JYY-3菌株胞外代謝產物對桃樹細菌穿孔病病原菌甘藍黑腐黃單胞菌的最低抑菌濃度為50 mg/mL,當其等于或高于此濃度時能延長穿孔病菌遲緩期或減弱其對數期,使菌濃度保持在較低水平,以此達到抑制病原菌生長的目的。
病原菌在生長和繁殖過程中釋放的代謝產物對于菌體吸收營養物質、吸附和入侵宿主機體以及抵抗宿主免疫因子的反應等具有極為重要的作用[27-29]。如林海云等在青枯雷爾氏菌致病機制研究中發現,病菌分泌的胞外多糖及纖維素酶可加快其在植物體內的擴散,進而造成植株萎蔫或死亡[30]。因此,可通過抑制纖維素酶、胞外多糖等物質合成來抑制病原菌對植物的入侵作用,如王芳研究發現,從苦參中篩選出的B36菌株能有效抑制葉霉病菌纖維素酶活性,從而降低其入侵番茄植株能力[31]。黃青春發現,拌種靈可通過抑制柑橘潰瘍病病原菌胞外多糖分泌從而抑制該病害在植株中生長[32]。本試驗研究結果也顯示,經JYY-3菌株胞外代謝產物處理后,病原菌胞外多糖合成和纖維素酶活性在24 h較對照組分別降低58.81%、74.87%,這表明金銀花內生菌株JYY-3胞外代謝產物可通過弱化胞外多糖的分泌及纖維素酶的活性來抑制桃樹細菌穿孔病病原菌在植株中的生長及致病能力。
已有研究證實,許多活性成分的抑菌機制主要是通過破壞細胞壁及細胞膜的完整性和抑制蛋白、核酸的合成等途徑來實現[33]。細胞膜和細胞壁是許多藥物發揮抑菌作用的靶點,如謝晶等研究植酸對腐敗希瓦氏菌的抑菌機制時發現,藥物作用會導致細胞膜和細胞壁結構的破壞,使通透性增大,導致細菌內容物的外漏,使培養液電導率和AKP活性上升[19]。本試驗也發現,經JYY-3菌株胞外代謝產物處理后,桃細菌穿孔病病原菌培養液中電導率和核酸含量、AKP活性均較對照組顯著上升,這說明金銀花內生菌株JYY-3可通過破壞病菌的細胞膜及細胞壁完整性以抑制桃樹細菌穿孔病病原菌的生長。
蛋白質是生物生命活動的主要承擔者,而核酸是遺傳信息的攜帶者,核酸含量的減少,會直接導致蛋白合成量的降低,從會嚴重影響菌體細胞的各項生理機能[34]。本試驗結果表明,經JYY-3菌株胞外代謝產物作用后,桃細菌穿孔病病原菌DNA和RNA含量極顯著低于對照組,這說明金銀花內生菌株JYY-3胞外代謝產物可明顯抑制病原菌核酸的合成,從而影響其各項生理機能。另一方面,呼吸代謝是生物體進行各項生命活動的重要基礎,若病原菌的呼吸鏈被阻斷,其生長所需的能量就無法合成[23-24]。本試驗結果顯示,經菌株JYY-3胞外代謝產物處理后,桃細菌穿孔病病原菌呼吸代謝所必需的琥珀酸脫氫酶、蘋果酸脫氫酶活性被顯著抑制。這表明,金銀花內生菌株JYY-3可通過抑制琥珀酸脫氫酶和蘋果酸脫氫酶活性以阻斷桃細菌穿孔病病原菌的呼吸鏈,進而抑制其生長。其作用機制可能是胞外代謝產物中的有效成分與這2個酶側鏈的氨基酸結合,改變其構象,使酶活性降低,從而抑制病原菌的呼吸代謝,但其具體的作用機制尚未明確。
綜上所述,從金銀花健康植株中篩選出的曲霉屬JYY-3菌株對桃樹細菌性穿孔病有較強抑制作用,其抑菌機制主要是通過抑制病原菌胞內DNA、RNA的合成,破壞細胞壁、細胞膜的完整結構,抑制胞外多糖和纖維素酶合成,抑制菌體的呼吸代謝等途徑來實現的。因此曲霉屬JYY-3菌株有望用于桃樹細菌性穿孔病的防治,但其抑菌活性物質的確定及分離還有待進一步研究。
參考文獻:
[1]何 敬. 秦安縣桃樹細菌性穿孔病的發生及防治[J]. 甘肅農業科技,2019(7):88-89.
[2]秦 霞,楊紅芳,劉清瑞. 桃樹細菌性穿孔病的發生因素與綜合防治[J]. 種業導刊,2016(7):13-14.
[3]Wilson D. Endophyte:the evolution of a term,and clarification of its use and definition[J]. Oikos,1995,73(2):274-276.
[4]Jia M,Chen L,Xin H L,et al. A friendly relationship between endophytic fungi and medicinal plants:a systematic review[J]. Frontiers in Microbiology,2016,7:906.
[5]尹雁玲,蔡 然,張功良,等. 植物內生菌增強植物對生物脅迫抗性的研究進展[J]. 廣西植物,2023,43(2):212-220.
[6]劉 冰,李冬植,胡長志,等. 柑橘可培養內生細菌與寄主品種抗潰瘍病相關性的初步研究[J]. 江西農業大學學報,2013,35(2):319-323,418.
[7]崔麗紅,宋金秋,陳繼富,等. 根際內生菌對獼猴桃潰瘍病生防作用研究初探[J]. 上海農業學報,2017,33(6):28-32.
[8]黃海東,楊紅澎,王 玉,等. 云霧龍膽內生菌的分離鑒定及抗菌活性分析[J]. 微生物學通報,2010,37(7):1017-1021.
[9]譚才鄧,朱美娟,杜淑霞,等. 抑菌試驗中抑菌圈法的比較研究[J]. 食品工業,2016,37(11):122-125.
[10]曾范利,于 錄,葛 發,等. MABA法與二倍稀釋法測定齊墩果酸體外抗結核菌活性[J]. 動物醫學進展,2010,31(7):22-25.
[11]張 燕. 酸馬奶源乳酸乳球菌代謝物和大黃聯合作用對小鼠盲腸微生物以及營養代謝的影響[D]. 呼和浩特:內蒙古農業大學,2016:16-17.
[12]魏景超. 真菌鑒定手冊[M]. 上海:上海科學技術出版社,1979:1-10.
[13]朱艷蕾. 細菌生長曲線測定實驗方法的研究[J]. 微生物學雜志,2016,36(5):108-112.
[14]韓學易,陳 惠,吳 琦,等. 產纖維素酶枯草芽孢桿菌C-36的產酶條件研究[J]. 四川農業大學學報,2006,24(2):178-181.
[15]李佳佳,鞠玉琳,李 楊. 樺褐孔菌多糖的提取及含量測定方法的研究[J]. 湖北農業科學,2009,48(12):3133-3135.
[16]黃燕飛. 黃連水提物對痢疾桿菌的抑菌機制研究[D]. 合肥:安徽農業大學,2016:16.
[17]王海濤,王 倩,謝明杰. 大豆異黃酮對金黃色葡萄球菌的抑菌機制研究[J]. 中國農業科學,2009,42(7):2586-2591.
[18]謝 強,林玉桓,苗淑萍,等. 香芹酚對大腸桿菌和金黃色葡萄球菌細胞膜的影響[J]. 食品工業科技,2014,35(23):54-58,62.
[19]謝 晶,侯偉峰,湯 毅,等. 植酸對腐敗希瓦氏菌的抑菌機理[J]. 食品工業科技,2011,32(10):85-88.
[20]李昌勤,趙 琳,薛志平,等. 隱丹參酮抑菌作用機制研究[J]. 中國藥學雜志,2012,47(21):1706-1710.
[21]趙 蕾,張天宇. 植物病原菌產生的降解酶及其作用[J]. 微生物學通報,2002,29(1):89-93.
[22]葛紅娟,龍桂友,戴素明,等. 冰糖橙與枸櫞 C-05 對潰瘍病菌生長特性的影響[J]. 中國農業科學,2015,48(7):1383-1391.
[23]徐明生,陳錦屏,上官新晨. 魚精蛋白對黑曲霉細胞內的琥珀酸脫氫酶和蘋果酸脫氫酶的影響[J]. 食品科學,2005,26(4):48-51.
[24]曹鵬飛,劉青娥. 楊梅枯萎病拮抗內生菌的分離及其抑菌機制研究[J]. 河南農業科學,2021,50( 4):96-105.[HJ1.7mm]
[25]周 磊,云寶儀,汪業菊,等. 大黃素對金黃色葡萄球菌的抑菌作用機制[J]. 中國生物化學與分子生物學報,2011,27(12):1156-1160.
[26]李 瑾. 金銀花內生真菌的分離鑒定和抗菌性研究[D]. 鄭州:河南工業大學,2010:60-61.
[27]周 晶. 病原菌致病性胞外產物(ECP)的研究進展[J]. 畜牧與飼料科學,2009,30 (1):8-9.
[28]陳 成. 擬態弧菌感染黃顙魚的組織嗜性與動態病理損傷研究[D]. 雅安:四川農業大學,2016:5-6.
[29]婁喜艷,郭洋洋,裴冬麗. 河南商丘月季黑斑病病原菌鑒定及生物學特性[J]. 江蘇農業科學,2021,49(19):138-143.
[30]林海云,車建美,劉 波,等. 青枯雷爾氏菌致病機制及其相關基因的研究進展[J]. 福建農業學報,2011,26(5):899-906.
[31]王 芳. 苦參內生拮抗細菌篩選及其抗菌物質純化鑒定[D]. 沈陽:沈陽農業大學,2009:125-127.
[32]黃青春. 拌種靈(Amicarthiazol)對柑橘潰瘍病菌作用機制研究[D]. 南京:南京農業大學,2001:59-70.
[33]鄧 超,付海田,谷 鵬. 長裙竹蓀子實體乙醚和乙酸乙酯提取物的化學組成分析及抑菌活性研究[J]. 食品工業科技,2014,35(22):128-134.
[34]吳華彰,費鴻君,趙云利,等. 蘿卜硫素對大腸桿菌抑菌機制的研究[J]. 四川大學學報(醫學版),2012,43(3):386-390.
收稿日期:2022-10-08
基金項目:浙江省麗水市重大科技計劃(編號:2019ZDYF01)。
作者簡介:曹鵬飛(1978—),男,陜西旬邑人,副研究員,從事園藝植物病理研究工作。E-mail:297473247@qq.com。
通信作者:吳華芬,高級農藝師,從事植物資源研究推廣工作。E-mail:631154131@qq.com。

