杰氏棒桿菌L-天冬氨酸α脫羧酶半理性改造及全細胞催化合成β-丙氨酸
劉浩 馬世杰 周哲敏 崔文璟
(江南大學生物工程學院 工業生物技術教育部重點實驗室,無錫 214122)
β-丙氨酸,又稱3-氨基丙酸,是生物體內合成泛酸的重要前體物質,也是自然界中唯一存在的β型氨基酸。β-丙氨酸及其衍生物廣泛應用于制藥,如合成帕米磷酸鈉[1]、肌肽[2]等,以及食品、飼料和化工等領域[3-4],被認為是12種最具發展潛力的三碳化合物之一[5],市場需求量日益上升。通過PanD催化L-天冬氨酸制備β-丙氨酸是主要途徑之一,具有重要的工業應用價值,相較于化學合成法,生物轉化法更加綠色、可持續。
L-天冬氨酸-α-脫羧酶(L-aspartate-αdecarboxylase, EC 4.1.1.11, PanD, ADC)能夠專一地催化L-天冬氨酸脫去α羧基生成β-丙氨酸。ADC酶最早是由Williamson等[6]從Escherichia coli中分離得到。隨后Chopra等[7]異源表達了結核分歧桿菌來源的PanD,并首次進行了結晶。PanD主要存在于細菌、古細菌、放線菌等低等生物中,目前對PanD的報道主要集中在大腸桿菌[8]、谷氨酸棒狀桿菌[9](Corynebacterium glutamicum)、枯草芽孢桿菌[10](Bacillus subtilis)、結核分枝桿菌[11](Mycobacterium tuberculosis)、幽門螺旋桿菌[12](Helicobacter pylori)等。PanD可分為磷酸吡哆醛(PLP)依賴型和丙酮酰基團依賴型兩類,磷酸吡哆醛依賴型PanD催化過程中依賴于輔因子PLP,主要來源于Tribolium castaneum、果蠅(Drosophila melanogaster)等真核生物,蛋白結構和催化機理尚無明確報道[13],而丙酮酰基團依賴型PanD的催化能力依賴自加工形成的丙酮酰基團,無需外源輔助因子,且催化特異性高,相較于磷酸吡哆醛依賴型更具工業應用前景。丙酮酰基團依賴型PanD 合成時,首先轉錄翻譯成無活性的原酶(約15 kD),隨后在Gly24-Ser25處發生斷裂,自剪切形成1個C端含有羥基的β-亞基(約3 kD)和1個N端含有丙酮酰基的α-亞基(約12 kD)[14-16]。
目前關于PanD的克隆表達、分子改造及應用等方面的研究逐漸升溫,張瀟瀟[17]成功在E.coli BL21(DE3)菌株中異源表達了頓齒棒桿菌(Corynebacterium crenatum)來源的PanD 基因,催化生產β-丙氨酸,最終濃度達到76.47 mg/L。范雪萍等[18]將特基拉芽孢桿菌(B.tequilensis)來源的PanD 在E.coli BL21(DE3)中重組表達,以200 g/L L-天冬氨酸作為底物,β-丙氨酸的最終產量達66.4 g/L。Li等[19]構建了過量表達谷氨酸棒桿菌ADC的大腸桿菌重組菌,全細胞催化生產β-丙氨酸,產量達到24.8 g/L。Zhang等[20]基于酶結構與功能關系,將B.subtilis來源PanD的56號位點突變為絲氨酸,最終比酶活達到7.8 U/mg。Pei等[21]通過易錯 PCR對B.subtilis來源PanD進行改造,成功篩選到V68I以及I88M兩個突變體,其酶活相比野生型提高了18%-22%;陳虹[22]對T.castaneum來源的PanD進行建庫篩選,篩選到兩個酶活明顯提高的突變體,最終267 g/L的底物L-天冬氨酸可生成170.53 g/L的β-丙氨酸,轉化率達到95.45%。現有對L-天冬氨酸α脫羧酶的改造普遍存在酶活力低[23-28]的問題,這是限制其工業應用的關鍵性因素。因此,尋找初始活性較高的L-天冬氨酸α脫羧酶,并定向進化改造PanD基因進一步提高催化效率,對酶法合成β-丙氨酸具有重要的研究意義和工業價值。
本研究以杰氏棒桿菌(Corynebacterium jeikeium)來源的PanD基因為研究對象,通過半理性設計手段對其定向進化,獲得了酶學性質顯著提升的突變體酶,并利用全細胞催化技術實現了β-丙氨酸的高效合成,對酶法生產β-丙氨酸以及微生物發酵法合成β-丙氨酸下游產物(泛酸、肌肽等)具有十分重要的意義。
1 材料與方法
1.1 材料
大腸桿菌表達宿主菌E.coli BL21(DE3)、克隆宿主菌E.coli JM109、重組質粒pET-28a(+)為本實驗室保存。種子培養基為LB培養基。Corynebacterium jeikeium來源的PanD基因由安升達公司合成。L-天冬氨酸鈉、IPTG、卡那霉素購于上海生工生物工程有限公司。β-丙氨酸(購于Sigma公司)。酵母提取物、蛋白胨購于Oxford公司。異硫氰酸苯酯(phenyl isothiocyanate, PITC)購于阿拉丁公司。
蛋白純化儀和純化柱,GE Healthcare UK Ltd;Bio-Rad PCR儀器;日立高效液相色譜儀。
1.2 方法
1.2.1 同源建模和分子對接 將杰氏棒桿菌來源L-天冬氨酸α脫羧酶的氨基酸序列(GenBank登錄號:CR931997.1)上傳至AlaphFold2在線服務器進行結構預測。L-天冬氨酸α脫羧酶分子與配體L-天冬氨酸分子對接通過Maestro半柔性對接實現。
1.2.2 計算機模擬突變及虛擬突變位點的選擇 通過Rosetta軟件進行虛擬突變,對各位點解折疊自由能變化(ΔΔG)結果進行統計,篩選突變后折疊自由能(ΔG)下降顯著的位點。在Uniprot數據庫中通過BLAST尋找篩選PanD的高同源性蛋白,ClustalX2軟件對這些蛋白進行多序列同源比對分析[21],剔除高保守位點。
1.2.3 突變體文庫構建方法 以野生型CJPanD基因的重組質粒pET28a(+)-PanD為模板,設計NNK簡并密碼子引物,通過高保真聚合酶Prime STAR Max DNA Polymerase進行全質粒PCR。采用Dpn I酶于37℃對PCR產物進行酶切以消化野生型模板,隨后轉化克隆宿主菌E.coli JM109,涂布于平板上,待平板上長出菌落后,悉數洗下平板上的菌落,提取混合質粒,即為突變體文庫,再將混合質粒導入表達宿主菌E.coli BL21(DE3),涂布于平板上。挑取平板上的單菌落,接種于96孔板中,培養一段時間后,轉接至另一96孔板中,約2-3 h后,加入終濃度為0.3 mmol/L的IPTG誘導,繼續培養12 h取出,作為突變體庫備用。
1.2.4 突變體的初篩和復篩
1.2.4.1 突變體的初篩 將培養12 h的96孔板取出,離心去上清后,加入500 μL,濃度為100 mmol/L的L-天冬氨酸鈉溶液,放入37℃搖床反應30 min后取出,再次離心,上清即為全細胞反應液。突變體的初篩采用薄層層析,薄層層析是在薄板上進行的一種層析分離方法,其原理是溶液中各組分在固定相和流動相中的溶解度不同,在薄板上的遷移也不同,從而達到分離的目的,篩選突變體時用來定性非常方便。在距離薄板下端邊緣1.5 cm處劃線,樣品間隔1 cm,點樣1 μL,先點上底物L-天冬氨酸和產物β丙氨酸,再依次點上全細胞反應液,置于層析杠中,加入展開劑,展開劑沒過薄板下端邊緣1 cm左右,層析約3 h,停止層析。取出薄板,用吹風機吹干表面的展開劑后均勻地噴上茚三酮-乙醇溶液,再使用吹風機吹至出現藍紫色斑點,即可進行觀察定性。
1.2.4.2 突變體的復篩 對初篩有效果的突變體進行純化,測定純酶酶活。
1.2.5 酶的表達與純化 將重組大腸桿菌pET28a-CJPanD-BL21、pET28a-CJPanD-L39A-BL21的單克隆接種于5 mL LB培養基(含有50 μg/mL卡那霉素)中,置于37℃、200 r/min的搖床中,過夜振蕩培養,作為種子液。按1%(體積分數)接種量接種于含有50 μg/mL卡那霉素的100 mL LB培養基中,37℃、200 r/min,振蕩培養至OD600為0.6-0.8。加入終濃度為0.3 mmol/L的IPTG,在25℃條件下誘導表達16-18 h左右。利用AKTA蛋白純化儀和His Trap HP純化柱對目的蛋白進行分離純化。收集細胞培養液,12 000 r/min離心5 min,棄去上清液,收集沉淀。用Binding緩沖液(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、20 mmol/L咪唑)重新懸浮細胞,置于冰上進行超聲波破碎,待溶液澄清之后,于4℃、12 000 r/min離心30 min,收集細胞破碎上清液。上清液經0.45 μm濾膜過濾后作為粗酶液上樣,用Binding緩沖液洗去非結合蛋白,用15個柱體積的Elution緩沖液(20 mmol/L Na2HPO4、20 mmol/L NaH2PO4、500 mmol/L NaCl、500 mmol/L咪唑)進行線性洗脫,收集洗脫峰。將收集到的蛋白放入50 mmol/L磷酸鹽(pH 7.0)緩沖液中,4℃過夜透析除去咪唑。利用濃度為15%的SDS-PAGE對分離純化后的蛋白進行電泳檢測,利用Brandford法測定目的蛋白濃度。
1.2.6 L-天冬氨酸和β-丙氨酸檢測 L-天冬氨酸和β-丙氨酸采用異硫氰酸苯酯(PITC)進行衍生。L-天冬氨酸和β-丙氨酸經衍后采用HPLC測定,色譜柱為DiKMA Diamonsil C18(2)(5 μm × 4.6 mm ×250 mm);流動相A溶液為80%(體積分數)乙腈水溶液,流動相B為97∶3(體積分數,pH 7.0)的0.1 mol/L醋酸鈉-乙腈溶液;梯度洗脫:0-30 min,B溶液由95%下降至70%;35-40 min,B溶液由70%上升至95%;40-42 min,B溶液梯度保持不變,檢測波長為254 nm,柱溫為40℃。
1.2.7 酶學性質測定
1.2.7.1 最適溫度測定 將0.1 mg重組酶分別置于30、37、40、45、55、60、65、70、80℃金屬浴中預熱5 min,然后與同樣預熱過5 min的pH 7.0的200 mmol/L底物L-天冬氨酸鈉反應10 min,測定酶活后分析酶的最適反應溫度。
1.2.7.2 溫度穩定性測定 將0.1 mg重組酶液置于30、37、40、50、55、60、70、80℃孵育30 min后,置于冰上冷卻5 min。加入終濃度 200 mmol /L L-天冬氨酸鈉,于37℃,pH 7.0條件下反應10 min 測定殘余酶活。將初始酶活定義為100%,分析溫度對酶穩定性的影響。
1.2.7.3 最適pH測定 將0.1 mg重組酶置于37℃金屬浴預熱5 min,預熱后分別加至pH 3.0、4.0、4.5、5.0、5.5、6.0、7.0、7.5、8.0、9.0的緩沖液中,緩沖液中含有200 mmol/L底物L-天冬氨酸鈉,反應10 min,測定酶活性,分析酶的最適反應pH。
1.2.7.4 pH穩定性測定 將0.1 mg重組酶液置于pH 3.0、4.0、5.0、6.0、7.0、8.0、9.0的緩沖液中,孵育60 min后,加入終濃度 200 mmol /L L-天冬氨酸鈉,于37℃,pH 7.0條件下反應10 min測定殘余酶活。將初始酶活定義為100%,分析pH對酶穩定性的影響。
1.2.7.5 動力學常數測定 在終濃度100 μg/mL純酶液中,分別加入終濃度(1、2、5、10、20、50、80、100、200、400 mmol/L)L-天冬氨酸鈉,于37℃,pH 7.0條件下,反應5 min,100℃、15 min終止反應,檢測β-丙氨酸產量,測定初始反應速率。采用GraphPad Prism9軟件擬合曲線,測定動力學常數Km,Kcat。將在37℃,pH 7.0的條件下,每分鐘轉化L-天冬氨酸鈉生成1 μmol β-丙氨酸所需酶量定義為一個酶活力單位U。
1.2.8 突變體結構分析 通過Pymol軟件分析正向突變酶的空間結構變化,推測分析PanD酶學性質的變化與蛋白分子結構改變的聯系。
1.2.9 全細胞催化合成β-丙氨酸的體系優化 重組菌細胞經培養誘導后,離心收集,濃縮到OD600=40。在37℃,5 mL反應液(pH 7.0)中,加入L-天冬氨酸鈉固體粉末至終濃度1.5 mol/L,持續振蕩。每隔一段時間取樣測定L-天冬氨酸剩余量和β-丙氨酸的生成量,并由此計算轉化率和產量。
2 結果
2.1 杰氏棒桿菌L-天冬氨酸α脫羧酶在大腸桿菌中的表達與純化
將合成的目的基因連接到pET28a(+)T7啟動子下游后,獲得重組質粒pET28a(+)-CJPanD,將上述重組質粒轉化到E.coli BL21(DE3)感受態細胞中,獲得重組菌E.coli BL21(DE3)/pET28a(+)-CJPanD。將構建好的質粒導入表達宿主E.coli BL21(DE3),重組菌在大腸桿菌中表達純化結果見圖1,CjPanD重組表達后自剪切形成1個C端含有羥基的β-亞基(約3 kD)和1個N端含有丙酮酰基的α-亞基(約12 kD)。
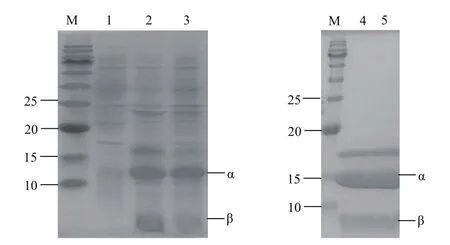
圖1 重組酶CJpanD及突變體蛋白電泳Fig.1 SDS-PAGE analysis of recombinant enzyme CJpanD and mutants
2.2 計算機模擬突變
蛋白質的解折疊自由能ΔG是蛋白質穩定性的重要參數。若突變后的ΔG較野生型下降,則表明該突變有利于提高蛋白質的穩定性;若突變后ΔG增加,則說明該突變不利于蛋白質的穩定。排除高保守位點H11后,確定C26、L39、I49、N72、L55和T56共6個突變熱點,相關位點的折疊自由能變化如表1。
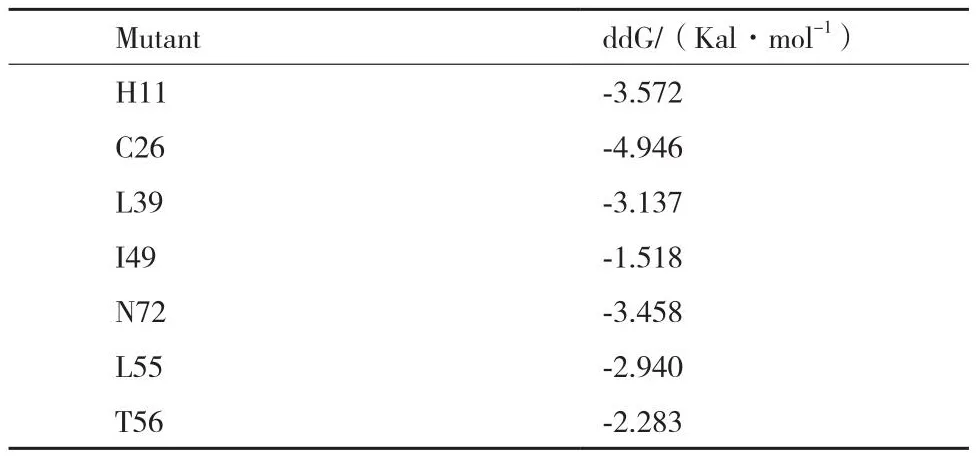
表1 擬突變氨基酸的選取Table 1 Selection of pseudo-mutant amino acids
2.3 突變體文庫的初篩和復篩
根據計算機模擬突變結果,設計飽和突變引物,簡并密碼子為NNK,構建含有上述突變位點的質粒,在96孔板中的反應后點于薄板上,部分薄層層析初篩結果如圖2所示,對初篩的正向突變體進行測序,篩選到C26L、C26F、L39A、I49L、L55F、T56W、N72。
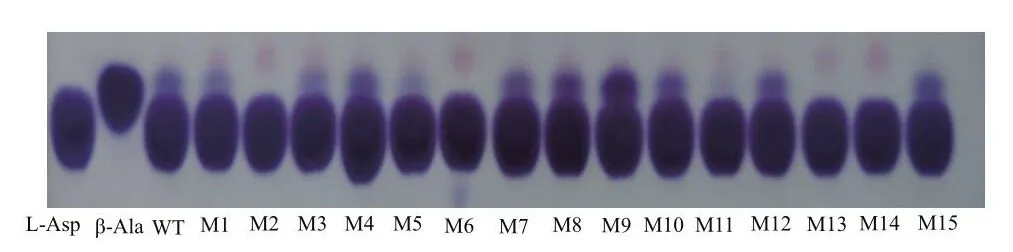
圖2 薄層層析結果Fig.2 Results by thin layer chromatography
對初篩有效果的正向突變體進行復篩驗證,在37℃,底物L-天冬氨酸濃度200 mmol/L的條件下測定重組酶的比酶活(圖3),經過實驗驗證,L39A突變體的比酶活是野生型的1.4倍。
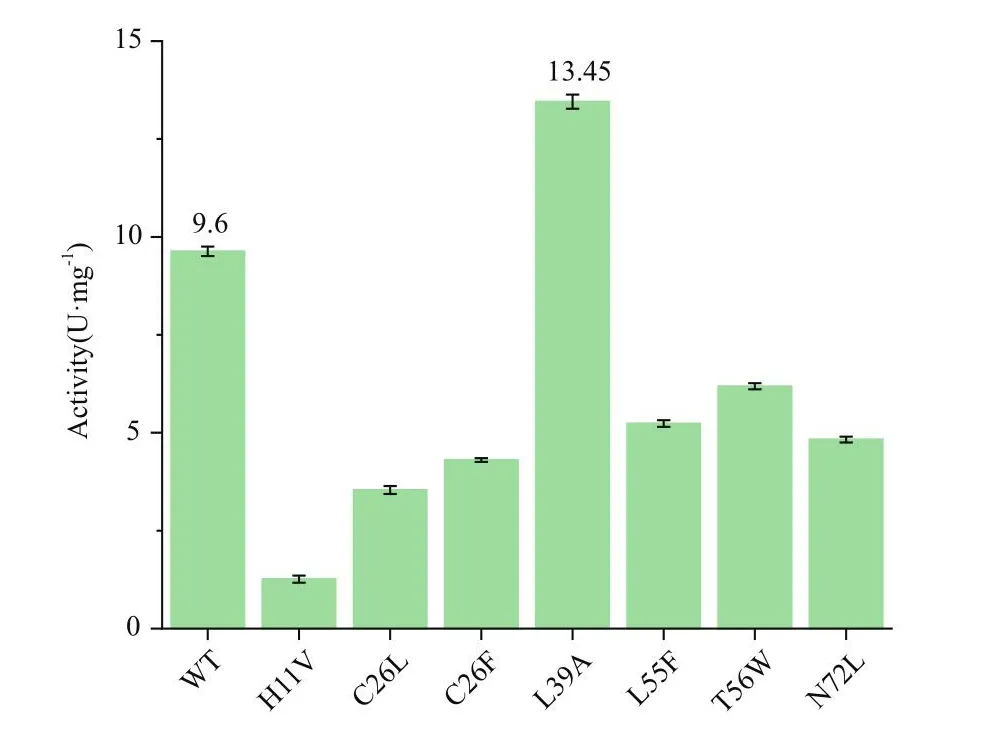
圖3 不同突變體比酶活Fig.3 Specific enzyme activity in different mutants
2.4 突變體的酶學性質表征
2.4.1 最適溫度及溫度穩定性、最適pH及pH穩定性的表征 為了考查野生型酶和L39A突變體的最適溫度和溫度穩定性,將底物L-天冬氨酸鈉和重組酶分別在對應溫度下孵育5 min后再混合到一起反應,以未經處理的酶作為對照,測定酶活。數據經處理后,由圖4-A可知,野生型和突變體的最適溫度為55℃,70℃下突變體L39A的活性仍然高于最適溫度下野生型活性。由圖4-B可知,在50℃孵育30 min后,野生型的活性保持在90%,而在70℃孵育情況下,野生型僅剩余20%的酶活;而突變體L39A穩定性有所提高,70℃處理后仍剩余50%的酶活。
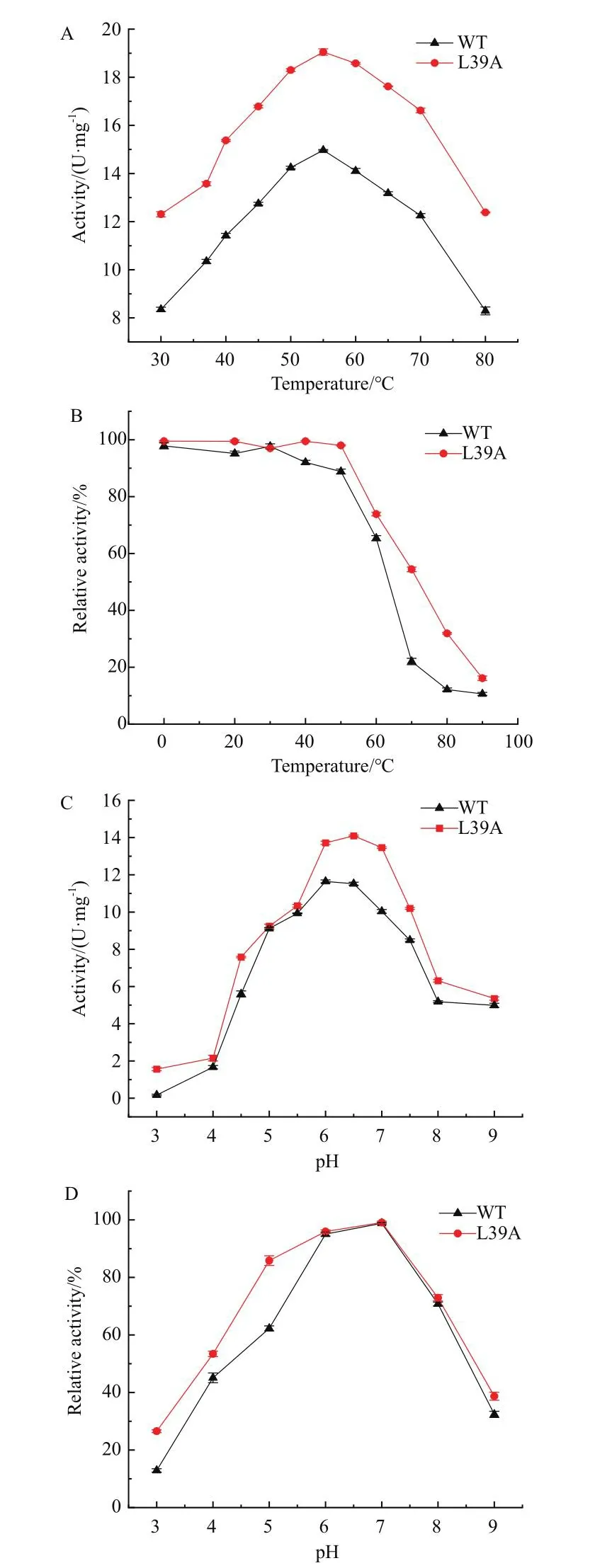
圖4 最適溫度及溫度穩定性、最適pH及pH穩定性Fig.4 Optimal temperature and temperature stability, optimal pH and pH stability of recombinant enzymes
為了考查L39A突變體的最適pH以及pH穩定性,將不同pH的含底物L-天冬氨酸鈉的緩沖液與重組酶在37℃孵育5 min后混合到一起反應,測定酶活。數據經處理后,由圖4-C可知,野生型與突變體L39A的最適pH為6.0-6.5,最適pH下,突變體酶活較野生型提升1.3倍。由圖4-D可知,在pH 6.0-7.0之間酶活保持穩定,當pH低于5.5或高于7.5時,殘余酶活低于60%。
2.4.2 突變體動力學常數的測定 測定突變體L39A的動力學參數(圖5)并與野生型進行比較,具體結果如表2所示,野生型的Km為(3.63±0.12)mmol/L,Kcat為(102.10±0.37)s-1。突變體L39A的Km值較WT低,表明其底物親和力優于野生型;Kcat/Km較野生型更高,催化效率有顯著提升,是野生型的1.4倍。

表2 動力學常數測定Table 2 Kinetic parameters of WT and L39A
2.5 突變體的結構模擬與分析
對突變位點L39A進行結構分析發現(圖6),L39A與底物之間并沒有直接的相互作用,但是39位的丙氨酸與42位的谷氨酸的羥基氧原子和氮原子之間形成兩個氫鍵,其羥基氧和羰基氧與7位賴氨酸形成兩個氫鍵,穩定了42位谷氨酸空間取向;42位谷氨酸與59位丙氨酸之間形成氫鍵,57位蘇氨酸、58位酪氨酸位參與底物的結合,39位取代為側鏈基團更小的丙氨酸,親水性增強,增加了關鍵催化氨基酸58位酪氨酸與其他氨基酸的相互作用,使活性中心周圍的區域穩定性提高,從而提高了催化活性。此外39位亮氨酸突變為丙氨酸后,結合自由能降低,PanD酶分子與底物結合更加容易。
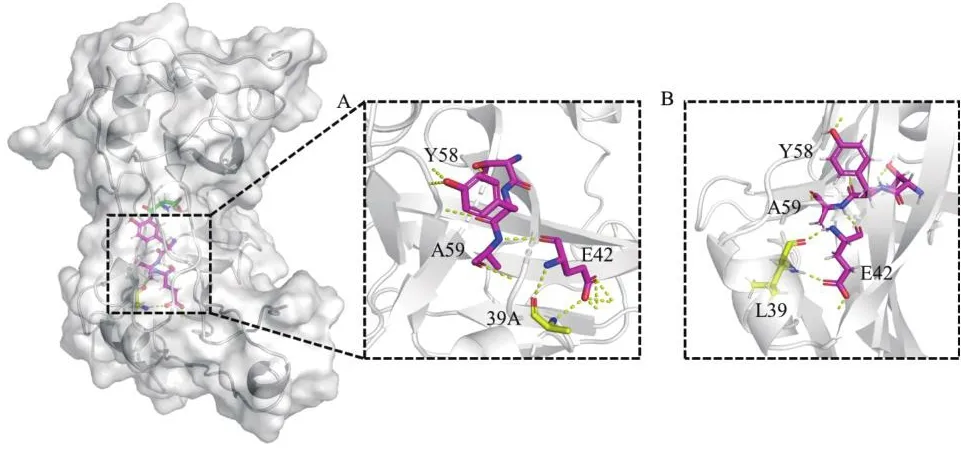
圖6 突變體L39A和野生型結構信息Fig.6 Structural information of L39A and WT
2.6 全細胞催化合成β-丙氨酸
在含有重組大腸桿菌細胞OD600=40的反應液中,一次性添加L-天冬氨酸鈉進行全細胞催化反應,定時取樣監測底物與產物的含量。由圖7可知,轉化初期速度較慢,轉化中期速度加快,可能是細胞發生裂解,胞內的酶釋放出來,轉化后期轉化效率降低,可能是酶出現了不可逆的失活。當一次性添加1 mol/L的L-天冬氨酸鈉進行全細胞催化反應時,如圖7-A,B所示,L39A在4 h基本上能夠轉化70%的L-天冬氨酸,而野生型4 h僅能轉化約50%,L39A在10 h能夠轉化90% L-天冬氨酸,在12 h能夠完全轉化1 mol/L的L-天冬氨酸,野生型在15 h能完全轉化1 mol/L的L-天冬氨酸,兩者在轉化性能方面的差距較明顯。
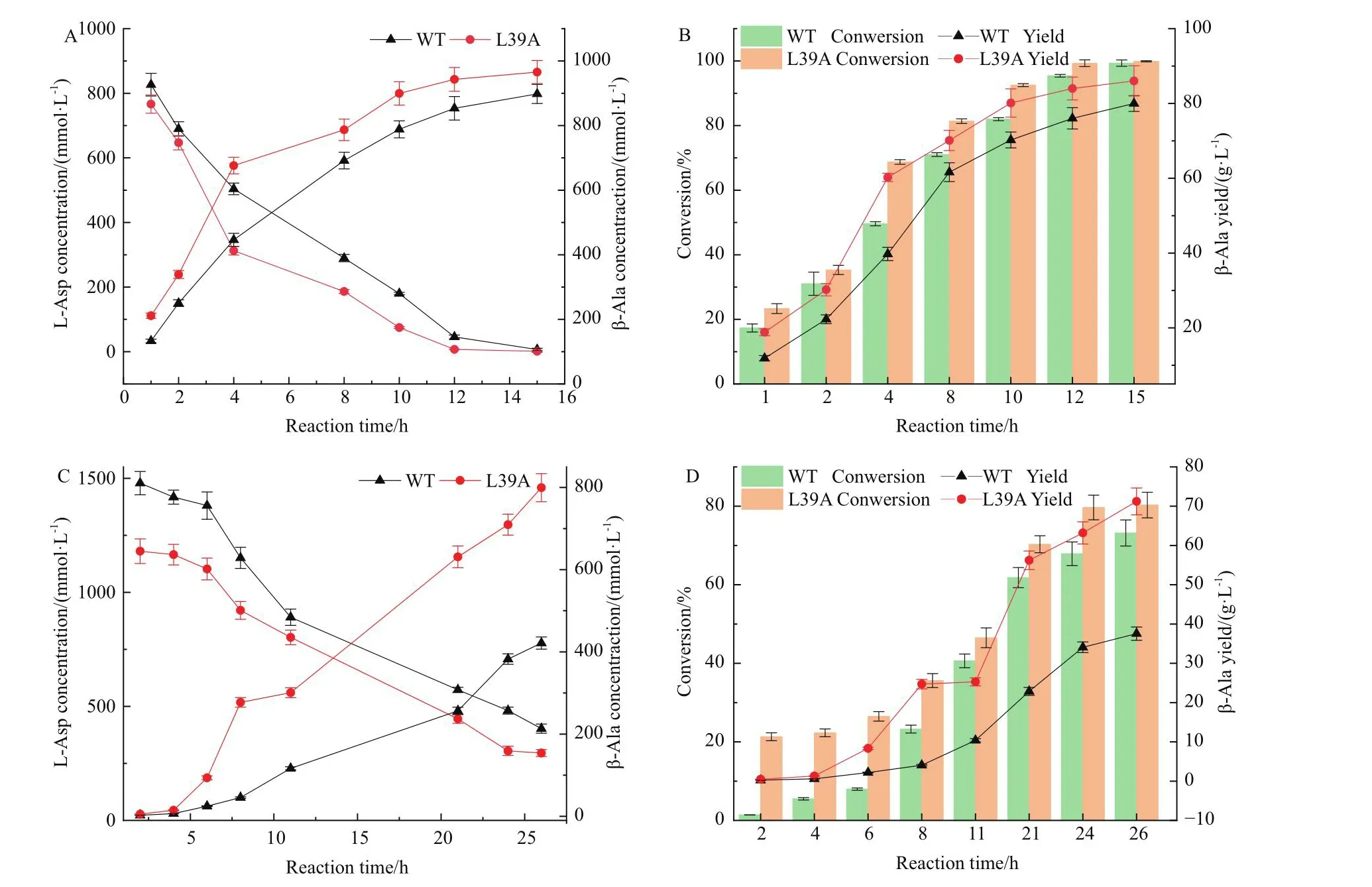
圖7 全細胞催化合成β-丙氨酸Fig.7 Whole cell catalytic synthesis of β-alanine
而當一次性添加1.5 mol /L的L-天冬氨酸鈉作為底物進行全細胞催化反應時,L39A在26 h摩爾轉化率達52%,而野生型摩爾轉化率僅為28%,L39A在26 h的最終產量為71.22 g/L,野生型為37.55 g/L(圖7-C, D,表3)。此種體系中酶的轉化效率變慢,可能是由于該類酶普遍存在不同程度的底物抑制。但這種體系下,突變體L39A在全細胞轉化方面顯現出優于野生型的催化和轉化性能。

表3 一批次26 h轉化率與產量Table 3 Conversion and yield at 26 h per batch
3 討論
目前,生物發酵法生產β-丙氨酸是主要的研究熱點,該方法反應條件溫和、綠色安全;該法主要有兩類:一類是通過微生物代謝生產β-丙氨酸,但是經過微生物代謝后,副產物較多,難以分離純化且微生物代謝轉化效率低[29];另一類是通過酶專一性催化生產β-丙氨酸,該方法僅需一步轉化即可得到產物,易于產物的分離純化,但存在酶活低、機理性失活、底物抑制等問題。針對酶生物轉化存在的問題,本文通過挖掘新酶尋找初始活性高的酶;通過定向進化提高酶的催化效率及穩定性。本文利用已報道的谷氨酸棒狀桿菌[8](Corynebacterium glutamicum)、枯草芽孢桿菌[9](Bacillus subtilis)來源的PanD基因為探針,在Uniprot數據庫中進行BLAST,分析活性中心位點周圍氨基酸序列的保守性,選擇自裂解后形成丙酮酰結構的基因序列,以起始活性為標準,篩選到來源于杰氏棒桿菌(Corynebacterium jeikeium)的PanD。
酶的實驗室定向進化是在實驗室模擬自然環境加速酶進化的技術[30],主要有位點飽和突變[31]和易錯PCR[32],這兩種方法能夠產生非常大的突變體文庫,但是需要依賴于分辨率較高的高通量篩選手段[33],若沒有合適的高通量篩選手段,定向進化過程將非常棘手。半理性設計借助蛋白質的保守性位點以及晶體結構,選取若干氨基酸作為潛在位點,構建“小而精”的突變體文庫[34]。確定了定向進化模板后,由于杰氏棒桿菌來源PanD尚未有明確的結構作為參考,AlphaFold2在蛋白質預測方面表現優秀[35],具有驚人的準確度,本文通過AlphaFold2預測杰氏棒桿菌來源PanD結構,并通過Rosetta進行虛擬篩選,根據蛋白質的解折疊自由能并結合保守性分析,進一步縮小了突變位點的范圍,提高了定向進化的效率。薄層層析能夠比較直觀地對氨基酸濃度進行定性,濃度越高,斑點越大。對突變體文庫進行初篩和復篩后,篩選到突變體L39A,突變體催化效率是野生型的1.4倍。研究中還發現,突變體酶活提高的同時,穩定性也有所提高,在50℃孵育30 min后,野生型的活性保持在90%,而在70℃孵育情況下,野生型僅剩余20%的酶活;而突變體L39A 70℃處理后仍剩余50%的酶活,更加有利于工業生產。為了進一步了解突變體在全細胞催化方面的優勢,本文在含有重組大腸桿菌細胞OD600=40的反應液中,一次性添加1 mol /L的L-天冬氨酸鈉鹽進行全細胞催化反應驗證,L39A在4 h基本上能夠轉化70%的L-天冬氨酸,而野生型4 h僅能轉化約50%,L39A在10 h能夠轉化90% L-天冬氨酸,在12 h能夠完全轉化1 mol/L的L-天冬氨酸,具有工業應用的潛力。結構分析表明,39位的丙氨酸與42位的谷氨酸的氧原子和氮原子之間形成兩個氫鍵,其羥基氧和羰基氧與7位賴氨酸形成氫鍵,穩定了42位谷氨酸空間取向,42位谷氨酸與59位丙氨酸之間形成氫鍵,57位蘇氨酸、58位酪氨酸參與底物的結合,39位取代為側鏈基團更小的丙氨酸,親水性增強,增加了關鍵催化氨基酸58位酪氨酸與其他氨基酸的相互作用,使活性中心周圍的區域穩定性提高,從而提高了催化活性。
半理性設計結合Rosetta虛擬篩選策略對比其他酶活性改造策略[36],能夠減少實驗復雜程度、時間。對于沒有確切晶體結構的分子,也可以通過AlphaFold2預測手段進行結構預測,以預測后的模型為參考進行篩選也有一定的意義,但是若想對酶進行更為深入的研究,精確的三維結構是必須的,還需要對野生型以及突變體進行晶體結構解析。
4 結論
本研究通過對杰氏棒桿菌來源L-天冬氨酸α脫羧酶進行定向進化,成功篩選到突變體L39A。L39A熱穩定性較野生型有所提升,最適溫度、pH與野生型一致。其與底物的親和力提高,催化效率是野生型的1.4倍。經過全細胞催化驗證,L39A在4 h能夠轉化70%的L-天冬氨酸,12 h能夠完全轉化1 mol/L的L-天冬氨酸,且催化效率的提高在高濃度底物(1.5 mol/L L-天冬氨酸)時表現得更為明顯。后續可以以L39A為模板,進一步迭代突變,提高其在工業應用中的潛力。

