羅氏沼蝦蛻皮周期中內分泌調控和蛻皮信號通路相關基因的表達分析
丁麗 都婷婷 唐瓊英 高權新 易少奎 楊國梁,2
(1.湖州師范學院 浙江省水生生物資源養護與開發技術研究重點實驗室 中國水產科學研究院水生動物繁育與營養重點實驗室,湖州 313000;2.江蘇數豐水產種業有限公司,揚州 225654)
蛻皮是甲殼類動物整個生命周期中的一個重要生理現象,對其生長、發育、繁殖和肢體再生等過程起著重要作用[1]。蛻皮周期貫穿了甲殼動物整個生命周期,主要分為蛻皮間期(C)、蛻皮前期(D)、蛻皮期(E)和蛻皮后期(AB)[2]。蛻皮激素(ecdysteroids hormone, EH)作為蛻皮過程的主要調節因子,在蛻皮、卵巢生長和甲殼動物發育方面起著關鍵作用[3-4]。目前節肢動物的蛻皮激素信號通路的調控路徑已經較為清晰[5-6](圖1),蛻皮激素信號入核前的上游通路已經基本明確,認為蛻皮抑制激素(molt-inhibiting hormone, MIH)與G蛋白偶聯受體結合,經過一系列的反應激活了蛋白激酶(protein kinase A, PKA),而具有活性的蛋白激酶入核后會調控甲殼動物蛻皮激素的產生[7]。蛻皮激素下游通路主要是蛻皮激素通過作用靶標-蛻皮激素受體(ecdysone receptor, EcR)和維甲酸類X受體(retinoid receptor, RXR)形成的EcR/RXR聚合體復合物[8-9],再利用應答基因調控靶基因的轉錄,其中應答基因包括ECR、RXR、E75、E74、E98、Br-C(broad-complex)、HR3、FTZ-F1(fushi tarazu transcription factor-1)等[10],最后通過幾丁質合成、表皮幾丁質降解、表皮蛋白質再生、激素分泌等過程完成蛻皮[11]。蛻皮是一個復雜的過程,不僅是由蛻皮激素單獨作用,也有其他激素參與蛻皮過程,在煙草天蛾中發現了能夠誘導昆蟲蛻皮的第二個神經肽激素-蛻皮啟動激素(ETH),而ETH是由氣門上腺細胞(Inka細胞)所分泌的。蛻皮激素會作用于Inka分泌ETH,最終ETH會與其受體(ETHR)結合產生調節肌肉的神經肽,從而控制身體完成蛻皮[12]。
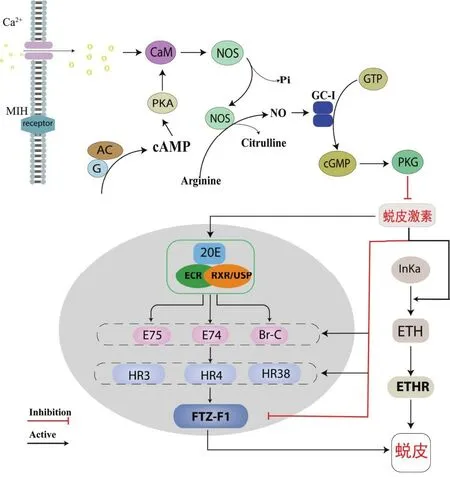
圖1 節肢動物蛻皮調控過程示意圖Fig.1 Schematic diagram of the regulation process of molting in arthropods
在蛻皮激素信號通路中,FTZ-F1作為晚期應答基因調控靶基因進行轉錄,從而調控蛻皮、變態等生理過程[13],信號通路中早期應答基因對FTZ-F1基因的調控主要通過HR3和E75介導的聯合作用,FTZ-F1作為一種能力因子,也能通過促進保幼激素調節E75A基因的表達[14]。已有研究表明當FTZ-F1缺失的果蠅突變體,在向蛹轉變的過程中會出現不能正常蛻皮的現象,說明FTZ-F1在果蠅蛻皮過程發揮重要的作用[15]。FTZ-F1基因在昆蟲中研究較為深入,但在甲殼動物中卻少有報道[16-17]。ETH信號通路是通過蛻皮啟動激素受體(ecdysis triggering hormones receptor, ETHR)介導的,有研究表明蛻皮激素能刺激Inka細胞產生ETH和蛻皮前啟動激素(pre-ecdysis triggering hormone, PETH),也可通過磷酸肌循聚集鈣離子誘導ETHR從而調控下游基因參與蛻皮[18]。蛻皮啟動激素受體有兩種亞型,分別是ETHR-A和ETHR-B,這兩種基因型在功能進化上承擔著不同的作用,ETHR-A通過激活蛻皮激素、激肽、甲殼類心臟活性肽和鞣化激素可誘導果蠅所有發育階段的蛻皮行為,而ETHR-B主要在蛹和成蟲蛻皮時期發揮重要作用[19]。在昆蟲類中,針對ETHR基因進行廣泛研究并對其分型也有所研究,而在甲殼動物中僅發現了一種ETHR類型[20]。
羅氏沼蝦原產于東南亞地區,自上世紀70年代引入我國,因其生長快、抗病性強、經濟價值高等優點,在我國的廣東、江蘇和浙江地區廣泛養殖,目前已成為我國重要的淡水養殖蝦類之一[21]。羅氏沼蝦的生長、發育、繁殖及斷肢再生等生理過程都與蛻皮有關。在蛻皮過程中機體抵抗力會變弱,易感染病原導致死亡,會嚴重影響經濟效益。目前蛻皮調控機制在昆蟲中進行了廣泛研究,而關于甲殼動物中蛻皮調控機制還未完全明晰[22],鑒于此,探究羅氏沼蝦蛻皮調控機制對于羅氏沼蝦高密度養殖具有重大意義。本研究以羅氏沼蝦為對象,檢測了谷氨酰胺合成酶(glutamine synthetase, GS)、β-N乙酰氨基葡萄糖苷酶(N-acetyl-β-D glucosaminidase,NAGase)、幾丁質酶活力(chitinase)和蛻皮激素含量,分析了蛻皮周期內Mr-ETHR、Mr-FTZ-F1以及蛻皮相關基因Mr-RXR、Mr-ECR和Mr-MIH的表達量變化,從內分泌調控與基因調控兩個層面探究羅氏沼蝦蛻皮的調節機制,為甲殼動物蛻皮調控機制的研究提供理論基礎。
1 材料與方法
1.1 材料
實驗材料來源于江蘇省高郵市數豐水產有限公司養殖的同一家系的羅氏沼蝦,隨機選取健康且規格一致的羅氏沼蝦300尾,體重為(7-8)g并隨機分成3組,每組100尾蝦養殖于17 m2(6.87 m×2.55 m)的水泥池中,保持養殖水體pH 7-8.5,溶氧3-5 mg/L,水溫25℃,養殖用水來源于育種中心北部的高郵湖水并做過濾處理,日投喂商品飼料2次(8:00和17:00)各一次,每隔3 d進行吸污換水,每次換1/3水,24 h增氧。根據形態特征與顯微結構觀察結合[23]的方法,選取蛻皮后期(AB期)、蛻皮間期(C期)、蛻皮前期(D期)和蛻皮期(E期)個體各6只,取血淋巴和肝胰腺組織,液氮速凍-80℃保存,用于酶活檢測與蛻皮激素的測定以及蛻皮相關基因表達分析。
1.2 方法
1.2.1 羅氏沼蝦蛻皮相關酶的活力測定 測定了蛻皮相關的幾丁質酶、谷氨酰胺合成酶和β-N乙酰氨基葡萄糖苷酶的活性,取羅氏沼蝦4個蛻皮時期的血淋巴和肝胰腺組織,肝胰腺組織按照組織質量(g)與PBS體積(mL)約為1∶9的比例進行冰水浴勻漿,取上清;血淋巴以6 000 r/min離心15 min,取上清。每組3個重復。由于幾丁質酶主要存在于甲殼動物的外表皮中,少量存在于肝胰腺中,因此只測肝胰腺中的幾丁質酶含量。使用幾丁質酶檢測試劑盒、谷氨酰胺合成酶檢測試劑盒和β-N乙酰氨基葡萄糖苷酶檢測試劑盒(南京建成生物工程研究所,南京)測定酶活性,參照試劑盒說明書在酶標儀(Multiskan FC)中進行檢測。
1.2.2 羅氏沼蝦蛻皮激素含量測定 取不同蛻皮周期的組織(血淋巴和肝胰腺),每個蛻皮周期采取3尾,肝胰腺組織與血淋巴組織進行冰水浴勻漿,取上清。使用對蝦蛻皮激素酶聯免疫分析試劑盒(上海源桔生物科技中心,上海)測定EH含量參照試劑盒說明書在酶標儀中進行檢測。
1.2.3 羅氏沼蝦ETHR與FTZ-F1基因CDS序列的克隆 通過NCBI數據庫檢索的日本沼蝦ETHR基因序列(NN13868.1)和FTZ-F1基因序列(UQC00153.1)以及羅氏沼蝦轉錄本序列為模板,利用Primer Premier 5.0設計特異性引物,引物序列信息見表1。采用Trizol法提取羅氏沼蝦肝胰腺組織總RNA,使用PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa,大連)試劑盒合成cDNA,以其為模板進行PCR擴增,擴增產物送至天一輝遠(武漢)股份有限公司進行測序驗證。通過一代測序獲得的序列進行手動拼接,最終獲得羅氏沼蝦ETHR、FTZ-F1基因的CDS全長。
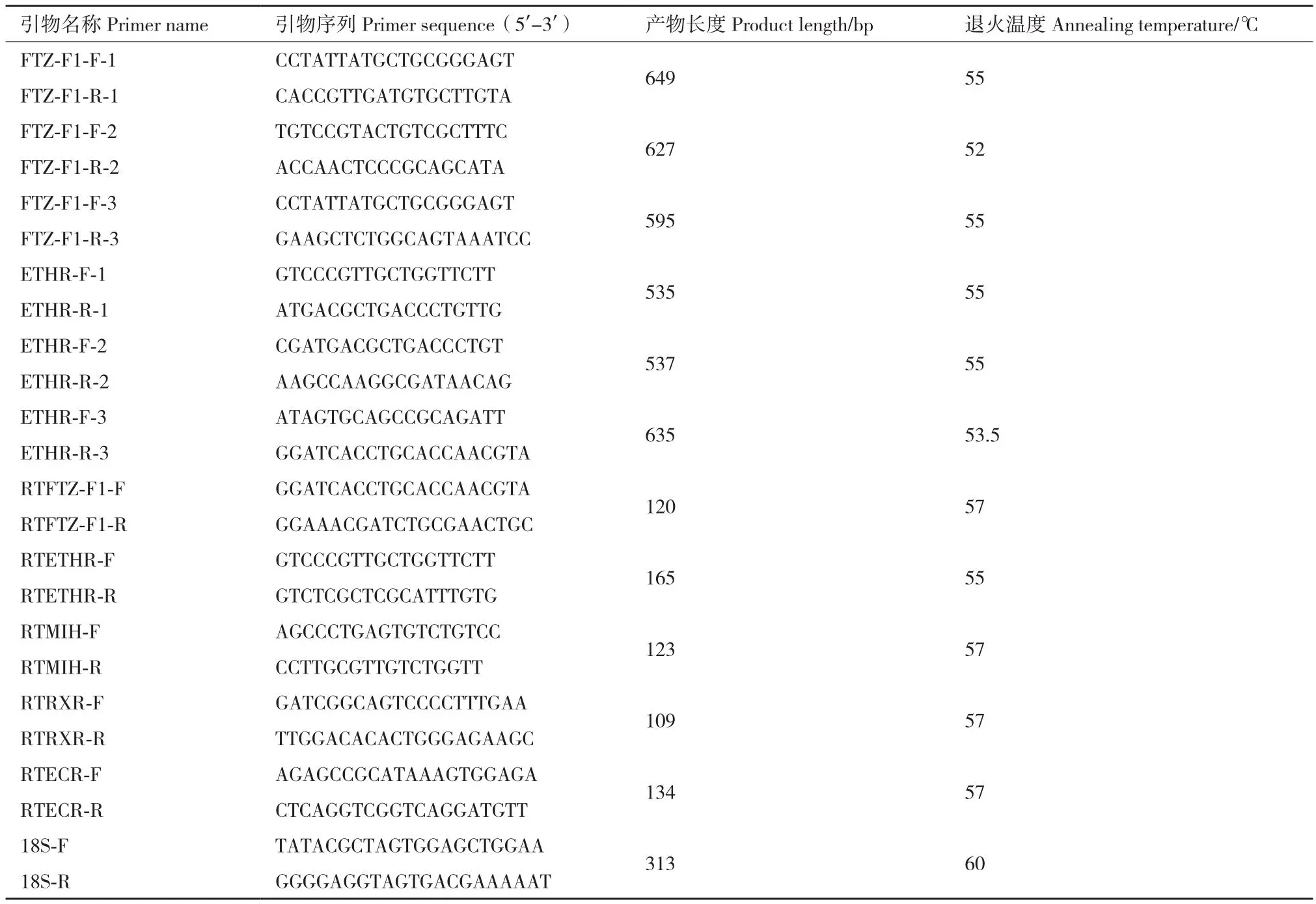
表1 實驗所用引物序列Table 1 Primer sequences used in the experiment
1.2.4 羅氏沼蝦蛻皮相關基因生物信息學分析 獲得羅氏沼蝦Mr-ETHR、Mr-FTZ-F1 CDS 全長序列后,使用下列軟件與工具進行生物信息學分析:采用ORFfinder在線預測開放閱讀框,SMART在線翻譯蛋白氨基酸序列,BLAST對氨基酸序列進行驗證和同源性分析,在線軟件預測蛋白質的等電點、分子量、不穩定系數和親水性等特征,使用Expasy Protaram以及Expasy Protscale在線軟件預測蛋白的信號肽與跨膜結構與NCBI中保守結構域(CDD)數據庫比對,功能結構,在線分析蛋白質二級結構組成與三級結構,通過ClustalX與GeneDoc進行多序列比對,采用MEGA 6.0以鄰接法(Neighbor Joining,NJ)法構建系統進化樹。
1.2.5 羅氏沼蝦蛻皮相關基因表達分析 提取羅氏沼蝦2個組織(肝胰腺和血淋巴)、4個蛻皮階段(AB、C、D和E)總RNA,選取高質量的RNA 樣品,進而反轉錄獲得 cDNA,用于后續RT-qPCR。根據基因序列信息,采用Primer Premier 5.0 軟件設計引物(表1),選用18S rRNA為內參基因,采用TB GreenTMPremix ExTaqTMII(TaKaRa,大連)試劑盒進行RT-qPCR,其反應體系(20 μL)如下:SYBRRPremix Ex TaqTMII 10 μL,上、下游引物各0.8 μL,cDNA 1.6 μL,ddH2O 6.8 μL;反應條件:95℃ 30 s;95℃ 5 s,60℃ 30 s,35個循環。基因相對表達量用2-△△Ct公式[24]進行計算。
1.2.6 統計方法 數據采用平均值±標準誤的形式表示,采用SPSS 19.0軟件進行單因素方差分析(One-Way ANOVA),采用Duncan多重比較進行組間差異分析,P<0.05為差異顯著。采用TBtools[25]進行熱圖繪制,并對基因進行聚類分析。使用Graphpad prism(版本號9.5.0,GraphPad軟件公司,美國)進行基因間相關性分析。
2 結果
2.1 羅氏沼蝦蛻皮相關酶在蛻皮周期的變化
采集不同蛻皮時期羅氏沼蝦的血淋巴和肝胰腺組織進行酶活測定,結果顯示肝胰腺中GS酶活性在D期顯著高于其他蛻皮時期(P<0.05),在E期活性降至最低,C期和D期GS酶活性無明顯差異。血淋巴中GS酶活性在AB期顯著高于其他蛻皮時期(P<0.05),且其他蛻皮時期GS酶活性無明顯差異;在肝胰腺和血淋巴中,NAG酶活性均呈現先上升后下降的趨勢,且在D期活性達到最高。肝胰腺中NAG酶活性在C期顯著低于D期(P<0.05),AB期和E期間NAG酶活性無明顯差異。血淋巴中NAG酶活性在D期顯著高于AB期(P<0.05),且各個蛻皮時期NAG酶活性差異顯著;肝胰腺中幾丁質酶活性在AB期達到最高,在E期活性最低,且各個蛻皮時期差異顯著,總體呈現上升趨勢(圖2)。
2.2 羅氏沼蝦蛻皮激素在蛻皮周期的動態變化
選取羅氏沼蝦不同蛻皮時期的肝胰腺和血淋巴組織進行蛻皮激素含量測定,結果顯示:在肝胰腺和血淋巴中,EH含量在不同蛻皮時期的變化趨勢一致。在肝胰腺和血淋巴組織中,EH含量均在AB期達到最高。在肝胰腺和血淋巴中EH含量呈現上升的趨勢,AB期含量顯著高于C期(P<0.05),且D期和E期間含量無明顯差異(圖3)。
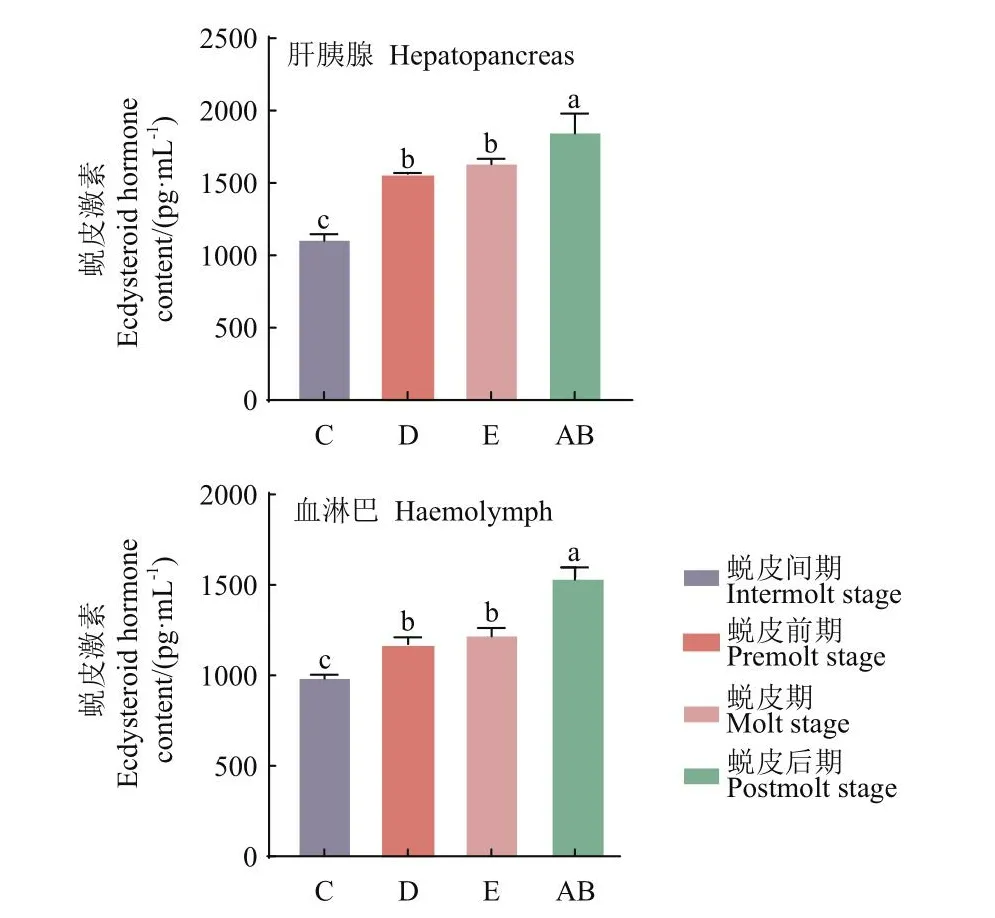
圖3 羅氏沼蝦肝胰腺與血淋巴中不同蛻皮時期蛻皮激素含量變化Fig.3 Dynamics of ecdyhormone content in hepatopancreas and hemolymph in M.rosenbergii at different molting stages
2.3 羅氏沼蝦ETHR和FTZ-F1基因生物信息學分析
通過克隆獲取羅氏沼蝦ETHR基因和FTZ-F1基因的CDS序列,并命名為Mr-ETHR(Gene Bank No:OQ383351)和Mr-FTZ-F1(Gene Bank No:OQ383352)。Mr-ETHR基因開放閱讀框編碼區全長1 173 bp,編碼390個氨基酸,蛋白的分子量為44.39 kD,理論等電點為9.04,具有親水性;與NCBI保守結構域(CDD)數據庫對比,表明Mr-ETHR具有G蛋白偶聯受體家族(G Protein-Coupled Receptors,GPCR)典型的七次跨膜結構域,3個胞外環含有兩個高度保守的的半胱氨酸殘基,這兩個殘基可以形成二硫鍵用來穩固受體。氨基酸序列多序列比對以及同源性分析,發現Mr-EHTR基因與日本沼蝦(M.nipponense, ANN13868.1)的同源性最高,為97.69%,主要是位于21aa和30aa分別由亮氨酸突變為組氨酸和纈氨酸突變為亮氨酸,表明Mr-EHTR基因較為保守。系統進化分析結果顯示,10個物種分成兩大支,為甲殼綱和昆蟲綱支。在家蠶、煙草天蛾、赤擬谷盜和埃及伊蚊中ETHR-A和ETHR-B被單獨分支,說明ETHR-A和ETHR-B在功能上有所區別,而羅氏沼與日本沼蝦聚為一支,說明其親緣關系最近(圖4-A)。
Mr-FTZ-F1基因開放閱讀框編碼區全長1 206 bp,編碼401個氨基酸,蛋白的分子量為43.65 kD,理論等電點為6.35,具有疏水性;利用CDD數據庫比對,發現Mr-FTZ-F1基因存在NR_LBD_Ftz-F1_like結構域(169-399 aa)。將羅氏沼蝦FTZ-F1基因氨基酸序列與其他甲殼動物氨基酸序列進行對比發現Mr-FTZ-F1基因與日本沼蝦(M.nipponense,UQC00153.1)的同源性最高,為98.71%,與南美白對蝦(Penaeus vannamei, XP_027236937.1)、克氏原螯蝦(Procambarus clarkia, XP_045625434.1)、日本對蝦(P.japonicus, XP_042874083.1)和斑節對蝦(P.monodon, XP_037803373.1)的同源性均高于80%,說明Mr-FTZ-F1基因具有一定的保守性。Mr-FTZ-F1基因系統進化樹顯示,13個物種被分成兩大支,并細分為5小支,甲殼綱中的7個物種聚為一支,羅氏沼蝦與同屬的日本沼蝦聚為一支,表明其親緣關系最近(圖4-B)。
2.4 羅氏沼蝦蛻皮相關基因在不同蛻皮周期的表達分析
選取不同蛻皮周期羅氏沼蝦的血淋巴和肝胰腺組織,分析Mr-ETHR、Mr-FTZ-F1、Mr-RXR、Mr-ECR和Mr-MIH基因表達,結果顯示在肝胰腺和血淋巴中,Mr-ETHR均在AB期表達量最高。在肝胰腺中,Mr-ETHR在D期表達量遠遠低于AB期(P<0.05),總體呈上升趨勢。在血淋巴中,Mr-ETHR表達量在E期顯著低于其他蛻皮時期(P<0.05),C期、D期和AB期間無明顯差異。Mr-FTZ-F1在肝胰腺和血淋巴中的表達量均在D期最高,Mr-FTZ-F1在D期的表達量顯著高于AB期(P<0.05),總體呈現先上升后下降趨勢(圖5)。
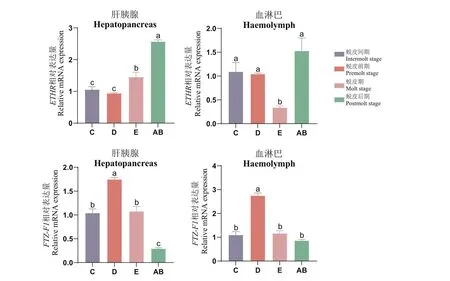
圖5 在不同蛻皮時期內Mr-ETHR、Mr-FTZ-F1基因在肝胰腺和血淋巴組織中的表達情況Fig.5 Expressions of Mr-ETHR and Mr-FTZ-F1 in hepatopancreatic and hemolymphatic tissues at different molting stages
聚類分析結果表明,Mr-ECR在不同蛻皮時期的表達模式與Mr-RXR相似,在肝胰腺和血淋巴組織中,均在AB期表達量最高,且總體呈現上升趨勢。Mr-ETHR在肝胰腺與血淋巴組織中均在AB期表達量最高,Mr-ETHR的表達模式與Mr-ECR和Mr-RXR相似,而Mr-FTZ-F1與Mr-MIH被單獨聚為一支。在肝胰腺和血淋巴組織中Mr-FTZ-F1在D期表達量最高,在AB期表達量最低。Mr-MIH在C期表達量最高,總體呈現下降趨勢。Mr-FTZ-F1與Mr-MIH表達模式與其他基因并不相似(圖6)。
2.5 羅氏沼蝦蛻皮基因間相關性分析
相關性分析顯示:在肝胰腺組織中,Mr-FTZ-F1與Mr-ECR的表達量呈極顯著負相關(r=-0.833 9,P<0.01),與Mr-ETHR的表達量呈極顯著負相關(r=-0.627 5,P<0.01),而在血淋巴組織中,Mr-FTZ-F1與Mr-MIH表達量呈極顯著正相關(r=0.666 5,P<0.01);在肝胰腺組織中,Mr-RXR與Mr-ETHR表達量呈極顯著正相關(r=0.703 0,P<0.01)。肝胰腺和血淋巴中Mr-ETHR與Mr-ECR表達量呈極顯著正相關(r=0.868 0,P<0.01)。
3 討論
在羅氏沼蝦蛻皮過程中,會涉及到機體內能量代謝以及滲透壓的變化。谷氨酰胺通過參與血淋巴滲透壓調控來維持機體正常的生命活動[26],而谷氨酰胺合成酶(GS)是谷氨酰胺合成途徑必不可少的關鍵酶,在機體氨基酸代謝過程中具有重要作用[27]。已有研究發現在凡納濱對蝦[28]和克氏原螯蝦[29]蛻皮過程中谷氨酰胺合成酶中參與了能量代謝過程與滲透壓調節。在中國對蝦(Fenneropenaeus chinensis)的研究中發現谷氨酰胺合成酶能通過間接的方式參與免疫防御過程[30]。本研究發現GS酶在羅氏沼蝦血淋巴組織中的活力明顯高于肝胰腺中,推測可能是因為在蛻皮過程中機體抵抗力下降時,血淋巴作為甲殼動物中主要的免疫與滲透調節器官起著免疫防御病毒感染作用[31]。已有研究表明肝胰腺是甲殼動物的主要代謝器官,包含大量的酶與蛋白質,而GS酶參與細胞內多種酶活動[32]。羅氏沼蝦蛻皮后,在肝胰腺組織中,GS酶活力驟降,推測羅氏沼蝦蛻皮后期短時間內因不能進食從而需要消耗機體自身大量的蛋白質,而GS酶可通過催化合成谷氨酰胺并用于蛋白質合成。
甲殼動物的蛻皮包括舊的外骨骼蛻去、新的外骨骼形成等過程,在此過程中幾丁質酶可起到降解外骨骼的作用,而NAGase作為幾丁質級聯催化降解途徑的關鍵酶,在蛻皮過程中也發揮了關鍵作用[33]。研究表明幾丁質酶在斑節對蝦和中國對蝦甲殼動物中參與了蛻皮過程[34-35]。在日本沼蝦(M.nipponense)和中華絨螯蟹(Eriocheir sinensis)甲殼動物研究中發現,NAG酶活性均在蛻皮前期達到峰值,并與蛻皮激素含量呈正相關[36-37]。本研究測定了幾丁質酶和NAG酶在不同蛻皮周期的活性變化,發現在肝胰腺和血淋巴組織中NAG酶均在蛻皮前期的活性達到最高,推測蛻皮前期是頭胸甲表皮結構顯著變化的時期,而NAG酶在此時期高活力可保證高效降解舊的外骨骼,促進羅氏沼蝦的順利蛻皮,而幾丁質酶在蛻皮后期活性達到最高。
甲殼類動物的蛻皮與生長受多種激素及蛻皮相關基因的調控,黃姝等[38]發現中華絨螯蟹蛻皮激素含量變化在蛻皮周期中是波動的,且在蛻皮間期含量最低。本研究結果表明,血淋巴與肝胰腺中的蛻皮激素含量在羅氏沼蝦不同蛻皮時期內有差異,其中蛻皮間期的含量最低,在蛻皮后期含量達到峰值。ETH-ETHR信號通路在節肢動物中普遍存在,ETHR與配體蛻皮啟動激素(ETH)結合后會參與蛻皮過程,而蛻皮激素會介導ETHR基因的表達[12]。本研究發現在肝胰腺組織中,Mr-ETHR在蛻皮后期的表達量最高,總體呈現上升趨勢,與蛻皮激素含量在不同蛻皮時期的變化趨勢一致,進一步驗證了蛻皮激素能夠誘導Mr-ETHR基因的表達。已有研究證實了甲殼動物的蛻皮激素與FTZ-F1具有緊密聯系,通過去除三疣梭子蟹單側眼柄后檢測FTZ-F1基因的表達量,發現當蛻皮激素濃度升高到峰值會抑制FTZ-F1基因的表達[39]。本研究中蛻皮后期蛻皮激素含量最高,而Mr-FTZ-F1基因的表達量卻是最低,推測羅氏沼蝦蛻皮激素含量在一定峰值內會抑制Mr-FTZ-F1的表達,兩者之間可能存在負調控作用。同樣,已有研究表明蛻皮激素含量與MIH的表達量具有顯著相關性[40]。本研究發現羅氏沼蝦MIH表達具有明顯規律:Mr-MIH在C期表達量最高,在AB期表達量最低,呈逐漸下降趨勢;通過關聯羅氏沼蝦蛻皮周期蛻皮激素含量的變化,結果顯示Mr-MIH表達量與蛻皮激素含量呈現負相關性,進一步驗證了羅氏沼蝦MIH可以抑制蛻皮激素的合成從而調控著羅氏沼蝦蛻皮的發生。Mr-FTZ-F1和Mr-MIH的表達模式相近,并且呈強正相關,表明Mr-FTZ-F1和Mr-MIH在調控羅氏沼蝦蛻皮通路中的調控模式相近。在中華絨螯蟹、中國明對蝦的研究中,發現RXR基因與ECR基因能夠調控甲殼動物的蛻皮[41-42]。本研究證實了羅氏沼蝦Mr-ETHR、Mr-RXR和Mr-ECR在蛻皮周期中表達量呈強正相關性,在血淋巴與肝胰腺組織中,Mr-RXR基因與Mr-ECR基因都在蛻皮后期的表達量最高,與蛻皮激素含量趨勢一致,推測RXR基因需與ECR基因結合形成二聚體從而介導羅氏沼蝦的蛻皮,在羅氏沼蝦的蛻皮功能上表現出協同作用。
4 結論
本研究通過測定在羅氏沼蝦中不同蛻皮時期內蛻皮相關酶的活性、蛻皮激素的含量以及蛻皮信號通路中相關基因的表達量,發現谷氨酰胺合成酶、β-N乙酰氨基葡萄糖苷酶和幾丁質酶在不同蛻皮周期內活性均有差異,Mr-ETHR、Mr-RXR和Mr-ECR共同參與調控羅氏沼蝦蛻皮且其表達量具有顯著的正相關性,并對蛻皮的發生起著正向調節作用,而Mr-FTZ-F1和Mr-MIH在蛻皮信號通路中起負調節作用且具有相似的調控模式,證實了羅氏沼蝦的蛻皮受多種酶、蛻皮激素以及蛻皮通路中基因的調控,為甲殼動物蛻皮調控機制的研究提供理論基礎。

