褪黑素緩解空腸黏膜上皮細胞氧化損傷的效果研究
康凌云 韓露露 韓德平 陳建勝 甘瀚凌 邢凱 馬友記 崔凱
(1.甘肅農業大學動物科學技術學院,蘭州 730070;2.中國農業科學院飼料研究所,農業農村部飼料生物技術重點實驗室,北京 100081;3.中國農業大學動物醫學院,北京 100193;4.北京農學院動物科學技術學院,北京 102206)
動物腸道是重要的營養物質吸收部位,與生長發育密切相關。同時腸道作為重要的先天黏膜免疫屏障器官,在防御病原感染和細菌毒素等方面發揮重要作用[1]。其中,黏膜上皮細胞是直接接觸腸道內環境的細胞,包括柱狀細胞、微皺褶細胞、杯狀細胞、神經內分泌細胞等,它們的主要功能是吸收營養物質,同時也具有抗原遞呈和分泌細胞因子的功能。另外,它們彼此間利用緊密連接蛋白相互嵌合形成一道物理性機械屏障[1-2],減少腸道上皮的通透性,進而減少腸道內容物與黏膜固有層的接觸。一旦上皮細胞發生病理性損傷,引起緊密連接蛋白減少,會增加腸道黏膜的通透性[3]。此外,腸道黏膜表面分泌有免疫球蛋白,上皮細胞間分布有大量先天淋巴細胞,固有層散在有各種免疫細胞,黏膜下層發育形成具有特定免疫細胞的彌散淋巴組織結構,它們構成了腸道黏膜重要的免疫屏障[4]。黏膜上皮細胞受到刺激后,會分泌一系列的調控介質,協調免疫細胞的應答反應,共同來維持腸道內環境的穩定[5]。
在飼養管理過程中,畜禽容易遭受各種應激源刺激,如夏季高溫、長途運輸、限制飼喂和早期斷奶等[6-10],它們均會引起腸黏膜屏障不同程度的損傷。這些應激因素會打破腸道內的微生態平衡,增加細菌粘附能力、黏膜上皮通透性和致病菌內毒素,進一步加重局部感染,誘導趨化大量炎性細胞遷移至感染部位,引起炎性損傷。嚴重時,黏膜上皮細胞死亡脫落,直接暴露黏膜固有層,增加腸腔內病原微生物的感染機會,誘發過激的炎癥反應[11]。其中,多種應激因素的共同特點是引起局部自由基的蓄積,如超氧陰離子和羥自由基等,由此誘發氧化應激損傷[12]。所以,減少應激反應時自由基的產生和累積,可以保護黏膜上皮細胞損傷,有效地維護腸道黏膜屏障,減少飼養管理中的經濟損失。
褪黑素具有提高機體免疫和抗氧化等多種生理功能,是目前眾多內源性和合成的神經保護劑中關注和研究的熱點[13-14]。研究發現,褪黑素(melatonin,MT)可以有效緩解氧化應激、增強固有免疫功能,而且這種緩解氧化損傷的能力在不同物種之間呈現出很強的保守性。褪黑素發揮免疫調節活性,主要是由免疫細胞上的褪黑素受體(MT1和MT2)介導,參與中性粒細胞、自然殺傷細胞、單核細胞和巨噬細胞等細胞的免疫調節作用[15-16]。在免疫抑制條件下,褪黑素通過結合T細胞表面MT受體促進效應T細胞的功能發揮,增加2型輔助性T細胞(T helper cell 2,Th2細胞)的免疫應答[17]。同時,褪黑素還可通過調控免疫調節因子和細胞因子的表達對免疫系統進行調節[18]。研究發現,采用褪黑素處理抗原致敏小鼠,可增加白介素-10(interleukin-10,IL-10)的表達,同時減少腫瘤壞死因子-α(tumour necrosis factor-α, TNF-α)的產生,進而誘導Th2細胞反應[19]。同時,褪黑素可增強小鼠巨噬細胞的抗原遞呈能力,促進T細胞活化,增加主要組織相容性復合體(major histocompatibility complex, MHC)分子和白介素-1(interleukin-1, IL-1)的表達[20]。當給予山羊褪黑素處理后,可以增加血清中炎癥相關細胞因子的含量,增強機體免疫應答能力[21]。此外,腸道神經系統(enteric nervous system,ENS)遍布腸道組織,能夠將收集到的信息迅速傳遞到自體的其它細胞[22]。最新研究報道發現,ENS可以作為免疫系統的感應平臺作用于腸道上皮細胞,促進杯狀細胞抗菌蛋白(antimicrobial protein,AMP)的表達,維持腸道穩態[23]。施用外源靶向神經遞質受體的神經調節化合物對腸道上皮細胞黏液和抗菌蛋白(AMP)的分泌產生廣泛影響[13]。研究發現,在人為模擬熱應激條件下,通過添加褪黑素處理,可以有效緩解熱應激造成的綿羊顆粒細胞的死亡,同時也可抑制綿羊成纖維細胞的凋亡[21,24]。而當給予小鼠和仔豬提前斷奶處理,并同時飼喂外源性褪黑素,可以明顯改善它們腸道黏膜屏障和免疫功能的受損情況,有效緩解提前斷奶造成的應激反應[25-26]。綜上,褪黑素可在抵抗畜禽腸道氧化應激損傷,維持黏膜屏障方面發揮重要作用。
1 材料與方法
1.1 材料
1.1.1 細胞 原代小鼠空腸黏膜上皮細胞,購自華普奧科生物科技(北京)有限公司。
1.1.2 試劑 褪黑素(購買于Sigma,配制方法:將褪黑素用無水乙醇稀釋至100 mmol/L,作為儲液保存在-20℃冰箱中),上皮細胞完全培養基(賽百慷(上海)生物技術股份有限公司),Gibco胎牛血清、0.25%胰酶-EDTA、青鏈霉素和細胞培養用PBS(賽默飛世爾科技(中國)有限公司),硫酸亞鐵和30%過氧化氫(國藥集團化學試劑北京有限公司),丙二醛(MDA)、超氧化物歧化酶(SOD)、過氧化氫酶(CAT)、谷胱甘肽過氧化物酶(GSH-Px)、乳酸脫氫酶(LDH)、白細胞介素6(IL-6)、白細胞介素8(IL-8)ELISA檢測試劑盒(上海酶聯生物科技有限公司),4%多聚甲醛固定液(索萊寶科技有限公司),CK-18抗體(proteintech),Alexa Fluor 594 conjugated Goat Anti-Rabbit IgG(proteintech),MTT檢測試劑盒(索萊寶科技有限公司),Trizol RNA提取試劑盒(Invitrogen公司),反轉錄試劑盒(天根生化科技有限公司),實時熒光定量PCR試劑盒(天根生化科技有限公司)。
1.1.3 儀器和工具 CO2細胞培養箱(上海博迅實業有限公司),酶標儀(美國BioRad iMark),倒置熒光顯微鏡(Leica),超微量分光光度計(Thermo Scientific,德國),蘇州凈化雙人超凈工作臺(LR-1500CP),恒溫水浴鍋,細胞培養板(美國康寧)。
1.2 方法
1.2.1 原代空腸黏膜上皮細胞培養及免疫熒光鑒定 原代小鼠空腸黏膜上皮細胞,用含100 mL/L的胎牛血清和10 g/L青鏈霉素的DMEM培養基培養,置37℃、5% CO2細胞培養箱中培養。當細胞長滿至80%-90%左右時,用0.25%胰酶-EDTA消化細胞,按照1∶2的比例進行傳代培養。后續試驗過程中所用細胞均在F6代內。
將細胞按2×104個/孔接種于96孔板,待細胞貼壁后,吸棄培養基,用PBS清洗兩次。加入800 μL 4%多聚甲醛溶液,室溫固定20 min。PBS清洗2次,加入800 μL 0.1% triton X-100室溫孵育10 min。PBS清洗2次,3%過氧化氫室溫處理15 min。PBS清洗2次,加入,4℃孵育過夜。PBS清洗3次,加入二抗37℃孵育1 h。PBS清洗3次,加入500 μL即用型DAPI溶液,室溫處理5 min。PBS清洗3次,于倒置熒光顯微鏡下觀察。
1.2.2 細胞氧化損傷模型 將F3代空腸黏膜上皮細胞按2×104個/孔接種于96 孔板,置于37℃、5%CO2培養箱中繼續培養。待細胞長滿至80%左右,加入200 μL含不同濃度FeSO4和H2O2(0、2.5、5、10、20、40、80 mmol/L)的DMEM培養基繼續培養3 h。小心吸去上清,加入90 μL新鮮培養液,再加入10 μL 5 mg/mL MTT溶液,繼續培養4 h。然后吸掉上清,每孔加入110 μL Formazan溶解液,置搖床上低速振蕩10 min,使結晶物充分溶解。在酶聯免疫檢測儀490 nm處測量各孔的吸光值。同時設置調零孔(培養基、MTT、Formazan溶解液),對照孔(細胞、相同濃度的藥物溶解介質、培養液、MTT、Formazan溶解液),每組設定5個重復孔。
1.2.3 褪黑素緩解氧化損傷分析 將F5代空腸黏膜上皮細胞按2×104個/mL接種于6孔細胞培養板,待細胞完全貼壁后,吸棄上清,每孔加入800 μL不同濃度的褪黑素(MT)溶液(終濃度分別為5、10、15、30、50、100、150、250、500 μmol/L),置37℃、5% CO2培養箱中繼續培養2 h。同時設置空白組(CON)和氧化損傷模型組(FeSO4/H2O2),空白組不做任何處理。褪黑素處理2 h后,吸棄對照組和褪黑素處理組的細胞上清,分別加入2 mL含10 mmol/L FeSO4和H2O2的DMEM培養基,繼續培養3 h。然后,吸取細胞上清,6 000 r/min離心10 min,棄沉淀,留取上清液進行相關指標的ELISA檢測。
1.2.4 ELISA檢測 設置標準品孔和樣本孔,標準品孔各加不同濃度的標準品50 μL,待測樣品孔中先加樣品稀釋液40 μL,然后加待測細胞上清10 μL。每孔加入酶標試劑100 μL,用封板摸封板后37℃溫育60 min。洗滌液重復洗滌5次,盡量拍干。每孔分別加入顯色劑A和B各50 μL,37℃避光顯色15 min。每孔加終止液50 μL終止反應,于450 nm波長測定各孔的吸光度。其中,檢測指標包括MDA、SOD、CAT、GSH-Px、LDH、IL-6和IL-8。
1.2.5 核酸提取和RT-qPCR反應 使用Trizol RNA試劑盒提取細胞總RNA;使用NanoDrop ND-2000分光光度計對提取的 RNA 濃度和純度進行檢測,選取OD260/ OD280介于 1.8-2.1,OD260/ OD230大于2.0的RNA 樣品,并經1%的瓊脂糖凝膠電泳對其完整性進行檢測。選擇質量合格的RNA樣品,按反轉錄試劑盒操作說明中的兩步法完成cDNA第一鏈的合成。從NCBI數據庫中檢索羊TNF-α(NM_001024860.1)、IL-1β(NM_001009465.2)、IL-6(NM_001009392.1)的mRNA序列,并利用Pick Primers進行引物設計,之后通過NCBI上的Blast檢測引物特異性,最后由上海生工生物公司合成,引物序列見表1。以反轉錄得到的cDNA為模板,按照實時熒光定量PCR試劑盒建議的體系進行RT-qPCR擴增。RT-qPCR擴增體系:2×SR PreMix Plus 10 μL,上、下游引物各 0.5 μL,cDNA模板 1 μL,RNase-Free ddH2O 8 μL,每個獨立的試驗至少重復 3 次。
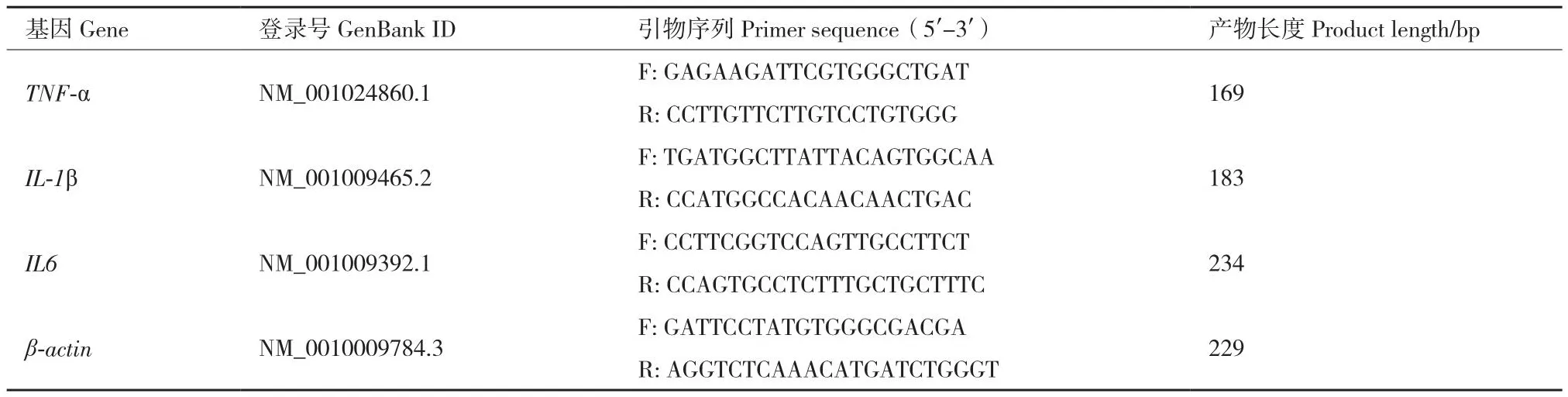
表1 引物序列信息Table 1 Primer sequence information
1.2.6 數據分析 所有數據經過Excel初步整理后,采用SAS 9.2軟件(SAS Inst.Inc., Cary, NC)進行分析。使用one-way ANOVA模型分析,單因素為不同的處理方式,P < 0.05和P < 0.01為差異顯著,具有生物統計學意義。
2 結果
2.1 空腸黏膜上皮細胞可進行分離培養
對原代分離培養的空腸黏膜上皮細胞進行形態學觀察,發現該細胞呈現鋪路石樣生長(圖1-A,1-B)。經傳代培養后,發現該細胞可穩定傳代10代以上。經CK-18免疫熒光染色后發現,該細胞呈明顯強陽性表達(圖1-C,1-D),純度達到90%以上。說明分離的細胞是空腸黏膜上皮細胞,純度較高,可用于后續實驗。

圖1 空腸黏膜上皮細胞形態及CK-18免疫熒光染色Fig.1 Jejunum epithelial cell morphology and CK-18 immunofluorescence staining
2.2 FeSO4 /H2O2處理可引起黏膜上皮細胞明顯氧化損傷
為了探索FeSO4/H2O2處理粘膜上皮細胞一定時間后造成的損傷情況,以不同濃度(0、2.5、5、10、20、40、80 mmol/L)的FeSO4/H2O2處理接種細胞的96孔板,利用MTT法檢測其在相同作用時間下對黏膜上皮細胞的影響。結果如圖2所示,利用FeSO4/ H2O2處理黏膜上皮細胞,可明顯引起細胞氧化損傷,與空白組細胞相比(圖2-A),FeSO4/ H2O2處理后,黏膜上皮細胞皺縮變圓,大量細胞脫落(圖2-B)。
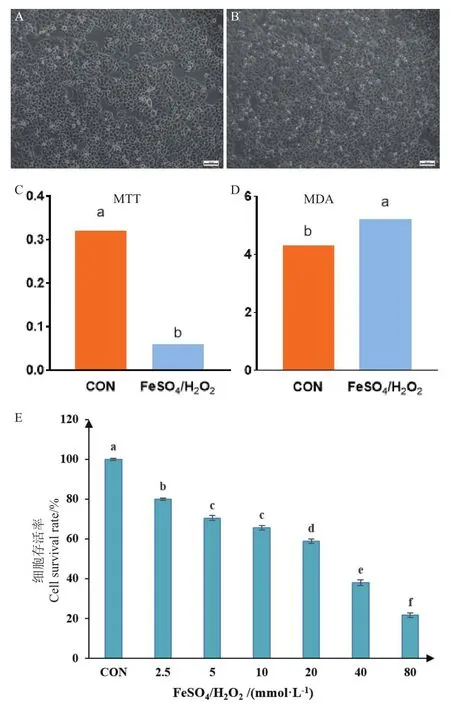
圖2 FeSO4/H2O2處理可明顯引起黏膜上皮細胞氧化損傷Fig.2 FeSO4/H2O2 treatment significantly causing the oxidative damage to mucosal epithelial cells
MTT結果表明,FeSO4/ H2O2處理后,細胞存活率明顯下降(圖2-C,P < 0.05),且MDA的含量在FeSO4/ H2O2處理后顯著增加(圖2-D,P <0.05);圖2-E的結果表明,細胞的致死率隨FeSO4/H2O處理濃度的增大而增大,且呈現出明顯的依賴性,不同處理組的細胞致死率與正常對照組差異顯著(P<0.05)。2.5、5、10、20、40、80 mmol/L FeSO4/H2O2處理后,細胞的存活率分別為80.1%、70.5%、65.8%、58.9%、38.1%、21.6%(圖2-E),其中40、80 mmol/L FeSO4/ H2O2作用黏膜上皮細胞后,細胞成片脫落,大量死亡,造成不可逆損傷,無法利用藥物進行修復。
綜合分析MTT和MDA結果,決定使用10 mmol/L 的FeSO4/H2O2處理空腸黏膜上皮細胞,建立氧化損傷模型用于后續實驗分析。
2.3 褪黑素對黏膜上皮細胞具有明顯的抗氧化保護作用
為了探索不同濃度外源添加褪黑素對空腸黏膜上皮細胞具有明顯的抗氧化保護作用,我們分別以不同的濃度(5、10、15、30、50、100、150、250、500 μmol/L)的褪黑素處理接種細胞的96孔板,利用MTT法檢測不同濃度褪黑素在不同作用時間下對黏膜上皮細胞的影響。如圖3-A所示,褪黑素濃度為5-15 μmol/L時,細胞存活率>90%,而當其濃度超過100 μmol/L時,會對空腸黏膜上皮細胞產生傷害;因此我們選擇10 mmol/L褪黑素作為后續的安全濃度。Calcein-AM/PI雙染結果顯示,褪黑素的添加明顯緩解了FeSO4/H2O2引起的氧化損傷,死細胞數量大幅度下降(圖3-B,3-C),這表明褪黑素對空腸黏膜上皮細胞具有明顯的抗氧化保護作用。

圖3 褪黑素處理可明顯緩解黏膜上皮細胞的氧化損傷Fig.3 Melatonin treatment significantly ameliorating the oxidative damage to mucosal epithelial cells
同時,與對照組相比,FeSO4/H2O2處理明顯引起細胞氧化應激,MDA的表達顯著增加(表2);而添加不同濃度的褪黑素預處理后,MDA的表達明顯減少(P<0.05)。此外,FeSO4/H2O2的處理可引起黏膜上皮細胞中LDH的顯著提高,而預先加入0.01 mmol/L和1 mmol/L的褪黑素,可明顯減少LDH的釋放。FeSO4/H2O2處理能夠降低黏膜上皮細胞表達SOD、GSH-Px和CAT的表達,而通過外源添加不同濃度的褪黑素后,可顯著提高GSH-Px在黏膜上皮細胞內的表達(P<0.05)。

表2 不同濃度褪黑素預處理對黏膜上皮細胞抗氧化因子的表達影響Table 2 Effects of pretreatment with different concentrations of melatonin on the expressions of antioxidant factors in mucosal epithelial cells
2.4 褪黑素可調節黏膜上皮細胞炎性因子表達
外源添加褪黑素可影響黏膜上皮細胞炎癥反應相關因子的表達(圖4)。檢測發現,10 mmol/L 的FeSO4和H2O2氧化損傷模型并沒有明顯影響黏膜上皮細胞IL6和IL8的含量變化。但是,與對照組和氧化損傷模型組相比,1 mmol/L的褪黑素處理后,黏膜上皮細胞顯著降低了IL-6的表達(P<0.05)。而10 mmol/L褪黑素添加可顯著增加黏膜上皮細胞內IL-8的含量(P<0.05)。應用 RT-qPCR,以內參基因β-actin對各組TNF-α、IL-1β、IL-6的mRNA表達量進行校正;結果如圖5所示,TNF-α、IL-1β、IL-6 mRNA 表達水平與ELISA檢測結果基本一致,說明外源添加褪黑素可影響黏膜上皮細胞炎癥反應相關因子的表達。
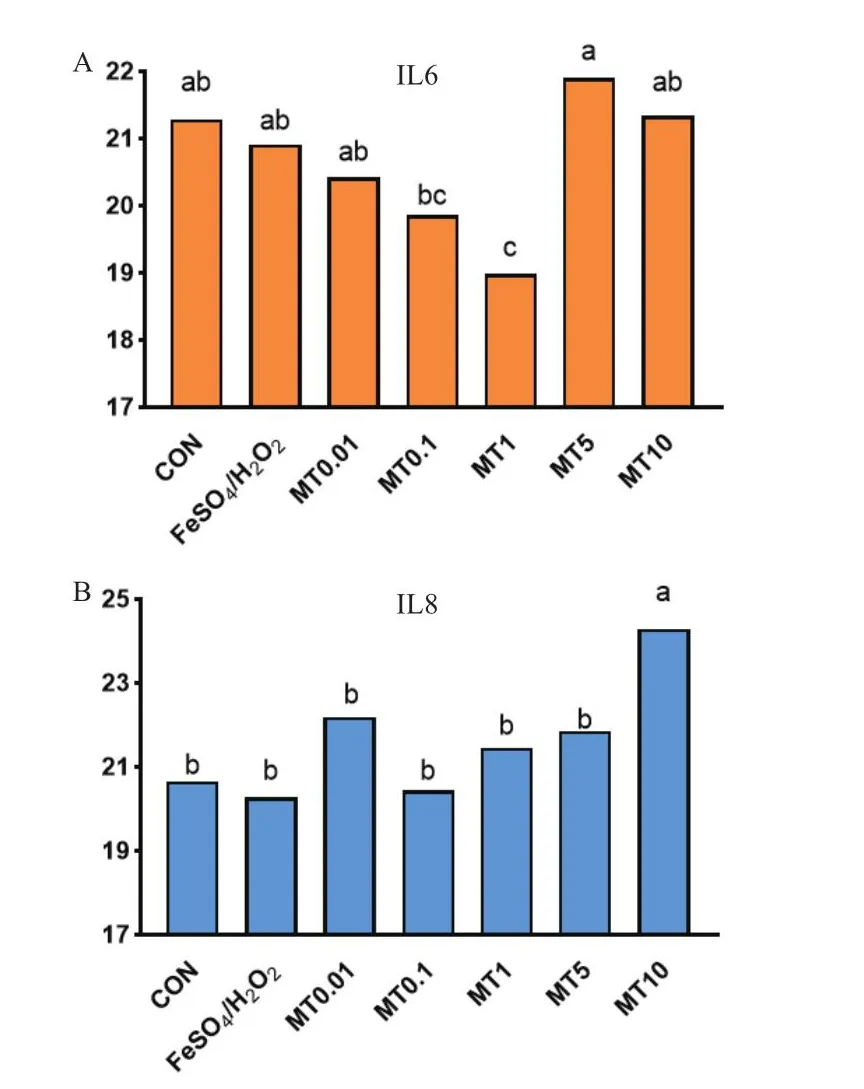
圖4 褪黑素調節黏膜上皮細胞氧化損傷時IL-6和IL-8的表達Fig.4 Melatonin regulating the expressions of IL-6 and IL-8 during oxidative injury of mucosal epithelial cells
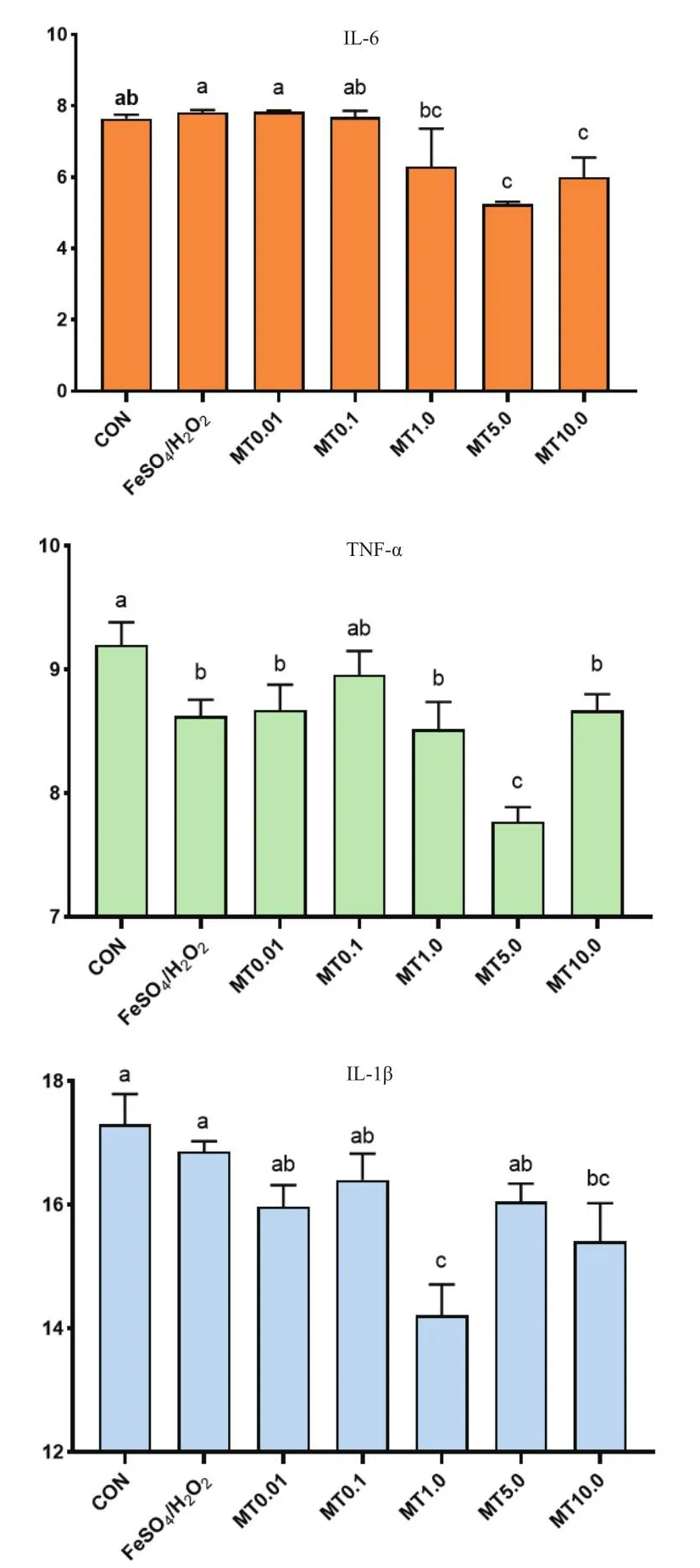
圖5 褪黑素調節粘膜上皮細胞氧化損傷時TNF-α、IL-1β及IL-6的mRNA表達水平Fig.5 Melatonin regulateing the mRNA expression of TNF-α, IL-1β and IL-6 during oxidative injury of mucosal epithelial cells
3 討論
氧化應激主要與活性氧的大量累積有關。活性氧(reactive oxygen species, ROS)主要包括超氧陰離子、過氧化氫和羥自由基,其作為重要的第二信使可啟動細胞內特定信號通路,通過調控相關基因的表達而維持細胞的特定生理功能[27]。而當ROS產生過多時,超過了機體的抗氧化能力,會引起ROS在體內的異常蓄積。此時,ROS失去了正常的生理調節功能,反而會導致細胞核DNA和線粒體DNA突變或缺失,細胞膜脂質過氧化和蛋白氧化損傷,進而造成細胞內膜流動性改變、重要酶失活,最終導致細胞凋亡和組織結構損傷[28]。已經有研究發現,氧化應激可引起機體氧化損傷,與多種病理過程密切相關。如心肌缺血再灌注損傷時心肌細胞的凋亡、睪丸支持細胞和精子細胞的損傷、神經元氧化應激損傷、卵巢衰老及儲備功能下降等[29-33]。我們發現,FeSO4和H2O2反應產生的氧自由基和羥自由基,可引起腸黏膜上皮細胞的明顯損傷,導致細胞皺縮變圓,并形成凋亡小體,說明自由基確實可引起腸黏膜上皮細胞的明顯凋亡和壞死。
機體內存在重要的抗氧化防御機制,主要包括抗氧化酶和各種抗氧化活性物質[34-35]。其中,抗氧化酶包括SOD、CAT、還原型谷胱甘肽(glutathione,GSH)、GSH-Px等。抗氧化活性物質包括褪黑素、α硫辛酸、谷胱甘肽、類胡蘿卜素、維生素C和E、微量元素銅鋅硒錳等。我們發現FeSO4和H2O2引發的氧化損傷,可引起腸黏膜上皮細胞抗氧化酶的表達下降,而通過添加褪黑素后,細胞內抗氧化酶的表達明顯增加,抗氧化能力明顯增強。
此外,炎癥反應伴有大量炎性細胞的浸潤和免疫應答,它們在發揮免疫效應的同時,細胞也會產生大量自由基[36]。如果機體此時抗氧化能力下降或由于組織損傷缺失抗氧化能力,便會進一步加劇炎性損傷。伴隨著活性氧自由基的積累,動物血液中IL-1β、IL-6、TNF-α及IFN-γ等促炎性細胞因子表達水平升高,進而誘發劇烈的炎癥反應[37-38];而IL-8則被認為是非常重要的中性粒細胞分化誘導物,具有抗炎作用[39]。我們的研究結果表明,褪黑素可以引起腸黏膜上皮細胞炎性細胞因子IL-6的表達下降,而趨化因子IL-8的表達上升,說明褪黑素可以減少炎性因子對上皮細胞的損害,還可通過趨化誘導其它免疫細胞的遷移來修復局部黏膜上皮的損傷。RT-qPCR結果進一步證實了這一結論,添加褪黑素后,細胞內IL-1β、IL-6、TNF-α的表達水平均較之氧化應激組有所下調,說明褪黑素可以減緩氧化應激誘導的腸道免疫損傷。
4 結論
褪黑素可以明顯減輕自由基引起的細胞氧化損傷,下調氧化產物MDA的表達水平,增加抗氧化酶的含量。而且上皮細胞炎性細胞因子表達水平降低,趨化因子的表達明顯增加。綜上,褪黑素可以保護自由基引起的空腸黏膜上皮細胞氧化損傷,并能夠減輕細胞損傷引起的炎癥反應。

