TLS和PD-1/PD-L1信號通路在肝細胞癌免疫治療方面的研究進展
喬浩東,劉一璠,梁 澤,郭懷斌
河北省人民醫院肝膽外科(石家莊 050051)
肝細胞癌(hepatocellular carcinoma,HCC)是全球最常見的惡性腫瘤之一,亞洲尤其嚴重,據世界衛生組織調查顯示,2020年亞洲HCC新增人數占全球72.5%,相關死亡人數占全球73.3%[1]。現代醫學手術和介入相結合的療法對部分HCC患者產生了不錯的療效[2-5]。但大多數患者發現HCC時已經出現轉移,無法進行手術[6]。近年來,免疫療法尤其是抗程序性死亡因子1及其受體(programmed cell death-1 and its ligand,PD-1/PD-L1)通路治療對部分晚期HCC的預后有所改善[7-9],但該療法的預后缺乏可靠的預測指標[9]。如何篩選出適合PD-1/PD-L1的優勢人群,從而節約醫療資源,降低患者醫療費用,已成為目前免疫治療的熱點。最新研究表明,三級淋巴結構(tertiary lymphoid structures,TLS)對HCC免疫治療的預后有一定的指導作用。本文闡述了TLS和PD-1/PD-L1信號通路在HCC治療中的最新進展及TLS對抗PD-1/PD-L1預后的預測價值。
1 TLS與HCC及其免疫治療
1.1 TLS的基本結構
TLS是在非造血器官中形成的淋巴聚集物,該結構最初在黑色素瘤和非小細胞肺癌中發現,之后在多種腫瘤組織中被證實[10-11]。基本結構由生發中心、B細胞區和T細胞區構成,其中生發中心由成熟B淋巴細胞、樹突狀細胞(dendritic cell,DC)構成,B細胞區由B淋巴細胞構成,T細胞區由T淋巴細胞構成。成熟TLS的生發中心較大,T細胞區較小[12]。
1.2 TLS的形成機制
C-X-C趨化因子配體13 (C-X-C chemokine ligand 13,CXCL13)及其受體C-X-C趨化因子受體5(C-X-C chemokine receptor 5,CXCR5)與肺癌、結直腸癌、皮膚黑色素瘤及口腔癌等多種腫瘤的TLS形成有關[13-15](具體機制詳見圖1)。此外,凋亡外泌體樣囊泡可通過促進淋巴毒素和炎癥因子的釋放從而促進TLS形成[16](具體機制詳見圖2);有研究發現CXCL13會促進淋巴毒素分泌[16-17],這可能是其產生和發展TLS的途徑;Suematsu等人發現趨化因子與DC可促進TLS中淋巴細胞簇的形成,且趨化因子起主導作用,DC起增強作用[18];Finkin等人發現與同月齡Alb-cre小鼠相比,IKK-β(EE)Hep小鼠(該小鼠能持續表達IKKB及NF-κB轉錄活性)肝臟中TLS較多[19],說明IKK-NF-κB信號通路是肝臟TLS產生的重要途徑。
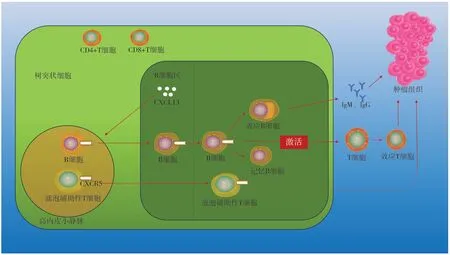
圖1 CXCL13促進TLS的形成Figure 1.CXCL13 promotes the initiation of tertiary lymphoid structure development
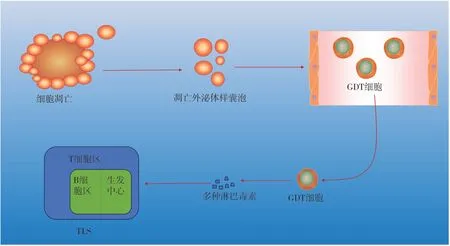
圖2 細胞凋亡促進TLS形成Figure 2.Apoptosis promotes the initiation of tertiary lymphoid structure development
1.3 TLS的測量和分級方法
目前臨床上采用HE染色或HE染色聯合免疫組化判定HCC組織中TLS的存在。HE染色切片中TLS的特征是成熟DC位于T細胞區并鄰近生發中心[20]。TLS常見免疫組化標志物為CD21、CD20 、CD3、CD8 和CD208[21-22]。
在HCC的TLS分級方面,目前缺乏統一的分級標準。近年來比較有影響力的分級方法是Julien Calderaro等人的方法:①淋巴細胞聚集體型TLS:模糊、定義不清的淋巴細胞簇;②初級淋巴濾泡型TLS:無生發中心形成的圓形淋巴細胞簇;③次級淋巴濾泡型TLS:含有生發中心的濾泡[19,23-24]。此外,Nie等人根據成熟度將TLS分為聚集體(腫瘤樣本僅顯示聚集體而無淋巴濾泡)和淋巴濾泡型TLS(腫瘤樣本顯示至少一個淋巴濾泡或生發中心,有無聚集體均可)[22]。而在非小細胞肺癌的TLS相關研究中,Devi-Marulkar等人提出可以根據TLS內部免疫細胞比例的不同,如調節性T細胞(Treg)/B細胞和γδT細胞等對TLS進一步劃分,優化分級方法[25]。
1.4 誘導TLS形成的方法
目前大多數研究表明,TLS對HCC的預后起到積極作用,可考慮人工誘導TLS的形成以改善HCC預后。Suematsu等人研究將表達LTα或趨化因子的細胞系和DC嵌入到海綿狀膠原支架并移植到小鼠的腎包膜下進行培養,成功構建出了人工TLS,并且證實了其結構和功能與一般TLS存在相似性[18,26]。此外,Aoyama等人根據TLS的形成條件,總結了目前可能作為人工TLS支架的構建材料,如膠原基質、水凝膠、介孔二氧化硅棒和聚酰胺纖維[27]。
1.5 TLS對HCC免疫的影響
腫瘤相關TLS有助于腫瘤浸潤淋巴細胞產生抗腫瘤免疫應答,從而改善腫瘤預后[28]。作為淋巴細胞產生局部免疫的“前沿堡壘”和“傳導體”,淋巴細胞產生的多種抗腫瘤免疫作用需通過TLS啟動和維持,包括T細胞免疫、B細胞體液免疫、DC抗原呈遞或其他結構的作用。Lin等人發現TLS通過產生中樞記憶T淋巴細胞和漿細胞,在抗腫瘤特異性免疫反應中發揮關鍵作用[29]。Sautès-Fridman等人通過泛癌分析制作了T-分布隨機鄰域嵌入圖,發現HCC組織中,腫瘤內TLS成熟度的增加則提示機體產生了長期的抗腫瘤免疫[30]。Wen等人通過單因素比例風險回歸分析發現TLS內中性粒細胞/淋巴細胞比值與HCC總生存率呈正相關[21]。El-Rebey等人的研究表明HCC腫瘤TLS內的CD8+T、CD4+T和NK等免疫細胞發揮抗腫瘤作用[31]。Li等人通過對HCC患者的腫瘤組織進行免疫熒光和免疫組化染色,也發現TLS內CD20+B細胞和CD8+T細胞的數量與HCC患者總生存期呈明顯正相關關系,CD3+T細胞和LAMP3+DCs的數量與患者無進展生存期顯著正相關[32]。
然而,在HCC中,局部免疫不僅產生抗腫瘤作用,也具有加速腫瘤惡性程度進展的作用。這是因為在長期抗HBV的免疫過程中,免疫抑制介質例如肝臟駐留的Kupffer細胞分泌的白細胞介素-10,作用于HBV特異性CD8+T細胞,使其數量減少或活性喪失,導致免疫系統無法根除HBV感染[33-34]。但其他免疫細胞如CD4+T細胞仍然繼續分泌細胞因子和生長因子,刺激肝臟持續產生炎癥,導致肝損傷和肝細胞再生的重復循環,進而加速腫瘤進展。Finkin等人通過分析82例進行過肝切除的HCC患者的臨床資料、組織學切片和肝TLS相關基因,發現TLS與HCC預后呈負相關[19]。研究認為IKK-β(EE)Hep小鼠肝組織中TLS表達增多,HCC發生率升高,而注射抗原Thy-1.2抗體(該種抗體通過消融T淋巴細胞和自然殺傷細胞減少了TLS的產生和發展)的小鼠HCC產生幾率較低[19]。此外,TLS周圍的肝細胞最先惡化為腫瘤細胞并表達多種HCC祖細胞標志物。組織學檢測證實這是因為TLS中的T淋巴細胞和B淋巴細胞通過分泌LTα等細胞因子,促使其周圍的肝細胞向惡性腫瘤細胞轉化并獲得自分泌相同細胞因子的能力。Zhao等人的研究發現TLS中Tregs產生促腫瘤作用,并會加速HCC的惡化[35]。
2 PD-1/PD-L1通路與HCC及其免疫治療
2.1 PD-1/PD-L1通路與腫瘤免疫
PD-1是一種在免疫細胞表面表達的抑制性跨膜蛋白,PD-L1在多種組織類型的表面,而PD-L2大部分在造血細胞表面[36]。該信號可調節T淋巴細胞,在免疫穩態、消炎、耐受等方面具有重要作用。PD-1在其胞質結構域中有兩個酪氨酸基序,當與配體接合時,酪氨酸殘基處被磷酸化,募集多種蛋白酪氨酸磷酸酶(protein tyrosine phosphatase,PTPs),如蛋白酪氨酸磷酸酶Src和同源蛋白2等。這些PTPs通過去磷酸化作用拮抗T細胞抗原受體(TCR)和CD28產生的陽性信號,從而影響T淋巴細胞的下游信號通路分子,例如磷酸肌醇3激酶(PI3K)-Akt、Ras、胞外信號調節激酶(ERK)、VAV和磷脂酶Cγ(PLCγ)、p27、p15[37-39]。
正常細胞表面表達PD-L1,通過結合PD-1而抑制淋巴細胞功能。當組織損傷時,細胞表面的PD-L1表達量減少,出現免疫反應[40]。較大程度的免疫反應會產生炎癥,促進PD-L1表達量增加,減少免疫系統對正常組織的損傷,形成負反饋循環,既保證了免疫系統能發揮作用,又減少了對正常組織的損傷。腫瘤細胞高度表達PDL1,通過PD-1/PD-L1通路減少淋巴細胞的殺傷作用和長期免疫作用,產生免疫逃逸[41]。阻斷PD-1/PD-L1通路可以增強腫瘤免疫治療效果[42](圖3)。
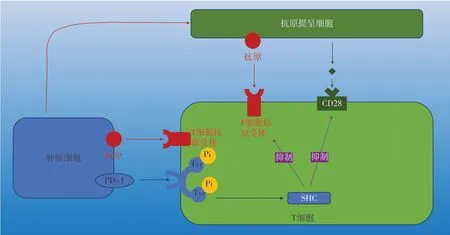
圖3 腫瘤細胞通過PD-1/PD-L1通路抑制免疫細胞的殺傷作用Figure 3.Tumor cells inhibit the killing effect of immune cells through PD-1/PD-L1 pathway
2.2 PD-1/PD-L1免疫治療的不足
目前分子靶向治療和免疫治療是晚期HCC唯一的治療方案。免疫治療,尤其是抗PD-L1聯合抗血管內皮生長因子(vascular endothelial growth factor,VEGF)療法顯示出更高的緩解率(約30%),并顯著延長HCC患者生存期[43],例如卡瑞利珠單抗、納武單抗或帕博利珠單抗聯合索拉非尼療法[44-47]。盡管如此,大多數晚期HCC患者對靶向治療反應仍不佳[48-49]。實際臨床治療中,抗PD-1/PD-L1藥物應答率普遍較低,如納武單抗的應答率僅20%[45]。且有研究表明,抗PD-1/PD-L1治療甚至會增加非酒精性脂肪肝所致HCC的惡性程度[50-51]。因此,在進行PD-1/PD-L1免疫治療前需檢測生物標志物預測治療效果,以降低治療成本并避免治療相關不良事件。目前對抗PD-1/PD-L1免疫治療HCC預后的評估指標——免疫組化、腫瘤突變負荷和微衛星不穩定狀態的準確性均不足[9,45,47]。由于肝癌組織本身很少發生基因突變,因此后兩項并不作為主要評判指標,尤其是腫瘤突變負荷,不僅尚未得到驗證,甚至在HCC免疫治療中的作用也未完全闡明[52-53]。雖然在多種腫瘤中,PD-L1表達程度的增加與PD-1阻斷治療反應率的增加和腫瘤預后的改善有關[54-56],但在HCC免疫治療中PD-L1的表達卻不能準確預測療效,例如在KEYNOTE-224以及CheckMate 040試驗中,PD-L1就不具有預測價值[45,47]。Yan等人在探索HCC免疫治療生物標志物的研究中同樣觀察到PD-L1的表達程度不足以對HCC中抗PD-1/PD-L1免疫治療效果進行準確預測[57]。因此,迫切需要開發更有效的生物標志物,以準確預測抗PD-1/PD-L1免疫治療對晚期HCC患者的療效。
3 TLS與HCC抗PD-1免疫治療
TLS作為腫瘤免疫環境的首要特征[58],反映抗腫瘤免疫應答的程度[20,59],對抗PD-1/PD-L1免疫治療效果有一定的預測價值[12,59]。2020年以來均有研究發現在多種腫瘤中,成熟TLS與免疫治療的更好反應性有關[60-61]。Helmink發現TLS中的B細胞可通過與其他免疫成分相互作用并分泌細胞因子(包括TNF、IL-2、IL-6和IFNγ)激活和招募其他免疫細胞如T淋巴細胞,以增強腫瘤對免疫治療的反應[62]。Clubb等人也發現TLS形成與頭頸癌抗PD-1/PD-L1免疫治療有協同作用,這與TLS維持免疫反應微環境中的作用有關,并據此提出可通過誘導產生TLS或增加其成熟度以增強免疫治療作用的觀點[63]。此外,Li等在HCC與TLS相關性的研究中發現,淋巴細胞特異性蛋白酪氨酸激酶作為通過調控細胞因子信號通路、趨化因子信號通路和T細胞活化參與TLS形成和成熟的分子,其表達水平與HCC患者對HCC免疫治療的敏感性呈正相關[32]。Zhong等以高密度TLS作為判斷條件,對伴有門靜脈瘤栓的HCC實行抗PD-1治療聯合索拉非尼,發現預測效果良好,表明TLS有作為預測免疫治療反應指標的價值[64]。因此,在研究抗PD-1/PD-L1免疫治療效果時,可考慮將TLS視為一個生物標志物。
4 結語
未來HCC免疫治療的研究方向可能為:①從TLS入手,提出預測HCC術后復發的循證醫學證據;②將導致HCC、亞臨床HCC和有惡化為HCC風險的肝臟疾病的病因作為一個考慮因素,評判HCC患者聯合治療時是否應當加入抑制PD-1通路的免疫治療以及將其作為主要治療方式或輔助治療,可通過以上兩點,更新HCC患者免疫治療的評判量表,依據病情提出提升患者生存時間和生存質量的方案;③目前預測抗PD-1/PD-L1療效的指標單一,將TLS及其密度、與腫瘤位置的遠近、組成成分和成熟程度作為抗PD-1/PD-L1療效的評判指標可提高預測準確度;④HCC中TLS存在及成熟度與抗PD-1/PD-L1療效呈負相關,因此,誘導TLS形成或成熟可能成為提高HCC抗 PD-1/PD-L1療效的方法之一。

