槲皮素對鈦顆粒誘導的成骨細胞凋亡抑制作用研究
游鎮君,蔣毅,吳可沁,季斌,胡安全,蔣侃凌
槲皮素對鈦顆粒誘導的成骨細胞凋亡抑制作用研究
游鎮君,蔣毅,吳可沁,季斌,胡安全,蔣侃凌
浙江省嘉興市第一醫院骨科,浙江嘉興 314000
探討槲皮素對鈦顆粒誘導的成骨細胞凋亡的抑制作用。采用鈦顆粒處理小鼠MC3T3-E1細胞系構建細胞凋亡模型,應用槲皮素進行干預并設置對照,噻唑藍法[3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di- phenytetrazoliumromide,MTT法]法檢測細胞增殖活性,流式細胞術檢測細胞凋亡,酶聯免疫吸附試驗(enzyme-linked immunoadsordent assay,ELISA)檢測白細胞介素-1β(interleukin-1β,IL-1β)和腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)表達,免疫熒光技術檢測C/EBP同源蛋白(C/EBP homologous protein,CHOP)、B細胞淋巴瘤因子2(B-cell lymphoma-2,Bcl-2)蛋白的表達,實時定量聚合酶鏈反應(real-time polymerase chain reaction,RT-PCR)檢測CHOP和Bcl-2的mRNA的表達。鈦顆粒抑制成骨細胞增殖活性,并呈濃度依賴性。流式細胞術檢測結果顯示,鈦顆粒誘導成骨細胞凋亡。槲皮素預培養能有效緩解鈦顆粒對成骨細胞增殖活性的抑制,減少其凋亡。ELISA檢測結果顯示,槲皮素能減少IL-1β和TNF-α表達。免疫熒光技術顯示槲皮素參與調控CHOP蛋白和Bcl-2蛋白的表達,RT-PCR檢測結果顯示,槲皮素參與調控CHOP和Bcl-2的mRNA的表達。槲皮素能抑制鈦顆粒誘導的成骨細胞凋亡,其作用機制可能與內質網應激啟動的凋亡途徑抑制,調控CHOP、Bcl-2蛋白表達的信號通路有關。
槲皮素;成骨細胞;細胞凋亡;鈦顆粒
磨損顆粒碎屑所誘導的骨溶解和骨吸收是造成人工關節置換術后假體松動的主要原因[1]。目前,人工關節置換術后假體松動尚無有效的預防和治療方法。如能用藥物預防和治療人工關節置換術后假體松動,不僅可延長人工關節假體的使用壽命、避免翻修手術,而且可為患者減輕痛苦和節約費用,具有巨大的社會效益和經濟效益。槲皮素及其衍生物是植物世界分布最廣的黃酮類化合物,具有抗氧化、抗突變、抗血管形成、抑制組胺分泌等作用[2]。內質網應激(endoplasmic reticulum stress,ERS)啟動的凋亡途徑是近年來研究的熱點。研究發現,槲皮素能抑制ERS凋亡途徑[3]。但是目前還沒有使用槲皮素對假體松動治療的研究報道。目前大多數研究在于磨損顆粒激活破骨細胞引起的骨溶解方面。然而作為假體周圍的主要細胞成分,成骨細胞也參與了無菌性松動的病理過程[4]。本實驗采用磨損鈦顆粒誘導成骨細胞凋亡作為模型,研究槲皮素對鈦顆粒誘導成骨細胞凋亡抑制作用,并探索其可能的機制,為其應用于假體周圍骨溶解及無菌性松動的治療提供實驗依據。
1 材料與方法
1.1 材料
1.1.1 細胞株 小鼠成骨細胞MC3T3-E1細胞系購自上海安為生物科技有限公司。
1.1.2 藥物與試劑 1640培養基、磷酸鹽緩沖液(phosphate buffer saline,PBS)緩沖液、胰蛋白酶均購自艾爾吉生物科技有限公司;3-(4,5-二甲基噻唑- 2)-2,5-二苯基四氮唑溴鹽[3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di- phenytetrazoliumromide,MTT]溶液、Annexin V-FITC/PI細胞凋亡檢測試劑盒均購自上海索萊寶生物科技有限公司;CHOP/GADD153多克隆抗體、Bcl-2多克隆抗體、白細胞介素-1β(interleukin-1β,IL-1β)多克隆抗體、腫瘤壞死因子-α(tumor necrosis factor-α,TNF-α)單克隆抗體均購自美國Proteintech公司;抗兔IgG(H+L)購自美國Cell Signaling Technology公司;Bcl-2、CHOP均購自蘇州吉瑪基因股份有限公司;鈦顆粒購自美國Thermo Scientific公司;槲皮素購自上海索萊寶生物科技有限公司;RNA提取試劑盒、反轉錄試劑盒、熒光定量PCR試劑盒均購自康為世紀生物科技股份有限公司;PCR引物購自生工生物工程(上海)股份有限公司。
1.1.3 主要儀器 酶標儀(杭州奧盛儀器有限公司),流式細胞儀(美國Beckman Coulter Life Sciences公司),正置熒光顯微鏡(上海蔡康光學儀器有限公司),電泳儀(北京東方瑞利科技有限公司),7500定量實時PCR擴增儀(美國ABI公司)。
1.2 方法
1.2.1 細胞培養 44.5ml MEM細胞培養基+5ml胎牛血清+0.5ml雙抗,混勻。把細胞凍存管從液氮罐中快速取出,放置于一次性手套中,隔絕恒溫水浴鍋中的水,快速搖晃,在2min之內融化。取出一次性手套中的細胞凍存管,噴75%乙醇消毒后,放置在超凈工作臺中,用1ml移液器轉移凍存管中細胞到裝有培養基的15ml離心管,蓋上蓋子,用封口膜封口。用水平離心機4000r/min(離心半徑200mm),離心4min,離心結束后,15ml離心管外壁噴75%乙醇消毒后,放置于超凈工作臺中,棄去上清液,加入1ml新鮮培養基,吹勻,轉移至25T細胞培養瓶。用顯微鏡觀察細胞狀態和密度,細胞圓潤透亮,密度適中為合適。把25T細胞培養瓶噴75%乙醇消毒后,放置于37℃、5%CO2條件下培養備用。
1.2.2 MTT檢測不同濃度的鈦顆粒、槲皮素對成骨細胞的作用 MC3T3-E1細胞鋪96孔板,每個孔鋪200μl含6×103個細胞懸液,細胞密度為3×104個/ml。鋪板貼壁24h,使用濃度為0、100、200、400、600、800μmol/L鈦顆粒和濃度為0、3、6、12、25、50μmol/L槲皮素分別處理MC3T3-E1細胞24h,按不同分組處理換α-MEN培養基,每孔加入20μl 5mg/ml的MTT,37℃、5%CO?培養箱避光培養4h,小心吸棄孔內上清夜,每孔加入150μl DMSO,待結晶完全溶解后酶標儀490nm處檢測吸光度值。細胞存活率(%)=(各實驗組吸光度值–調零孔吸光度值)/(對照組吸光度值–調零孔吸光度值)×100%。
1.2.3 MTT檢測槲皮素對磨損顆粒誘導的成骨細胞的保護作用 MC3T3-E1細胞分別鋪96孔板,每個孔鋪200μl體系6×103個細胞懸液,細胞密度為3×104個/ml。鋪板貼壁24h,先使用槲皮素濃度為3、4、5、6μmol/L預處理細胞2h再加入600μmol/L鈦顆粒成骨細胞24h,MTT檢測細胞活性。
1.2.4 酶聯免疫吸附試驗(enzyme-linked immunoadsordent assay,ELISA)檢測槲皮素對鈦顆粒誘導的成骨細胞的IL-1β和TNF-α表達 使用5μmol/L的槲皮素預處理MC3T3-E1細胞2h,用600μmol/L的鈦顆粒處理24h。ELISA檢測各組上清液中IL-1β和TNF-α的表達水平。從室溫平衡20min后的鋁箔袋中取出所需板條,設置標準品孔和樣本孔,標準品孔各加不同濃度的標準品50μl,樣本孔中加入待測樣本50μl,空白孔不加,除空白孔外,標準品孔和樣本孔每孔加入辣根過氧化物酶(horseradish peroxidase,HRP)標記的檢測抗體100μl,用封板膜封住反應孔,37℃恒溫箱孵育60min。棄去液體,吸水紙上拍干,每孔加350μl洗滌液,靜置1min,甩去液體,吸水紙上拍干,如此重復5次。每孔加入底物A、B各50μl,37℃避光孵育15min。每孔加入終止液50μl,15min內,在450nm波長處測定各孔吸光度()值。
1.2.5 流式細胞術檢測槲皮素對鈦顆粒誘導的成骨細胞凋亡 MC3T3-E1細胞鋪100mm皿里,每個皿6000μl體系100×104個細胞懸液。鋪板貼壁24h,先使用槲皮素5μmol/L預處理細胞2h再加入上面600μmol/L鈦顆粒分別處理成骨細胞24h。細胞使用胰蛋白酶消化細胞離心,重懸,取100μl的細胞懸液于5ml流式管中,加入5μl Annexin V/FITC混勻后于室溫避光孵育5min,加入5μl的碘化丙錠溶液(propidium iodide,PI),并加400μl PBS,立刻進行流式或熒光顯微鏡檢測。空白管:陰性對照組細胞,不加Annexin V/FITC,PI溶液,用于調節電壓。單染管:陽性對照組細胞,只加Annexin V/FITC,用于調節補償。檢測管:處理的細胞,加Annexin V/FITC,PI溶液,用空白管和單染管調節好電壓補償后,獲得所需要的流式數據。
1.2.6 免疫熒光技術檢測槲皮素對鈦顆粒誘導的成骨細胞的CHOP、Bcl-2蛋白的表達 MC3T3-E1細胞鋪爬片,MC3T3-E1細胞鋪20×104個細胞。鋪板貼壁24h,先使用槲皮素5μmoL/L預處理細胞2h再加入上面600μmol/L鈦顆粒處理MC3T3-E1細胞24h。24h后,將細胞爬片取出,用PBS洗1~2次,甲醇固定10~15min,用PBS洗3次,每次5min,甩干用免疫熒光筆畫圈。放搖床上用羊血清封閉液封閉60min。孵一抗和二抗用(TBST)Tris Buffered saline Tween稀釋,將稀釋好的一抗加滴加到爬片上,4℃孵育過夜。次日放搖床上PBS洗3次,每次5min,孵二抗90min,放搖床上PBS洗3次,每次5min,避光孵4’,6-二脒基-2-苯基吲哚(4’,6-diamidino- 2-phenylindole,DAPI) 3~5min。
1.2.7 RT-PCR檢測槲皮素對鈦顆粒誘導的成骨細胞的CHOP和Bcl-2mRNA的表達收集各組細胞,提取總RNA。用反轉錄試劑盒反轉錄合成cDNA。根據PCR試劑盒說明書配制PCR擴增體系。將所獲得cDNA進行定量定時PCR,擴增條件:擴增條件:95℃預變性2min,95℃ 5s,56℃退火10s,60℃ 20s,共計40個循環。反應結束后通過溶解曲線評價擴增樣品的特異性與可靠性。GAPDH作為內參照,采用2–△△Ct法計算目的基因mRNA的表達情況。引物序列見表1。

表1 RT-PCR引物序列
1.3 統計學方法
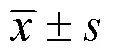
2 結果
2.1 鈦顆粒對成骨細胞活性的影響
鈦顆粒對成骨細胞的抑制濃度0、100、200、400、600、800μmol/L的鈦顆粒處理成骨細胞24h后,細胞存活率分別為96%、87%、76%、64%、49%、36%,與對照組比較,差異均有統計學意義(<0.05)。MC3T3-E1細胞在隨著鈦顆粒濃度增加時細胞平均存活率逐漸降低,鈦顆粒對MC3T3-E1細胞的生長有抑制作用,并且在鈦顆粒為600μmol/L時對細胞的抑制率接近50%,見圖1。
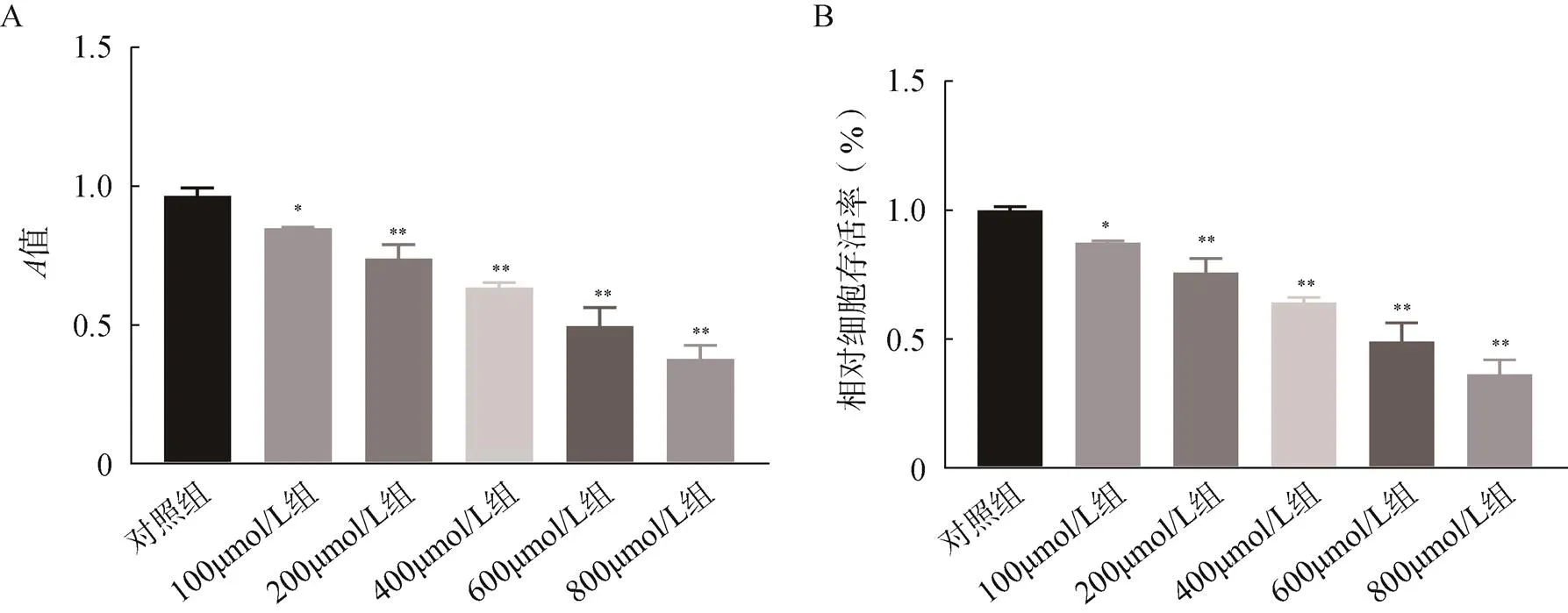
圖1 MTT法檢測鈦顆粒對成骨細胞存活率的影響
A.成骨細胞在不同濃度的鈦顆粒作用下值;B.成骨細胞在不同濃度的鈦顆粒作用下的存活率;與對照組比較,*<0.05,**<0.001
2.2 槲皮素干預對成骨細胞增殖活性的影響
MC3T3-E1細胞在槲皮素濃度為0、3、6、12、25、50μmol/L時細胞平均活率分別為99%、96%、93%、64%、48%、34%,與對照組比較,差異均有統計學意義(<0.05)。MC3T3-E1細胞在隨著槲皮素濃度逐漸升高時,細胞平均存活率呈遞減趨勢,只有在3~6μmoL/L時對細胞存活率無影響。高濃度的槲皮素對MC3T3-E1細胞的生長起到抑制作用,見圖2。
2.3 MTT法檢測槲皮素對磨損顆粒誘導的成骨細胞的保護作用
MC3T3-E1細胞在濃度為3~5μmol/L槲皮素預處理2h下再加600μmol/L鈦顆粒作用24h的細胞平均存活率隨槲皮素濃度的增加而逐漸升高。在5μmol/L槲皮素處理下,MC3T3-E1細胞存活率最高為99%,說明在此濃度下的槲皮素對MC3T3-E1細胞能有一定的保護作用,見圖3。
2.4 ELISA檢測槲皮素對鈦顆粒誘導的成骨細胞的IL-1β和TNF-α表達水平
ELISA檢測結果顯示,MC3T3-E1細胞對照組、槲皮素組、鈦顆粒組、槲皮素+鈦顆粒組的IL-1β的表達水平分別為33.75、33.38、40.73、36.57pg/ml,經鈦顆粒誘導的MC3T3-E1細胞IL-1β表達水平升高,而加槲皮素預處理后再加鈦顆粒誘導的MC3T3-E1細胞的IL-1β的表達水平較鈦顆粒組降低,差異均有統計學意義(<0.05)。對照組、槲皮素組、鈦顆粒組、槲皮素+鈦顆粒組的MC3T3-E1細胞的TNF-α的表達水平分別為156.44、153.65、186.81、168.22pg/ml,經鈦顆粒誘導的MC3T3-E1細胞TNF-α表達水平升高,而加槲皮素預處理后再加鈦顆粒的組別TNF-α表達水平較鈦顆粒組明顯下降,差異均有統計學意義(<0.05),見圖4。

圖2 MTT法檢測槲皮素對成骨細胞存活率的影響
A.成骨細胞在不同濃度的槲皮素作用下值;B.成骨細胞在不同濃度的槲皮素作用下的存活率;與對照組比較,*<0.001
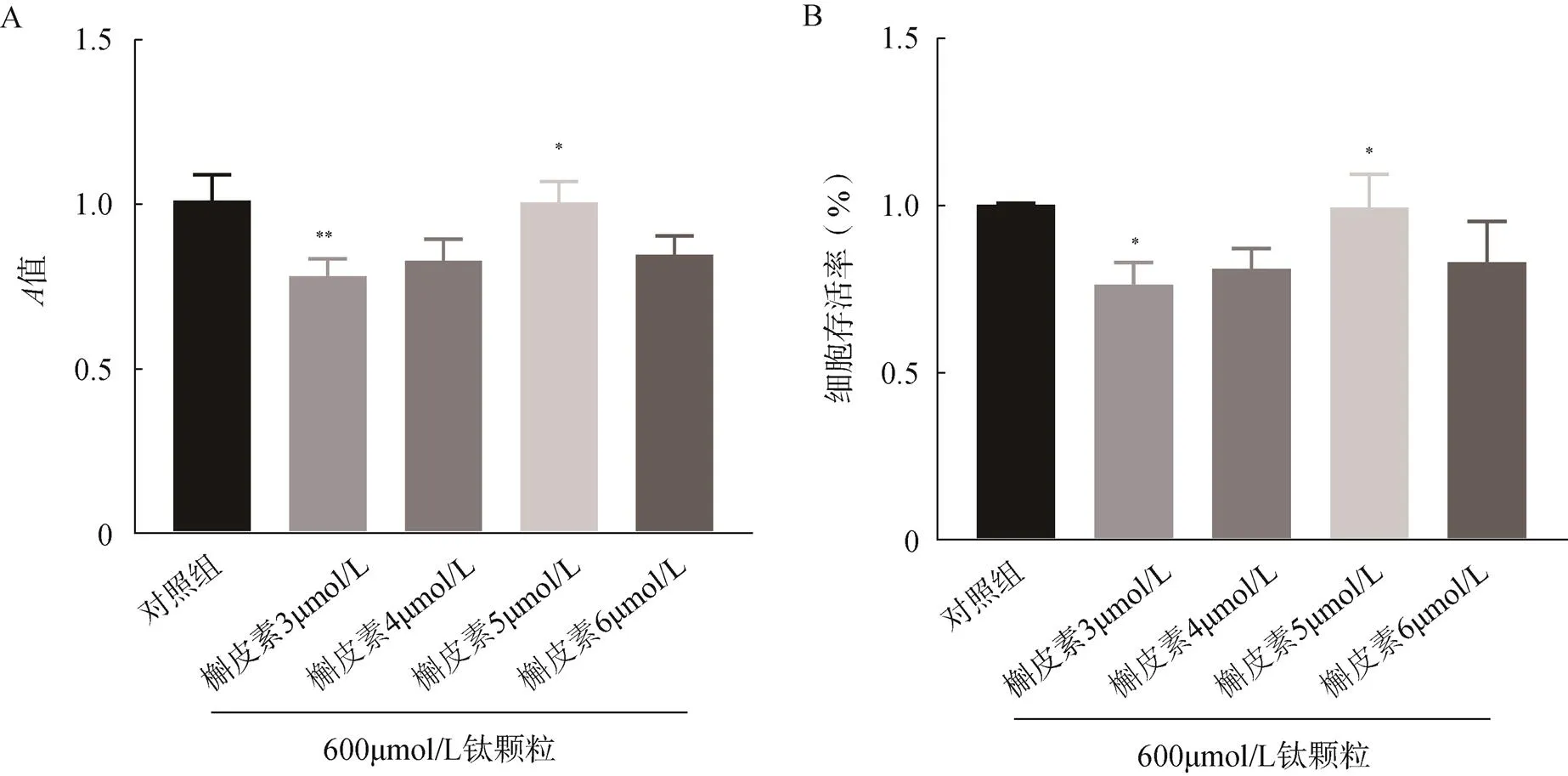
圖3 MTT法檢測槲皮素與鈦顆粒聯合對成骨細胞存活率的影響
A.成骨細胞在各組槲皮素與鈦顆粒聯合作用下值;B.成骨細胞在各組槲皮素與鈦顆粒聯合作用下的存活率;與對照組比較,*<0.05,**<0.01
圖4 槲皮素對鈦顆粒誘導的成骨細胞的IL-1β和TNF-α表達水平的影響
A.誘導的成骨細胞的IL-1β表達水平;B.誘導的成骨細胞的TNF-α表達水平;與對照組比較,*<0.05,**<0.01
2.5 流式細胞術檢測槲皮素對鈦顆粒誘導的成骨細胞凋亡
先用槲皮素預處理細胞2h,再加鈦顆粒作用24h,流式細胞術檢測對照組的MC3T3-E1細胞凋亡率為3.30%,槲皮素組的MC3T3-E1細胞凋亡率為3.24%,鈦顆粒組的MC3T3-E1細胞凋亡率為43.14%,槲皮素+鈦顆粒組的MC3T3-E1細胞凋亡率為20.40%,差異均有統計學意義(<0.05)。鈦顆粒促進了MC3T3-E1細胞凋亡,槲皮素+鈦顆粒明顯降低了MC3T3-E1細胞的凋亡率,說明槲皮素對MC3T3-E1細胞起到一定的保護作用,見圖5。
2.6 免疫熒光技術檢測槲皮素對鈦顆粒誘導的成骨細胞的CHOP、Bcl-2的表達水平
CHOP在對照組和槲皮素組都有熒光表達,熒光主要是在細胞質中表達,且熒光強度弱,呈弱陽性表達。鈦顆粒組的CHOP在核質都表達,熒光強度最強,呈強陽性表達。槲皮素+鈦顆粒組的CHOP表達位置在核質,但主要是在質中,熒光呈陽性表達。Bcl-2在對照組、槲皮素組和槲皮素+鈦顆粒組里熒光都呈弱陽性表達,在對照組表達位置主要是在細胞質中,槲皮素組和槲皮素+鈦顆粒組里在細胞核、細胞質都有表達。鈦顆粒處理的MC3T3-E1細胞的Bcl-2在細胞核、細胞質都表達,呈強陽性表達,見圖6、圖7。

圖5 流式細胞術檢測槲皮素對鈦顆粒誘導的成骨細胞凋亡的影響
A.流式細胞圖;B.細胞凋亡率;與對照組比較,*<0.001
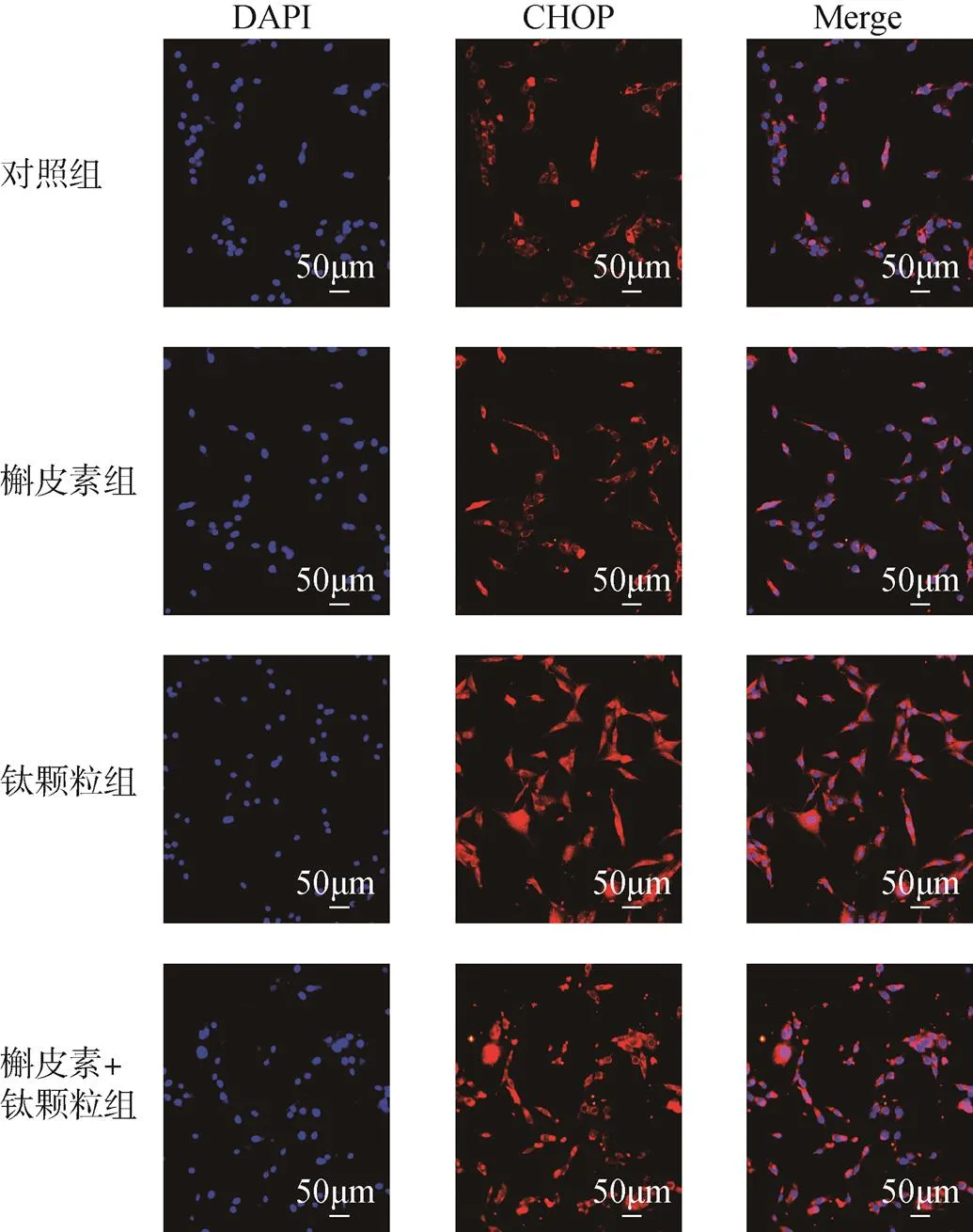
圖6 免疫熒光技術檢測槲皮素對鈦顆粒誘導的成骨細胞的CHOP表達
2.7 PCR檢測槲皮素對鈦顆粒誘導的成骨細胞的CHOP和Bcl-2的mRNA的表達
在成骨細胞中,相較于對照組,槲皮素誘導下CHOP的mRNA表達差異無統計學意義,但鈦顆粒組、槲皮素+磨損顆粒組中CHOP的mRNA表達升高,差異均有統計學意義(<0.05);槲皮素+磨損顆粒組的CHOP相對于鈦顆粒組蛋白表達有所降低。在成骨細胞中,相較于對照組,Bcl-2的mRNA在槲皮素、鈦顆粒、槲皮素+鈦顆粒誘導下升高,差異均有統計學意義(<0.05);槲皮素+磨損顆粒組的Bcl-2的mRNA相對于鈦顆粒組蛋白表達有所降低,見圖8。

圖7 免疫熒光技術檢測槲皮素對鈦顆粒誘導的成骨細胞的Bcl-2表達
3 討論
人工關節置換術是一種廣泛應用于晚期關節炎的終極治療方法,可以有效地減輕患者的疼痛癥狀,恢復關節活動度,并讓患者早期回歸到正常的生活當中。然而,人工關節置換術的廣泛應用使得外科醫生又面臨一種新的挑戰,即如何應對假體周圍骨溶解所引起的假體無菌性松動。目前很少有研究將重點放在假體周圍骨溶解中成骨細胞增殖活性受抑制和成骨細胞凋亡的環節上,對于上述環節具有保護作用的藥物及其機制的報道并不多。因此,理論上能有特效藥物解決長期困擾關節外科磨損顆粒導致的人工關節置換術后骨溶解與假體松動的頑疾,必將為人工關節置換患者帶來福音。近年來,有在實驗中觀察到磨損微粒對成骨細胞的抑制作用,本實驗研究結果與其相符[5]。鈦合金是目前骨科常用的假體材料,雖然其價格相對其他材質較貴,但鈦合金具有良好的組織相容性且無明顯的不良反應,其缺點是耐磨性差,因此,在假體周圍組織中鈦顆粒的含量也相對較高,本實驗選用純鈦顆粒作為磨損顆粒,主要原因是鈦的純度和顆粒大小都能符合實驗要求[6]。槲皮素及其衍生物已被作為天然抗氧化劑用于心血管疾病、骨質疏松性疾病、腫瘤和糖尿病等方面的治療[7]。國內外對其研究日益增多,槲皮素具有抗過敏、抗炎癥、抗氧化、抗病毒等作用[8-9]。研究證實,槲皮素能緩解甲基乙二醛誘導的成骨細胞凋亡,其作用機制可能與調控阻斷Wnt通路,影響成骨細胞增殖分化有關[10]。但是目前還沒有使用槲皮素對假體磨損松動治療的研究。本研究發現,鈦顆粒引起的成骨細胞增殖活性下降及細胞凋亡率的增高,而槲皮素對鈦顆粒誘導成骨細胞凋亡有明顯抑制作用。
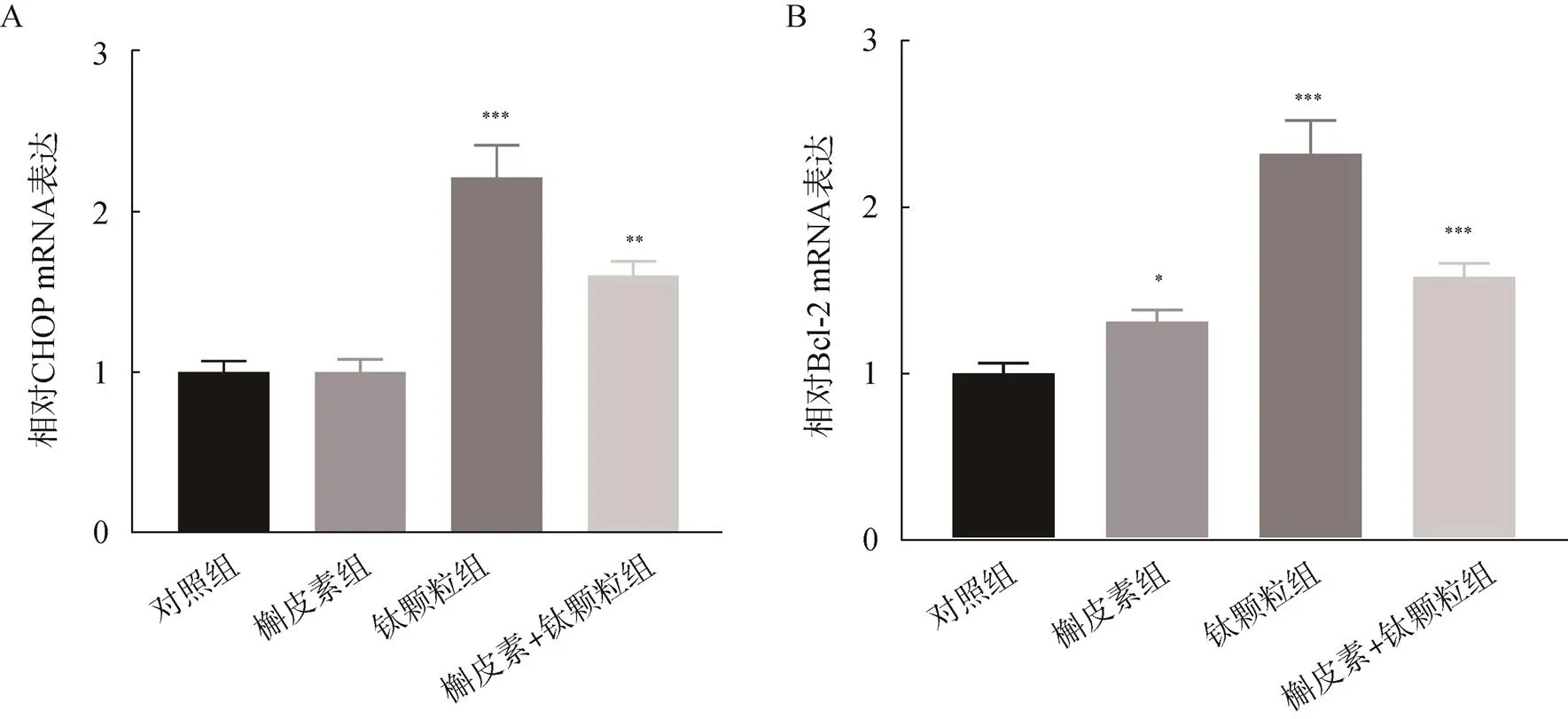
圖8 PCR檢測槲皮素對鈦顆粒誘導的成骨細胞CHOP和Bcl-2的mRNA表達
A.誘導的成骨細胞CHOP的mRNA表達情況;B.誘導的成骨細胞Bcl-2的mRNA表達情況;與對照組比較,*<0.05,**<0.01,***<0.001
磨損顆粒導致的假體周圍骨溶解及假體松動的發生是一個復雜的過程。關節活動產生的磨損顆粒會刺激局部組織產生無菌性炎癥,在假體周圍形成界膜組織,導致成纖維細胞和巨噬細胞等炎癥細胞增生、浸潤并釋放大量的炎癥因子,進而產生更多的炎癥細胞浸潤,同時也活化破骨細胞,引發局部發生骨溶解和骨吸收,最后導致假體松動。因此,TNF-α是磨損顆粒誘導骨溶解的發生過程中的關鍵因子,其能直接與破骨前提細胞表面的腫瘤壞死因子受體(tumor necrosis factor receptor,TNFR)結合,促進破骨細胞的生成和活化;同時TNF-α還能促進其自身以及IL-1β的生成[11]。因此,通過各種方法抑制TNF-α的水平,以及被認為是治療磨損顆粒誘導假體周圍溶解的有效方法之一[12]。通過槲皮素的抗炎癥、抗氧化等功能,本實驗證實了槲皮素能抑制TNF-α和IL-1β水平,能顯著抑制炎癥的產生和發展,抑制磨損顆粒導致的骨溶解的作用,具有高效、特異等顯著的優勢。
研究表明,磨損顆粒誘導的慢性炎癥與細胞凋亡存在一定的關系[12]。細胞凋亡又稱作細胞程序性死亡,細胞受到凋亡誘導因素的作用后,經信號轉導系統的傳遞而激活凋亡基因。其中Wnt/β-Catenin、調控核因子κB(nuclear factor-κB,NF-κB)等信號通路,Bcl-2家族蛋白表達以及逆轉表觀遺傳學修飾等途徑在誘導細胞凋亡中起到關鍵作用[13-14]。細胞凋亡過程中沒有溶酶體和包膜破裂,內涵物不外泄,不引起炎癥反應及繼發性損害,可有效限制炎癥保護機體。但當嚴重損害時,細胞內外環境發生極度紊亂,細胞凋亡出現嚴重異常,可引起凋亡過快,凋亡比例過多或清除障礙,進而產生機體組織炎癥損害。研究發現,細胞凋亡與磨損顆粒種類有關,在含金屬顆粒的介膜組織中細胞凋亡率最高,其次為超高分子聚乙烯顆粒及陶瓷顆粒[15]。因此,本實驗選擇鈦顆粒金屬作為磨損顆粒具有代表性,保證了實驗的齊同性和有效性。死亡受體活化和線粒體損傷途徑是細胞內兩條經典的凋亡途徑[16]。而ERS啟動的細胞凋亡途徑是近年才發現的一種新的凋亡途徑[17]。內質網是真核細胞中蛋白質合成、折疊與分泌的重要細胞器。當機體細胞受到缺氧、饑餓、鈣代謝紊亂、自由基侵襲及藥物等應激原的刺激時,內質網腔內未折疊蛋白增多或鈣失衡,可引發ERS,細胞對ERS會產生未疊蛋白反應(unfoled protein response,UPR)來降低蛋白質的合成,促進蛋白質的正確折疊,相關的轉錄因子有RNA依賴的蛋白激酶樣內質網激酶(PKR-like ER kinase,PERK)、肌醇激酶1(inositol-requiring kinase1,IRE1)和活化轉錄因子6(activating transcription factor6,ATF6)[18]。當應激過強時,UPR可激活CHOP引起細胞的凋亡,發生不可逆的損傷。CHOP是ERS誘導多種細胞產生凋亡的關鍵信號分子,過表達CHOP能夠誘發細胞的凋亡[19]。國外也有研究發現,槲皮素能抑制ERS凋亡途徑[20]。本研究發現,鈦顆粒能夠抑制成骨細胞增殖活性,并且呈濃度依賴性。此外,流式細胞術檢測結果顯示,鈦顆粒能夠誘導成骨細胞凋亡。本研究免疫熒光技術和PCR檢測結果均顯示,相對于鈦顆粒組,槲皮素+磨損顆粒組的CHOP蛋白表達有所降低,說明ERS啟動途徑受到抑制。槲皮素在轉錄和蛋白水平均可抑制鈦顆粒誘導的CHOP表達上調,保護成骨細胞免受ERS誘導的凋亡。研究還發現,當外界信號啟動ERS途徑,發生由ERS所介導的凋亡信號通路時,通過CHOP調控下游的凋亡信號,如Bcl-2家族蛋白等,可以調節腫瘤細胞凋亡[21]。因此,阻斷CHOP介導的系膜細胞凋亡,從而逆轉ERS誘導的成骨細胞凋亡進展將是治療的潛在靶點之一。Pang等[22]研究發現,槲皮素通過與內質網相互作用刺激骨形成蛋白信號轉導,從而發揮抗ERS的生物學效應。本實驗觀察到調控細胞凋亡的CHOP及其下游促凋亡信號的活性明顯增高,導致系膜細胞凋亡率明顯增加,而給予槲皮素干預后系膜細胞ERS得到抑制,CHOP及其下游促凋亡信號明顯減弱,細胞凋亡率明顯下降。因此,適量濃度槲皮素干預后顯著恢復了鈦顆粒抑制的成骨細胞增殖活性,本實驗證實,濃度5μmol/L槲皮素對成骨細胞有很好的保護作用。因此,適當濃度的槲皮素可促進成骨的活性,可能有利于假體與骨的牢固整合及長期穩定。
綜上所述,本研究結果顯示,適量濃度槲皮素能抑制鈦顆粒誘導的成骨細胞凋亡,其作用機制可能與內質網應激啟動的凋亡途徑抑制,調控CHOP、Bcl-2蛋白表達的信號通路有關。但本研究為單純體外實驗,需進一步研究證實,從而為臨床應用提供理論基礎。
[1] YANG G, TANG K, QIAO L. Identification of critical genes and lncrnas in osteolysis after total hip arthroplasty and osteoarthritis by RNA sequencing[J]. Biomed Res Int, 2021, 2021: 2314–2327.
[2] 馬子雨, 張賓, 張云濤, 等. 槲皮素緩釋系統對MC3T3-E1細胞成骨性能的影響[J]. 中國組織工程研究, 2023, 27(12): 1870–1876.
[3] 脫淑梅, 李瑞瑞, 李娟, 等. 槲皮素通過內質網應激誘導宮頸癌細胞凋亡的機制[J]. 甘肅醫藥, 2022, 41(9): 769–773.
[4] 林綿輝, 史玉朋, 王磊, 等. 鈦顆粒對成骨細胞增殖分化及細胞形態的影響[J]. 中國修復重建外科雜志, 2014, 28(5): 581–585.
[5] 戴閔, 周通華, 熊皞, 等. 金屬離子對成骨細胞凋亡、細胞周期分布及ALP分泌的影響[J]. 中國修復重建外科雜志, 2011, 25(1): 56–60.
[6] 陳德勝, 李燕, 郭鳳英, 等. 鈦顆粒刺激小鼠顱骨誘導骨溶解的動物模型建立[J]. 寧夏醫學雜志, 2018, 40(8): 677–680.
[7] HONG Y, LEE J, MOON H, et al. Quercetin induces anticancer activity by upregulating pro-NAG-1/GDF15 in differentiated thyroid cancer cells[J]. Cancers (Basel), 2021, 13(12): 2027–2041.
[8] GUO H, DING H, TANG X, et al. Quercetin induces pro-apoptotic autophagy via SIRT1/AMPK signaling pathway in human lung cancer cell lines A549 and H1299 in vitro[J]. Thorac Cancer, 2021, 12(9): 1415–1422.
[9] FANUNZA E, IAMPIETRO M, DISTINTO S, et al. Quercetin blocks ebola virus infection by counteracting the VP24 interferon-inhibitory function[J]. Antimicrob Agents Chemother, 2020, 64(7): 1098–1112.
[10] 金杯, 戴盼盼, 孫旺, 等. 槲皮素對甲基乙二醛誘導的成骨細胞凋亡保護作用研究[J]. 浙江醫學, 2020, 42(18): 1914–1920.
[11] CONNORS JP, STELZER JW, GARVIN PM, et al. The role of the innate immune system in wear debris-induced inflammatory peri-implant osteolysis in total joint arthroplasty[J]. Bioengineering (Basel), 2022, 9(12): 2306–2320.
[12] Yang C, Liu W, Shan H, et al. Naringin inhibits titanium particles-induced up-regulation of TNF-α and IL-6 via the p38 MAPK pathway in fibroblasts from hip periprosthetic membrane[J]. Connect Tissue Res, 2021, 62(5): 485–494.
[13] WEI J, ZHANG X, LI Y, et al. Novel application of bergapten and quercetin with anti-bacterial, osteogenesis- potentiating, and anti-inflammation tri-effects[J]. Acta Biochim Biophys Sin, 2021, 53(6): 683–696.
[14] ZENG Y, NIKITKOVA A, ABDELSALAM H, et al. Activity of quercetin and kaemferol against Streptococcus mutans biofilm[J]. Arch Oral Biol, 2019, 98: 9–16.
[15] 劉子歌, 張晨, 宋國瑞, 等. 磨損顆粒在人工關節置換術后無菌性松動中的作用機制及其影響因素[J]. 中國骨科臨床與基礎研究雜志, 2020, 12(3): 177–184.
[16] 李帥, 張炳東. 細胞凋亡途徑的研究進展[J]. 山東醫藥, 2017, 57(37): 103–106.
[17] 任慧敏, 韓樹池, 薛乾隆, 等. 內質網應激在吸煙COPD模型小鼠膈肌細胞凋亡中的作用及機制研究[J].中國免疫學雜志, 2023, 39: 22–33.
[18] YAO Y, LU Q, HU Z, et al. A non-canonical pathway regulates ER stress signaling and blocks ER stress-induced apoptosis and heart failure[J]. Nat Commun, 2017, 8(1): 133–148.
[19] 劉紅, 王增四, 高文, 等. 黃芪甲苷對STZ誘導的糖尿病大鼠腎組織內質網應激及CHOP信號通道的影響[J]. 中國醫院藥學雜志, 2021, 41(13): 1318–1322.
[20] Eisvand F, Tajbakhsh A, Seidel V, et al. Quercetin and its role in modulating endoplasmic reticulum stress: a review[J]. Phytother Res, 2022, 36(1): 73–84.
[21] 徐成波, 鄭瑞璣, 廖斌, 等. 雷公藤內酯醇通過CHOP/BCL-2內質網應激途徑誘導人多發性骨髓瘤細胞凋亡[J]. 中國病理生理雜志, 2022, 38(7): 1274–1282.
[22] PANG X, CONG Y, BAO N, et al. Quercetin stimulates bone marrow mesenchymal stem cell differentiation through an estrogen receptor mediated pathway[J]. Biomed Res Int, 2018, 2018: 2314–2325.
Inhibitory effect of quercetin on titanium particles induced apoptosis in osteoblasts
Department of Orthopedics, the First Hospital of Jiaxing in Zhejiang Province, Jiaxing 314000, Zhejiang, China
To explore the inhibitory effect of quercetin on titanium particles induced apoptosis in osteoblasts.Mouse MC3T3-E1 cell line was treated with titanium particles to construct apoptosis model, quercetin was applied to intervene and control group was set up. Cell proliferation activity was detected by 3-(4,5)-dimethylthiahiazo (-z-y1)-3,5-di- phenytetrazoliumromide assays (MTT), the apoptosis was analyzed by flow cytometry. The expression levels of interleukin-1β (IL-1β) and tumor necrosis factor-α (TNF-α) were detected by enzyme-linked immunoadsordent assay (ELISA). Immunofluorescence technology was used to detect the expression of C/EBP homologous protein (CHOP) and B-cell lymphoma-2 (Bcl-2) protein.The protein expression levels of CHOP and Bcl-2 mRNA expression were detected by real-time polymerase chain reaction(RT-PCR).Titanium particlesl inhibited osteoblast proliferation in a dose dependent manner. Flow cytometric showed that titanium particles induced osteoblast apoptosis. Quercetin pre-culture can effectively relieve the inhibition of titanium particles on the proliferation of osteoblasts and reduce their apoptosis. ELISA results showed that quercetin could reduce the expression of IL-1β and TNF-α. Immunofluorescence technology showed that quercetin is involved in regulating the expression of CHOP and Bcl-2 proteins, and RT-PCR detection results showed that quercetin is involved in regulating the mRNA expression of CHOP and Bcl-2.Quercetin can inhibit the apoptosis of osteoblasts induced by titanium particles, and which may be related to the inhibition of apoptosis pathway initiated by endoplasmic reticulum stress and the signal pathway that regulates the expression of CHOP and Bcl-2 protein.
Quercetin; Osteoblasts; Apoptosis; Titanium particles
R332
A
10.3969/j.issn.1673-9701.2023.29.011
浙江省嘉興市科技計劃項目(2020AD30076)
蔣毅,電子信箱:jiangyi0573@163.com
(2023–03–26)
(2023–09–14)

