微小RNA-127-3p對乳頭狀甲狀腺癌細胞增殖、侵襲及遷移的影響
吳文金, 劉 洋, 王濟國, 鐘安娜
[寶安中醫院(集團), 1.檢驗科, 2.腫瘤科, 廣東 深圳, 518133;3. 廣東省深圳市寶安區婦幼保健院, 廣東 深圳, 518133]
盡管多數乳頭狀甲狀腺癌患者經過綜合治療后預后良好,但仍有部分患者出現遠處轉移。微小RNA在腫瘤復發中扮演著重要角色[1-2]。研究[3]表明,宮頸癌組織微小RNA-127-3p(miR-127-3p)表達降低,可抑制宮頸癌細胞惡性生物學行為。miR-127-3p過表達可抑制黑色素瘤細胞的增殖、侵襲及轉移,誘導腫瘤細胞凋亡[4]。但miR-127-3p與甲狀腺癌惡性表型的關系無文獻報告。腫瘤細胞侵襲抑制因子(SCAI)在腫瘤組織中異常表達,參與調控腫瘤的惡性表型[5-7], 但SCAI與乳頭狀甲狀腺癌的關系尚不清楚。研究[7-8]顯示, SCAI與多種微小RNA存在靶向關系,參與調控腫瘤的惡性表型。但miR-127-3p與SCAI的關系未知。本研究分析miR-127-3p對乳頭狀甲狀腺癌惡性表型的影響及其作用機制。
1 材料與方法
1.1 主要試劑、細胞株及儀器
選取乳頭狀甲狀腺癌細胞TPC1、正常人甲狀腺細胞Nthy-ori 3-1(本實驗保存)。主要試劑和儀器主要包括: 引物、miR-127-3p 過表達載體(mimics)、miR-NC(miR-127-3p過表達的空載體)、對照質粒、si-NC、si-SCAI、突變型(MUT)-SCAI、野生型(WT)-SCAI(廣州云舟生物科技股份有限公司); 鼠抗人SCAI、β-actin、羊抗鼠二抗(沈陽萬類康生物有限公司); RNA提取、聚合酶鏈反應(PCR)試劑盒,轉染試劑盒(廣州云舟生物科技股份有限公司); 氯化丙定(PI)(廣州云舟生物科技股份有限公司); 熒光素酶檢測試劑盒(大連醫友生物有限公司); 噻唑藍(MTT, 大連醫友生物有限公司); Transwell小室(Corning,美國); 酶標儀(杭州奧盛儀器有限公司); PCR儀(杭州奧盛儀器有限公司)。
1.2 細胞培養、轉染及分組
利用完全DMEM培養基培養細胞,培養箱條件設置為37 ℃、5%CO2, 隔日傳代、換液。取生長良好的TPC1細胞,將質粒及Lip 2000一起加入到細胞培養基中進行轉染,分為空白組(NC組,無處理)、miR-NC組(轉染miR-127-3p過表達的空載體)、miR-127-3p組(轉染miR-127-3p-mimics)、si-NC組(轉染 SCAI 敲低空載體)和si-SCAI組(轉染si-SCAI)。
1.3 實時熒光定量PCR檢測miR-127-3p、SCAI mRNA水平
取對數生長期的細胞,利用Trizol提取總RNA, 檢測濃度,逆轉錄cDNA: 10 mmol/L dNTP1.5 μL, 5×PCR buffer 5 μL, 反轉錄酶1 μL, DEPC水2.5 μL, 總體積25 μL。然后采用PCR擴增,引物序列見表1。反應體系: SYBR? Premix Ex TaqTM(2×)12.5 μL+上下游引物(10 μmol/L) 1 μL, 加DEPC水,總體積為25 μL。反應參數: 95 ℃ 1 min、90 ℃ 20 s、50 ℃ 15 s, 共40個循環。2-△△Ct法表示表達量。內參為U6、GAPDH。所有實驗均重復3次。

表1 目標引物序列
1.4 MTT實驗
將細胞接種于96孔板,培養箱繼續培養,分別于0、48、72、96 h檢測細胞活力,檢測前加入20 μL MTT, 培養4 h, 然后加入150 μL DMSO, 水平搖床搖動30 min,上機檢測光密度(OD)值。每組5個復孔。
1.5 Transwell小室實驗
遷移實驗: 上室中加入1×105個細胞,用無血清培養基配制,下室加入含20%血清培養基, 48 h后去除上室未穿細胞,用4%多聚甲醛固定, 0.1%結晶紫染色,洗滌,計數。侵襲實驗: 首先用DMEM培養基按照1∶8稀釋基質膠,上室中加40 μL基質膠,其余同上。所有實驗均重復3次。
1.6 Western blot法檢測SCAI蛋白的表達
去除培養基,加入裂解液提取總蛋白。配制3%膠,點樣, SDS-PAGE電泳2 h將蛋白轉移至膜上, 5%脫脂奶粉封閉1 h, 加入SCAI(1∶1 000)、β-actin(1∶1 000)抗體冰箱過夜,次日加入二抗(1∶1 000), 室溫1 h, 洗滌3次后上機曝光, Image J軟件分析光密度。所有實驗均重復3次。
1.7 熒光素酶實驗驗證miR-127-3p與SCAI的靶向關系
分別將MUT-SCAI、WT-SCAI質粒分別轉入NC組和miR-127-3p組, 48 h后檢測各組細胞熒光活性。所有實驗均重復3次。
1.8 統計學方法
2 結 果
2.1 乳頭狀甲狀腺癌細胞、正常人甲狀腺細胞中的miR-127-3p表達
TPC1細胞中的miR-127-3p表達水平低于Nthy-ori 3-1細胞,差異有統計學意義(P<0.01)。見圖1。
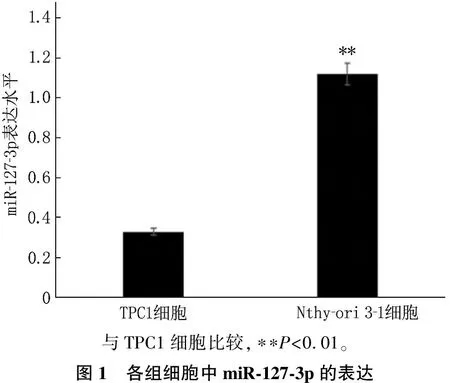
與TPC1細胞比較,??P<0.01。圖1 各組細胞中miR-127-3p的表達
2.2 乳頭狀甲狀腺癌細胞及正常甲狀腺細胞中SCAI蛋白、SCAI mRNA表達
TPC1細胞中SCAI蛋白、SCAImRNA表達均低于Nthy-ori 3-1細胞,差異有統計學意義(P<0.01)。見圖2。
2.3 miR-127-3p過表達對TPC1細胞增殖、遷移和侵襲的影響
miR-127-3p組細胞中的miR-127-3p表達水平高于NC組、miR-NC組,差異有統計學意義(P<0.05), 但NC組、miR-NC組的表達水平差異無統計學意義(P>0.05)。miR-127-3p組48、72 h 細胞OD值、遷移和侵襲細胞數量低于NC組、miR-NC組,差異有統計學意義(P<0.05); NC組、miR-NC組的細胞活力、細胞遷移和細胞侵襲數量比較,差異無統計學意義(P>0.05)。見圖3。
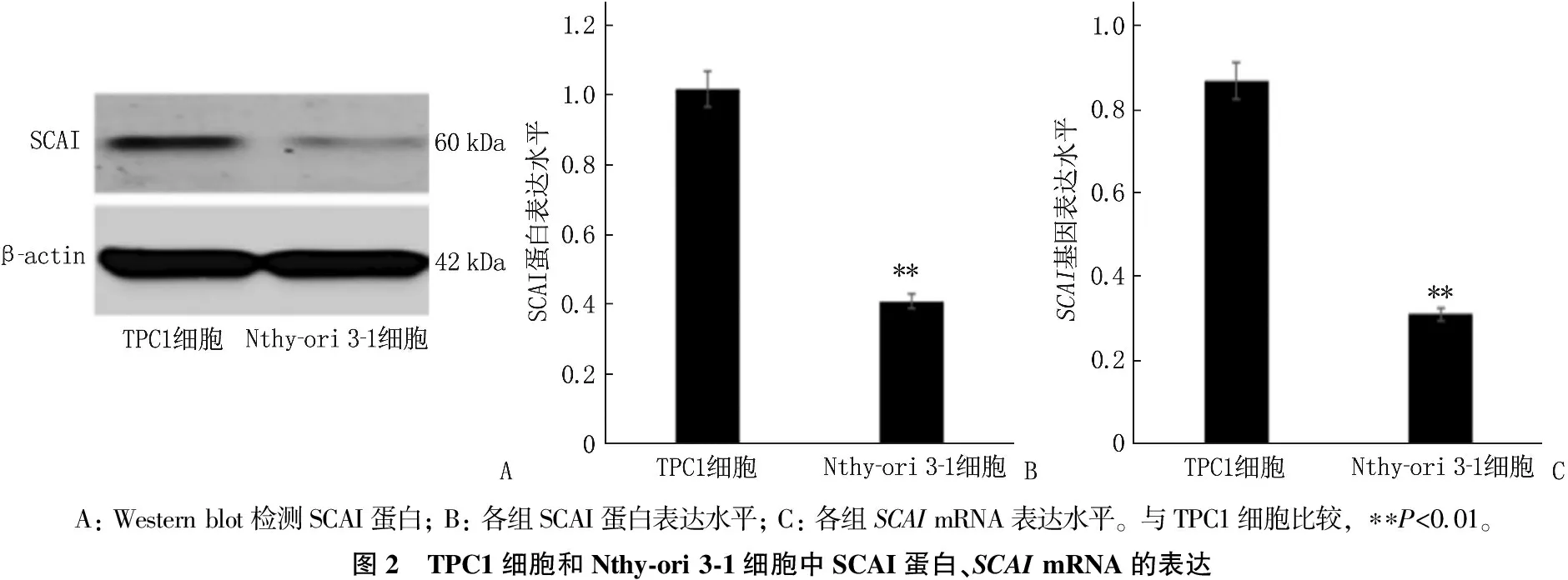
A: Western blot檢測SCAI蛋白; B: 各組SCAI蛋白表達水平; C: 各組SCAI mRNA表達水平。與TPC1細胞比較, ??P<0.01。圖2 TPC1細胞和Nthy-ori 3-1細胞中SCAI蛋白、SCAI mRNA的表達
2.4 抑制SCAI表達對TPC1細胞增殖、遷移和侵襲的影響
si-SCAI組細胞中SCAI蛋白及SCAImRNA水平低于NC組、si-NC 組,差異有統計學意義(P<0.05), 但NC組、miR-NC組細胞中SCAI蛋白及SCAImRNA水平比較,差異無統計學意義(P>0.05)。si-SCAI組48、72 h細胞OD值、遷移和侵襲細胞數量高于NC組、si-NC組,差異有統計學意義(P<0.05)。見圖4。
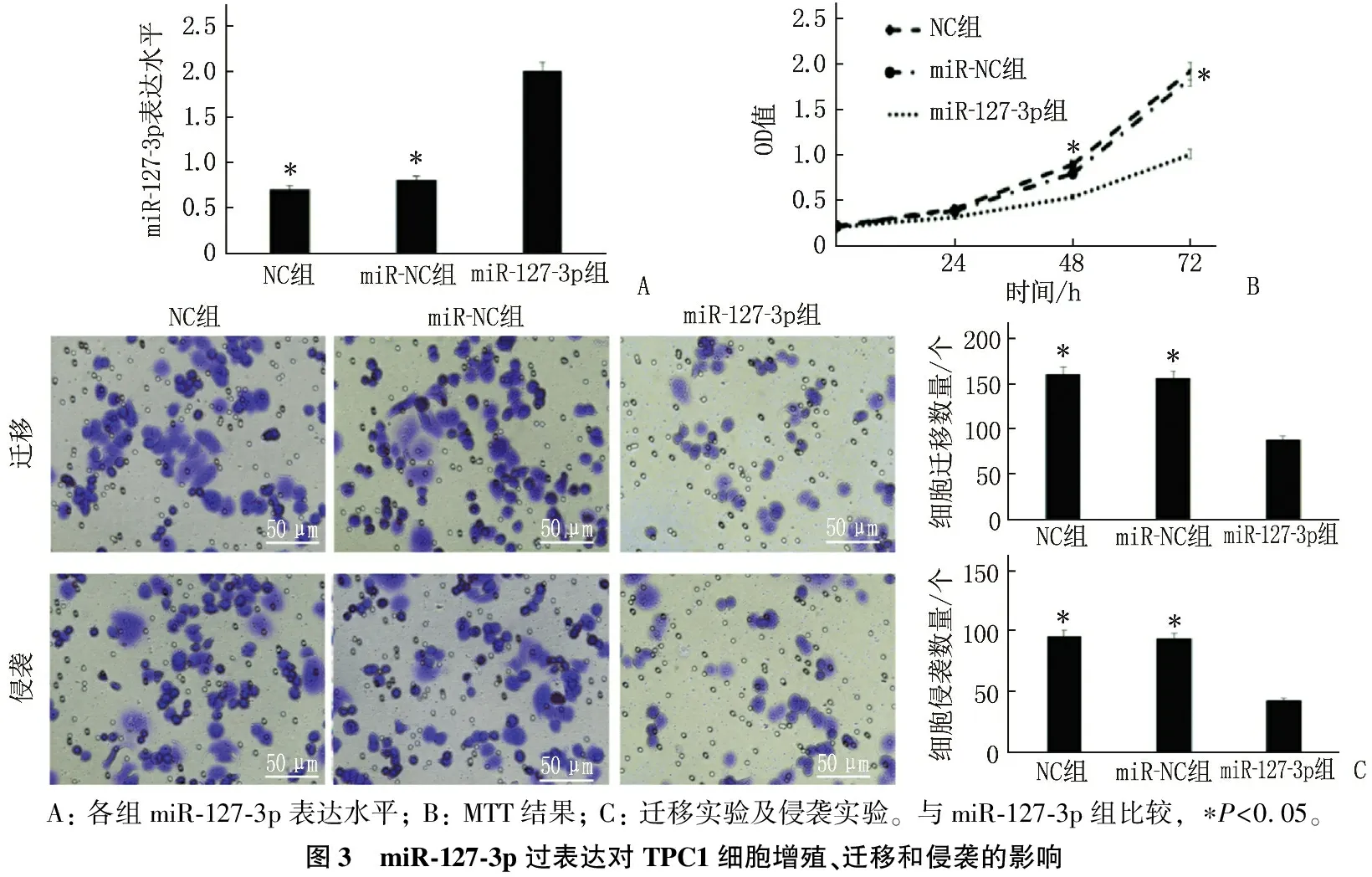
A: 各組miR-127-3p表達水平; B: MTT結果; C: 遷移實驗及侵襲實驗。與miR-127-3p組比較, ?P<0.05。圖3 miR-127-3p過表達對TPC1細胞增殖、遷移和侵襲的影響
2.5 各組細胞SCAI蛋白表達
miR-127-3p組SCAI蛋白表達水平高于NC組、miR-NC組,差異有統計學意義(P<0.05)。見圖5。
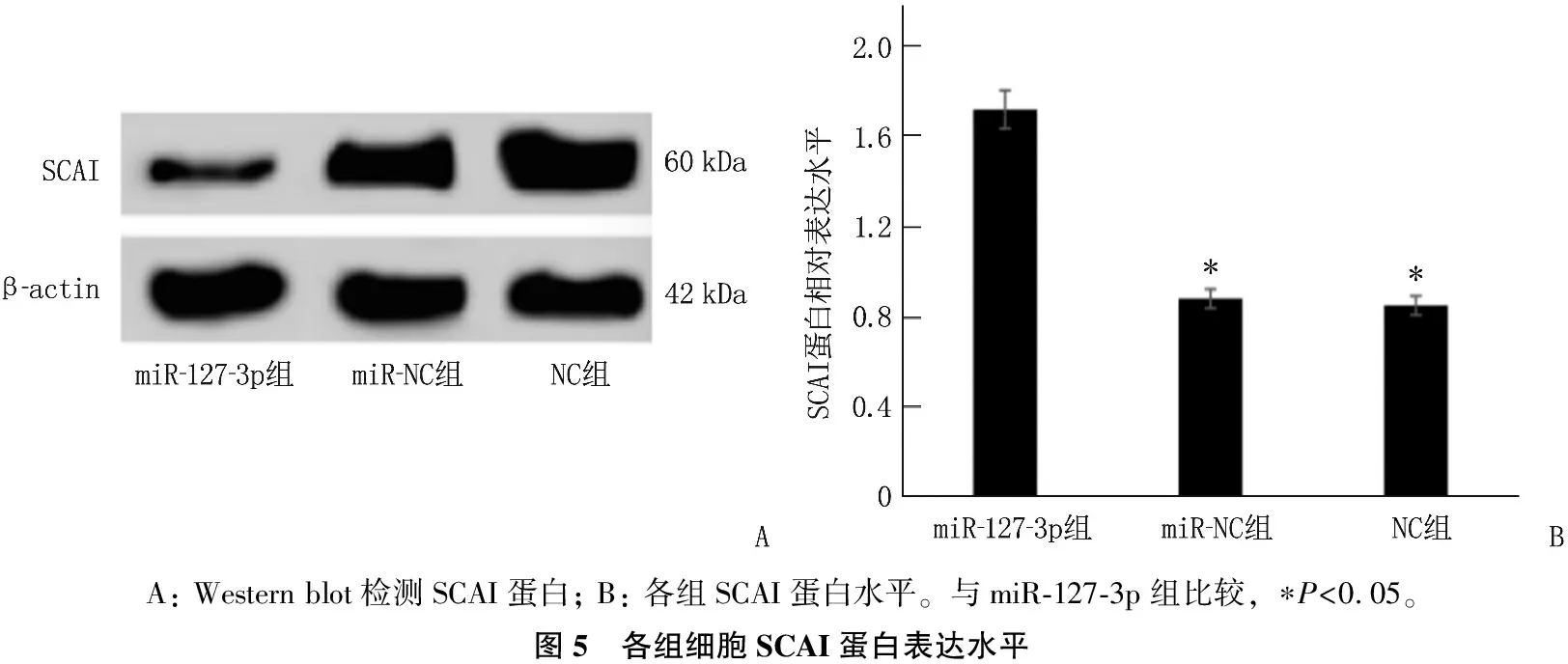
A: Western blot檢測SCAI蛋白; B: 各組SCAI蛋白水平。與miR-127-3p組比較, ?P<0.05。圖5 各組細胞SCAI蛋白表達水平
2.6 miR-127-3p與SCAI的靶向關系
生物信息分析顯示, miR-127-3p與SCAI存在互補堿基。轉載WT-SCAI的 miR-127-3p組細胞熒光素酶活性高于轉載WT-SCAI的NC組細胞,差異有統計學意義(P<0.05)。見圖6。
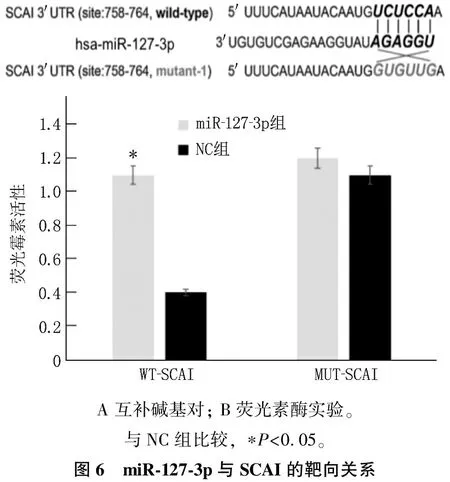
A 互補堿基對; B熒光素酶實驗。與NC組比較, ?P<0.05。圖6 miR-127-3p與SCAI的靶向關系
3 討 論
大量文獻[9-12]報道,微小RNA在乳頭狀甲狀腺癌進展中發揮重要作用。miR-127-3p在多種腫瘤組織中高表達。研究[13]表明,下調miR-127-3p能抑制肝癌進展。miR-127-3p可抑制黑色素瘤細胞的惡性行為,促進凋亡[14]。研究[15]發現,卵巢癌患者血清miR-127-3p與臨床病理特征有關。本研究結果顯示,乳頭狀甲狀腺癌細胞中miR-127-3p呈低表達,提示miR-127-3p可能是乳頭狀甲狀腺癌的抑癌基因。為了進一步研究miR-127-3p在乳頭狀甲狀腺癌發生、發展中的作用,本研究構建了miR-127-3p過表達乳頭狀甲狀腺癌細胞,并分析了其對腫瘤細胞惡性表型的影響。結果顯示, miR-127-3p過表達的細胞增殖、侵襲及遷移能力顯著降低。研究[16-20]發現, miR-127在前列腺癌、膀胱癌及結腸癌組織中呈低表達,機制可能是miR-127啟動子區域的異常甲基化,通過去甲基化藥物激活miR-127表達,并抑制其靶標 B細胞淋巴瘤細胞6(Bcl-6)抑制腫瘤發生。
miR-127-3p靶向多個基因行使其功能,如miR-127-3p可通過靶向MAPK4抑制卵巢癌腫瘤的生長[21]。另外, miR-127-3p可通過Wnt/β-catenin信號通路抑制腫瘤細胞的增殖[22]。SCAI是一種抑癌基因,參與腫瘤細胞的惡性生物學行為。另外,在多種腫瘤中SCAI可被多種微小RNA抑制[23-24]。本研究結果顯示,乳頭狀甲狀腺癌細胞中SCAI呈高表達,抑制SCAI后增強了細胞惡性生物學行為,提示SCAI與腫瘤進展有關。許娟秀等[25]研究發現, miR-135a可靶向SCAI抑制宮頸癌糖酵解。研究[26]發現,在肝癌細胞中SCAI可作為miR-425-5p的靶基因,當其被miR-425-5p抑制后可以促進肝癌細胞的上皮間質轉化(EMT)和轉移。上述結果證實,miR-127-3p通過負向調控SCAI的表達抑制甲狀腺癌細胞的增殖、侵襲及遷移。
綜上所述,乳頭狀甲狀腺癌中miR-127-3p呈低表達,可抑制細胞惡性生物學行為,機制可能與靶向SCAI有關,但具體機制有待進一步探討。

