不同產地生姜中姜酚類含量及最佳配比研究
董文南,萬敏,李克招,袁惠
1.江西省藥品檢驗檢測研究院,國家藥品監督管理局中成藥質量評價重點實驗室,江西省藥品與醫療器械質量工程技術研究中心,江西 南昌 330029;2 江西省醫療器械檢測中心,江西 南昌 330029
生姜(Zingiber officinaleRosc.)為姜科姜屬的多年生草本植物的新鮮根莖,最早起源于春秋時期,首載于《金匱要略》,張仲景的《傷寒雜病論》記載的方劑中用到生姜的就有75 首[1]。我國是世界上生姜總產量最多的國家,地方品種繁多[2]。據統計,全世界生姜共有約80 個屬,而中國就占據了其中14 個,分布于我國的中部、東南部到西南部。生姜是我國傳統中藥,歷史悠久,應用廣泛。現代研究表明,生姜具有止吐[3]、抗腫瘤[4-5]、抗糖尿病[6]、治療心腦血管疾病[7]等藥理活性。
不同產地的生姜中的功能性成分姜酚含量差異較大,不少文獻將姜酚作為評價生姜的質量指標[8-9]。2020 年版《中國藥典》規定生姜中6-姜辣素含量不得低于0.05%,8-姜酚和10-姜酚總量不得低于0.04%。本研究收集了30 個不同產地的生姜,用優選的姜酚制備工藝處理得到姜酚提取物,分別測定6-姜辣素、8-姜酚、10-姜酚的含量及含量配比,運用成熟的宮頸癌Hela 細胞作為體外篩選模型,根據腫瘤細胞抑制率IC50值優選姜酚提取物中各成分的比例。
1 儀器與材料
1.1 儀器
MS205DU 型電子天平(梅特勒-托利多公司);LC-20ADXR 型高效液相色譜(日本島津公司);SW-CJ-2D 型超凈工作臺(上海鼎科科學儀器公司);QP-80 型二氧化碳培養箱(濟南鑫貝西生物技術有限公司);SN-LSC-40S 型離心機(上海尚普儀器設備有限公司);ELI0A 型酶標儀(BIOBASE公司)等。
1.2 材料
生姜(經江西省藥品檢驗檢測研究院的萬林春主任中藥師鑒定為姜科植物姜Zingiber officinaleRosc.的新鮮根莖);6-姜酚對照品(批號:SLCG1228,購自Sigma 公司);Hela 細胞系[RPMI Medium 1640(含雙抗),索萊寶:31800-500 mL];FBS 緩沖液(ABW:AB-FBS0500);胰蛋白酶-EDTA 消化液(0.25%)不含酚紅(索萊寶:T1300);1×PBS 緩沖液(pH7.2~7.4,索萊寶:P1020);CCK-8 試劑盒(細胞增殖及毒性檢測試劑盒,索萊寶:CA1210);二甲基亞砜(DMSO,細胞培養級,索萊寶:D8371);5-氟尿嘧啶(美侖:MB1273-1);96 孔細胞培養板(labselect:11512)。
2 方法與結果
2.1 姜酚的含量測定
2.1.1 色譜條件色譜柱:OSAKA SODA CAPCELL PAK C18 柱(250 mm×4.6 mm,5 μm);流動相:乙腈(A)-0.1%甲酸溶液(B),梯度洗脫(0~10 min,45% A;10~15 min,45% →48% A;15~17 min,48% →60%A;17~43 min,60% A;43~45 min,60% →67% A;45~48 min,67%→69% A;48~58 min,69%→71% A);檢測波長:282 nm;流速:0.5 mL/min ;柱溫:25 ℃ ;進樣量:15 μL。
2.1.2 對照品溶液制備精密稱取6-姜辣素對照品,加甲醇溶解,制成質量濃度為102.4 μg/mL 的對照品溶液。
2.1.3 供試品溶液制備取絞碎的生姜50 g,精密稱定,加10 倍量75%乙醇浸泡0.5 h,回流提取1.0 h,濾過,備用。藥渣再加5 倍量的75%乙醇,回流提取1.0 h,濾過,合并濾液,50 ℃減壓回收乙醇至無醇味,加水稀釋至0.5 g/mL,備用。
量取預先處理好的XAD 7HP 型大孔吸附樹脂10 mL,進行濕法裝柱,將上述稀釋液緩慢上樣,以2~3BV 的體積流量通過樹脂柱;分別用水4BV(40 mL)和40%乙醇4BV(40 mL)洗滌除雜,棄去洗液;再用6BV 的75%乙醇,以2~3BV 的體積流量進行洗脫,收集洗脫液,50~60 ℃減壓回收乙醇至無醇味(至5~10 mL),加水稀釋至50 mL(1 g 生藥/mL),并加入同等體積的乙酸乙酯進行萃取,振搖10 min,靜置30 min,取有機相離心,分取澄清有機相,減壓濃縮至干,用適量甲醇分次洗滌殘渣,洗滌液轉移至50 mL 量瓶中,用甲醇定容至刻度,搖勻,備用。精密量取上述甲醇溶液1 mL,置于10 mL 量瓶中,加甲醇定容至刻度,即得供試品溶液。不同產地的30 個批次生姜同法操作。
2.1.4 姜酚的測定方法參照2020 年版《中國藥典》,吸取供試品溶液按“2.1.1”項下色譜條件測定生姜中6-姜辣素的含量,利用校正因子分別計算8-姜酚、10-姜酚含量。
2.2 抗腫瘤體外藥物篩選試驗
2.2.1 體外試驗樣品制備從“2.1.3”項下的30 個批次的甲醇定容的總姜酚溶液中分別取1 mL 母液,揮干甲醇溶劑,加入20 μL DMSO 溶解沉淀后加入對應體積的培養基至50、75、100、125、150 μM五種濃度,無菌過濾;陽性組為5-氟尿嘧啶用完全培養基配制成50 μM 濃度的溶液;對照孔為0.5%DMSO 溶液。
2.2.2 試驗方法及計算(1)試驗方法。CCK-8 試劑盒是MTT 法的最新的一種替代方法,用酶聯免疫法在特定波長處測定其光吸收值,可間接反映其中存活的細胞數量,廣泛應用于腫瘤抑制率和細胞增殖的快速高靈敏度檢測。本試驗使用胰酶消化Hela細胞,用完全培養基以每孔1×104個鋪于96 孔板上,在二氧化碳培養箱中進行孵育,待細胞完全貼壁;棄去舊的培養基,添加含藥物的培養基進行處理,培養48 h;棄上清,添加10% CCK-8 檢測試劑,培養1~2 h 后用酶標儀檢測。
(2)計算方法。細胞抑制率(%)=[(A 對照孔-A 實驗孔)/(A 對照孔-A 空白孔)]×100%;A 空白孔:不含細胞和待測藥物、只含CCK-8 的培養基的吸光度;A 對照組:含有細胞的培養基、CCK-8、沒有待測藥物、含0.5% DMSO 的吸光度;A 陽性實驗組:含有細胞的培養基、CCK-8、5-氟尿嘧啶50 μM 濃度、含0.5% DMSO 的吸光度;A給藥實驗組:含有細胞的培養基、CCK-8、待測藥物、含0.5% DMSO 的吸光度。
2.3 試驗結果
運用優選的制備工藝(見“2.1.3”項下),分別測定不同產地30 個批次的總姜酚提取物溶液的6-姜辣素、8-姜酚、10-姜酚含量,并計算,有效成分含量配比=有效成分含量/(6-姜辣素、8-姜酚和10 姜酚含量之和)。從表1 結果可以看出,不同產地的6-姜辣素、8-姜酚、10-姜酚的含量和含量配比差異較大。
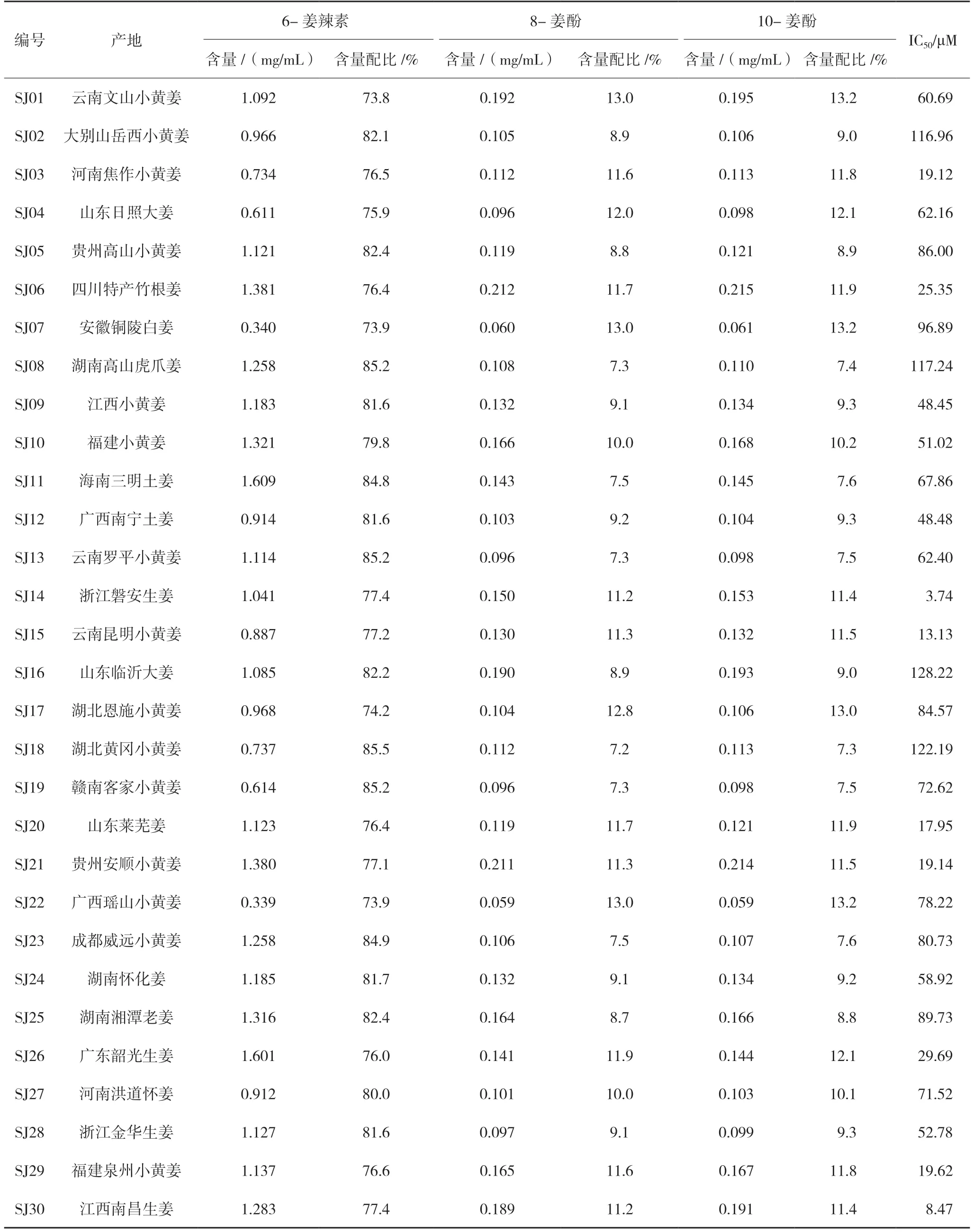
表1 不同產地生姜的6-姜辣素、8-姜酚、10-姜酚含量及對Hela細胞IC50值
運用成熟的宮頸癌Hela 細胞作為體外篩選模型,根據腫瘤細胞抑制率IC50值優選姜酚提取物中的6-姜辣素、8-姜酚、10-姜酚的比例。從表1 抑制率結果可以看出,空白組抑制率為0,對照組抑制率為-0.87%,陽性組抑制率為92.27%,實驗組中三者比例6-姜辣素77%±0.5%(76.5%~77.5%),8-姜 酚11.5%±0.5%(11.0%~12.0%),10-姜 酚11.5%±0.5%(11.0%~12.0%)時,IC50小于20 μM,顯示非常好的抗腫瘤活性,為最佳配比關系,為今后姜酚用于抗腫瘤研究確定提取物標準。
3 討論
試驗結果表明,不同產地的生姜經過優選的制備工藝提取后,制備所得的姜酚提取物中功能性成分6-姜辣素、8-姜酚、10-姜酚的含量差異較大,含量配比也有所不同。通過對30 個不同產地的姜酚提取物進行體外抗腫瘤細胞抑制率試驗進行篩選,得到相應批次提取物的IC50值來判斷抗腫瘤效果。最終發現產地浙江磐安、江西南昌的生姜IC50值最小,表明這兩個產地的生姜具有較好地抑制宮頸癌Hela 細胞增殖的作用。通過研究不同產地30 個批次的總姜酚提取物中6-姜辣素、8-姜酚、10-姜酚不同量的配比及對宮頸癌Hela 細胞抑制率IC50值,確定6-姜辣素、8-姜酚、10-姜酚的比例范圍為(76.5%~77.5%)∶(11.0%~12.0%)∶(11.0%~12.0%)時抗腫瘤活性最強。
近年來,越來越多的研究發現,中藥發揮作用不僅僅依靠某一種單一的成分,有可能是結構相近的一組成分發揮協同增效作用[2]。6-姜辣素、8-姜酚、10-姜酚為結構相近的同系物,具有產生相同藥理作用的官能團,與體內受體結合后,在體內進行吸收和轉運,并產生相同藥效[2]。通過體外腫瘤抑制率試驗高通量快速篩選IC50值較低的所屬產地的生姜,并明確6-姜辣素、8-姜酚、10-姜酚的天然配比,得到其最佳配比范圍。為探討中藥中含有的一系列同系物具有相同藥理作用提供了新思路,并為中藥用于抗腫瘤研究確定提取物標準。

