希瓦氏菌協同鐵氧化物/蒙脫石復合體對鈾酰離子的去除研究
謝龍悅 鄭志勤 翟帆帆 胡璇 杜小波 馬瑛 邊亮
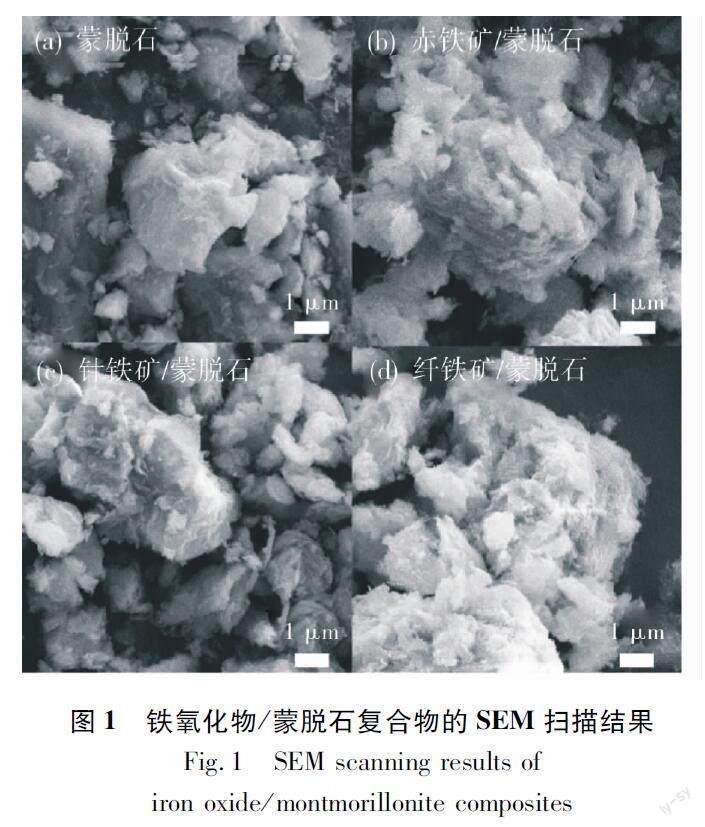
摘要:為了降低U(VI) 在水中的溶解性,縮小鈾污染的可遷移范圍,將蒙脫石改造為鐵氧化物/蒙脫石并與希瓦氏菌MR-1(Shewanella oneidensis MR-1)構成聯合體系,以實現在厭氧條件下對U(VI)的生物還原。制備了鐵氧化物/蒙脫石復合體并對其形貌結構進行了表征;分析了礦物-微生物聯合還原體系中U(VI),Fe(II)含量的變化和礦物-微生物-腐殖酸聯合體系中U(VI),Fe(II)含量的變化;討論了礦物-微生物聯合體系對U(VI)的生物還原過程及還原途徑。結果表明:蒙脫石在合成為鐵氧化物/蒙脫石后,其層狀結構變化不大,但引入了含量不等的Fe,其中纖鐵礦中引入的Fe原子含量最高(67.71%);在礦物-微生物聯合體系中,纖鐵礦/蒙脫石聯合希瓦氏菌MR-1體系對 U(VI)的還原能力最高,在鈾濃度50 mg·L-1處理組中的還原率為85.8%,Fe(II)的含量與U(VI)濃度呈反比關系,在反應的0~3 h時迅速上升;在礦物-微生物-腐殖酸復合體系中,腐殖酸濃度對還原U(VI) 的影響表現為“完全促進”“低促高抑”和“高促低抑” 3種現象,對聯合體系中的Fe(II)的影響主要分為抑制和促進兩種類型。鐵氧化物/蒙脫石與希瓦氏菌MR-1構成的聯合體系在厭氧條件下能夠實現對U(VI)的生物還原。
關鍵詞:希瓦氏菌MR-1 鐵氧化物/蒙脫石U(VI) 生物還原 腐殖酸
中圖分類號:Q939.11;X591文獻標志碼:A文章編號:1671-8755(2023)03-0048-10
Removal of Uranyl Ions by Iron Oxide/Montmorillonite Complex
in Cooperation with Shewanella Oneidensis MR-1
XIE Longyue1, ZHENG Zhiqin2,3, ZHAI Fanfan1, HU Xuan1, DU Xiaobo2,
MA Ying2, BIAN Liang4,5
(1.School of Life Science and Engineering, Southwest University of Science and Technology, Mianyang
621010, Sichuan, China; 2. Key Laboratory of Medical Transformation of Nuclear Technology, NHC,
Mianyang Central Hospital, Mianyang 621000, Sichuan, China; 3. Fundamental Science on Nuclear Wastes
and Environmental Safety Laboratory, Mianyang 621010, Sichuan, China; 4. School of Environment and
Resource, Southwest University of Science and Technology, Mianyang 621010, Sichuan, China; 5. State
Key Laboratory of Environmentfriendly Energy Materials, Mianyang 621010, Sichuan, China)
Abstract:? In order to reduce the solubility of U(VI) in water and the migratory range of uranium pollution, montmorillonite was transformed into iron oxide/montmorillonite and formed a consortium with Shewanella oneidensis MR-1 to achieve bioreduction of U(VI) under anaerobic conditions. The iron oxide/montmorillonite composite was prepared and its morphology and structure were characterized. The changes in U(VI) and Fe(II) contents in the mineral-microbe consortium and mineral-microbe-humic acid consortium were analyzed. The bioreduction process and pathway of U(VI) in the mineral-microbe consortium were discussed. The results show that after synthesizing montmorillonite into iron oxide/montmorillonite composite, the layer structure of montmorillonite has little change, but different amounts of Fe are introduced. And the highest content of Fe atoms is introduced by lepidocrocite (67.71%). In the mineral-microbe consortium, the lepidocrocite/montmorillonite consortium with Shewanella oneidensis MR-1 has the highest U(VI) reduction ability, and the reduction rate is 85.8% at a uranium concentration of 50 mg·L-1. The content of Fe(II) is inversely proportional to the concentration of U(VI), and it rises rapidly from 0 to 3 hours of reaction. In the mineral-microbe-humic acid composite system, the effect of humic acid concentration on the reduction of U(VI) exhibits three phenomena: “complete promotion” “low promotion and high inhibition” and “high promotion and low inhibition”. The impact on Fe(II) in the composite system is mainly divided into two types: inhibition and promotion. The consortium of iron oxide/montmorillonite and Shewanella oneidensis MR-1 can achieve the bioreduction of U(VI) under anaerobic conditions.
Keywords:? Shewanella oneidensis MR-1; Iron oxide/montmorillonite; U(VI); Bioreduction; Humic acid
在環境問題中土壤污染問題尤為突出[1-2]。隨著核能源的開發與使用、核武器的研發與試驗,生成了大量的放射性核廢物(鈾)[3],少部分未有效凈化的污染物排放到環境中,使得土壤污染問題更加復雜。鈾污染土壤的特征有高毒性、累積性、隱蔽性、滯后性和難降解等特點[4],鈾經食物鏈在生物(植物、動物)體內積累,最后到達人體,威脅人類生命安全[5]。鈾存在多種價態(III,IV,V和VI),其中U(III)和 U(V)非常活潑,不能穩定存在于環境中,在地質環境中僅有U(IV)和U(VI)穩定存在。U(VI)主要以鈾酰離子(UO22+)形式存在,因為其離子半徑大(3.20×10-8 cm)易溶于水而易遷移,離子半徑相對較小的 U(IV) (1.05×10-8 cm)則難溶于水[6]。因此,在鈾污染地區需要一種綠色、高效的方法將U(VI)還原為U(IV),用于防止鈾污染范圍進一步擴大[7]。
用于鈾污染環境的修復方法主要包括物化法和生物法[8]。其中生物法環境干擾小,不產生二次污染,被認為是最環保有效的修復技術。研究發現各種異化金屬還原菌能利用氧化金屬(Fe(Ⅲ),Mn(Ⅵ) 和U(Ⅵ)等)作為電子受體,以有機酸等作為電子供體獲得能量,最終實現金屬價態和狀態的改變[9-11]。細菌還可以通過細胞外電子轉移[12]、細胞膜結合蛋白[13]、還原酶[14]等對高價態重金屬進行固定還原。
微生物在土壤中常常附著在含鐵黏土礦物上,微生物和鐵礦物相互作用共同促進環境中的鐵循環并減少環境污染物。一方面黏土礦物(蒙脫石)含有可交換的陽離子和表面上可吸附的陰離子,可作為有害離子處理的吸附劑,含鐵黏土礦物(鐵氧化物)表面含有豐富的鐵羥基基團,對土壤中的污染離子具有較強的固定能力[15];另一方面含鐵黏土礦物中的結構鐵Fe(III)可被異化金屬還原菌還原,而結構亞鐵Fe(II)可減少環境中的污染物(如重金屬、有機物、核素),改變其毒性和遷移率。
腐殖質由含有多種官能團(羥基、氨基、羧基等)的芳香環構成,具有較大的比表面積和可變電荷[16-17],能與土壤中的重金屬離子通過離子鍵、共價鍵及螯合鍵的方式結合,進而吸附、絡合和還原重金屬離子,達到去除污染離子的作用。研究表明腐殖酸在金屬還原微生物的代謝過程中有助于提升金屬還原微生物對高價金屬離子的還原效率[18]。
本研究以蒙脫石為材料,合成了3種鐵氧化物/蒙脫石(纖鐵礦/蒙脫石、赤鐵礦/蒙脫石、針鐵礦/蒙脫石),并分別與希瓦氏菌MR-1(Shewanella oneidensis MR-1)構建了礦物-微生物聯合體系,使其對U(VI)進行生物還原。為了增強礦物-微生物聯合體系對U(VI)的還原能力,設計了礦物-微生物-腐殖酸聯合還原體系。最后,根據研究結果討論了礦物-微生物聯合體系對U(VI)的生物還原途徑。
1材料與方法
1.1鐵氧化物/蒙脫石的制備
合成了針鐵礦/蒙脫石、纖鐵礦/蒙脫石、赤鐵礦/蒙脫石。
蒙脫石的處理:稱取50 g蒙脫石(上海阿拉丁生化科技股份有限公司),分別用95%乙醇、去離子水清洗數次。根據顆粒的沉降速度,用虹吸法吸取小于2 μm的顆粒,使用真空冷凍干燥。最后用瑪瑙研缽研磨,保存于帶干燥硅膠的干燥器中,待用。
針鐵礦/蒙脫石的制備:稱取0.05 mol洗脫干燥后的蒙脫石和FeCl3·6H2O,分別溶于50 mL去離子水中,隨后將二者混勻,使用0.45 mol·L-1的NaOH溶液定容至1 L,于70 ℃ 孵育60 h。自然冷卻至室溫,并用去離子水反復洗滌數次,離心(8 000 r/min,5 min),真空冷凍干燥24 h[19]。
纖鐵礦/蒙脫石的制備:稱取0.05 mol洗脫干燥后的蒙脫石和FeCl3·6H2O,分別溶于50 mL去離子水中,隨后將二者混勻,將其稀釋到500 mL,轉移到密閉容器中,在70 ℃ 環境中保持48 h,期間pH值從1.7降至1.2,產生黃色沉淀,用去離子水洗滌數次,離心(8 000 r/min,5 min),真空冷凍干燥24 h[19]。
赤鐵礦/蒙脫石的制備:稱取0.05 mol洗脫干燥后的蒙脫石和FeCl3·6H2O,分別溶于50 mL去離子水,隨后將二者混勻,滴加150 mL已加熱到90 ℃ 的1 mol·L-1 NaOH,再加入25 mL 1 mol·L-1已加熱到90 ℃ 的NaHCO3,用90 ℃ 去離子水將其稀釋到500 mL,并放入加蓋的聚丙烯容器中密封,在90 ℃ 下老化48 h。用去離子水洗滌數次紅色沉積物并離心(8 000 r/min ,5 min),真空冷凍干燥24 h[19]。最后將干燥得到的固體用瑪瑙研缽磨細,保存于干燥器中。
1.2鐵氧化物/蒙脫石的結構表征
采用場發射掃描電子顯微鏡(Scanning electron microscope,SEM)進行樣品形貌分析:取少量樣品粉末于導電膠表面,在真空下進行鍍金,通過SEM(Uitra55,德國蔡司)進行觀察,其中加速電壓為10~20 kV,激發電子束為30~40 μA。
利用能量色散-X射線光譜儀(Pure,荷蘭Phenom)對鐵氧化物/蒙脫石中的主要元素進行分析。
采用X 射線衍射儀(XRD,XPert PRO,荷蘭帕納科)進行物相分析:粉末壓片法(將烘干保存的樣品用瑪瑙研缽磨細至200 目以下,樣品量約1 g),功率1 400 W(管壓40 kV,管流40 mA),掃描范圍10°~80°(2θ),步長0.02°,掃描速度0.02°/s。
利用傅里葉紅外光譜分析儀(FT-IR,IRSpirit-T,日本)對礦物結構進行分析:取適量樣品粉末與無水KBr(質量比1∶100)于瑪瑙研缽中研磨混合均勻,取約0.003 g混合后樣品壓片進行測試。掃描范圍400~4 000 cm-1,最高分辨率 0.4 cm-1,波速精度0.01 cm-1,掃描速度:0.158 1~3.164 7 cm·s-1,掃描次數50次。
1.3U(VI)還原體系的搭建
將希瓦氏菌MR-1于LB培養基中培養后離心分離(6 000 r/min ,10 min),用無菌碳酸氫鈉緩沖液(濃度為30 mmol·L-1 NaHCO3,pH=7.3)將菌體洗滌兩次,并懸浮細胞至1×109 個·mL-1(OD600=0.8)。并加入到無機鹽培養基(10 mmol/mL乳酸鈉,2 g·L-1 NaHCO3,0.1 g·L-1 KCl,pH 7.0,含5.0 g·L-1鐵氧化物/蒙脫石)中。于30 ℃ 厭氧培養12 h后向反應體系中加入適量的U(VI)(UO2(NO3)2·6H2O, AR, 北京華威瑞科),使U(VI) 的終濃度分別為50,100,150,200 mg·L-1,且反應體系的體積為40 mL,并放置于厭氧培養箱中,以此作為礦物-微生物對U(VI)的聯合還原體系。于第3,6,9,12,24 h時采集樣本,作為待測液。
在礦物-微生物-腐殖酸聯合體系中,U(VI)濃度為100 mg·L-1,且腐殖酸(C14H12O8,羅恩試劑)的濃度分別0,50,100,150,200 mg·L-1,其他條件與礦物-微生物聯合體系一致。
1.4反應體系中U(VI)和Fe(II)濃度的測定
由于NaHCO3可萃取U(VI)[20],故取1 mL待測液,使用等體積的30 mmol·L-1 NaHCO3與之混勻,取1 mL混合液于比色管中,并加入質量分數 0.1%的偶氮胂III溶液、3% HNO3溶液和0.05 mol·L-1 EDTA-2Na 各1 mL,用去離子水補充至10 mL,用漩渦震蕩儀搖勻,于652 nm波長處測吸光度。經測定U(VI)濃度(mg·L-1)與652 nm處吸光度的標準曲線方程為:y=0.0169x-0.0939(R2=0.9992)。
Fe(II)濃度測試采用鄰菲羅啉-HF/H2SO4提取法,具體步驟如下:測定樣品中總Fe(II)濃度時,將0.5 mL樣品與1.2 mL質量分數10% H2SO4,0.1 mL質量分數4% HF和0.16 mL質量分數10% 鄰菲羅啉顯色劑(用95% 乙醇溶液配制,避光保存)混合搖勻,于沸水浴中加熱30 min。冷卻后,向待測樣品中加入0.8 mL 0.1 mol/L H3BO3,搖勻,用于中和多余的HF。移取0.5 mL加入1 mL質量分數10% 檸檬酸三鈉,待顯色充分后于510 nm處測吸光度。經測定Fe(II)濃度(mmol·L-1)與510 nm處吸光度的標準曲線方程為:y=0.691x-0.0905(R2=0.9991)。
1.5數據處理
本研究中的ANOVA方差分析均由R語言完成,數據可視化由Origin2020和Graph Pad8共同完成。
2結果與分析
2.1鐵氧化物/蒙脫石復合物的結構表征
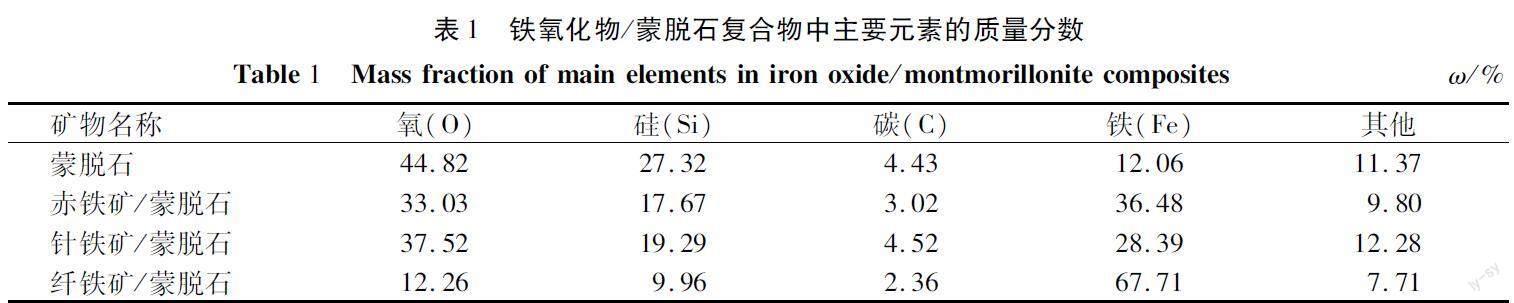
通過掃描電子顯微鏡并結合能量色散-X射線光譜儀對鐵氧化物/蒙脫石復合物進行了分析,結果如圖1、表1所示。經過處理后的鐵氧化物/蒙脫石呈現出不規則的晶體和非晶體結構,有異于蒙脫石的光滑層狀結構,使得處理后的鐵氧化物/蒙脫石可能吸附到更多的U(VI)。蒙脫石中O,Si,C原子為其中的主要元素,其中O原子和Si原子的相對原子含量較高,質量分數分別為44.82% 和27.32%。相比于礦物結構的變化,合成后的鐵氧化物/蒙脫石在原子組成上同樣發生了較大的變化,主要體現在O,Si原子相對含量大幅降低,同時還引入了含量不等的Fe原子,但C原子在合成之后相對含量的變化不大。具體表現為:赤鐵礦、針鐵礦的O原子質量分數較蒙脫石的O原子質量分數降低了7.30%~18.53%,而纖鐵礦O原子的質量分數則降低了32.56%。合成的纖鐵礦中引入的Fe原子也遠高于其他礦,纖鐵礦的Fe原子相對含量為67.71%。
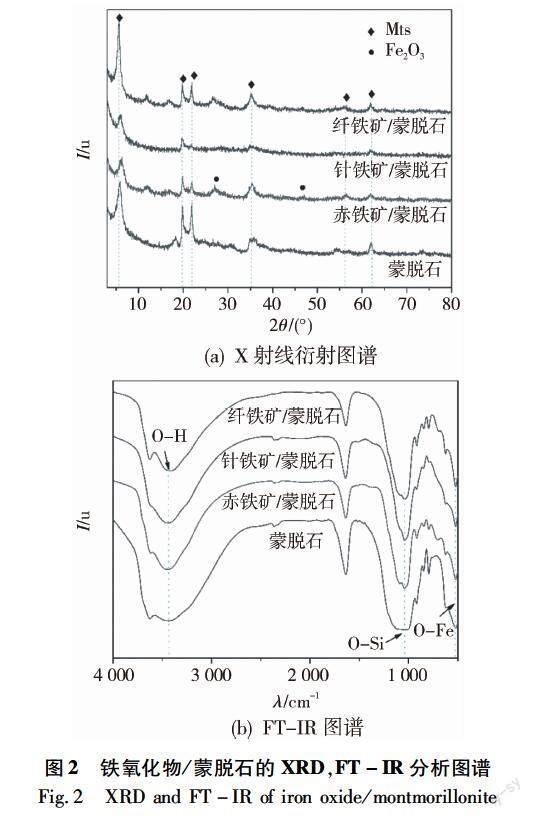
XRD分析結果如圖2(a)所示。蒙脫石內部的幾何空間是層間結構,其中有可用于離子交換的陽離子。與蒙脫石的衍射數據比較,鐵氧化物/蒙脫石復合物中蒙脫石的衍射峰減弱,這可能是由于蒙脫石表面覆蓋了鐵氧化物顆粒。另外,蒙脫石的晶層間距發生改變,鐵氧化物/蒙脫石復合物在形成過程中羥基鐵離子進入蒙脫石晶層間取代了部分鈉離子。由布拉格公式計算得出蒙脫石層間距為2.81 nm。通過比對PDF標準卡片(Powder diffraction file,PDF)發現,3種鐵氧化物/蒙脫石均具有較強的SiO2特征峰(SiO2 JCPDS? No:46-1405,101晶面),未發現Fe2O3或FeO的特征峰,表明合成的鐵氧化物-硅酸鹽礦物復合物在形成過程中導致Fe2O3或FeO的非晶化。
FT-IR結果如圖2(b)所示。蒙脫石及鐵氧化物/蒙脫石的FT-IR圖譜的差異不大,均在3 608,3 455,1 640,1 033,465 cm-1處具有較強的吸收峰,表明它們的內部基團的種類與排布基本一致。其中在4 000~1 300 cm-1范圍內為紅外光譜的官能區,3 600 cm-1左右為HO鍵的特征峰,這很可能是在蒙脫石中存在一定的結合水。而1 630 cm-1附近則為層間水伸縮振動和彎曲振動譜帶[21],對比蒙脫石的數據曲線,鐵氧化物/蒙脫石復合物中≡AlOH伸縮振動帶、OSiO伸縮振動帶、AlOSi彎曲振動帶發生了移動和變化,且出現了≡FeOH面內彎曲振動帶、≡FeOH面外彎曲振動帶和FeO伸縮振動帶。
2.2礦物-微生物聯合還原體系中U(VI),Fe(II)濃度的變化
鐵氧化物/蒙脫石與希瓦氏菌MR-1聯合作用時,均可在一定程度上降低體系中U(VI)? 的含量(圖3),同時反應十分迅速,即在0~3 h內反應速率最高,并且在3~12 h內反應速率逐步變緩,直至12 h時反應達到平衡。ANOVA分析結果表明,纖鐵礦/蒙脫石聯合希瓦氏菌MR-1體系對U(VI)? 的還原能力顯著高于其他2個復合物(P<0.05),例如在50 mg·L-1的鈾處理組中,纖鐵礦/蒙脫石在平衡時使U(VI) 的濃度降低至7.082 mg·L-1(還原率85.8%)。另外,針鐵礦/蒙脫石在4個處理組中還原U(VI)的能力均為最低,顯著低于其他礦物的U(VI)還原能力(P<0.05)。綜上所述,礦物-微生物體系在還原U(VI) 時反應速率較快,同時鐵氧化物/蒙脫石中Fe(III) 的含量與U(VI) 的還原率成正相關。
礦物-微生物聯合還原體系中Fe(II)濃度的變化如圖4所示。所有處理組的Fe(II) 濃度在整個反應過程中均介于0~0.7 mmol·L-1,由于在礦物合成過程中使用FeCl3作為原料,故而在反應初始階段(0 h)體系中的Fe(II)濃度幾乎為0,在反應的 0~3 h內Fe(II) 濃度迅速上升,該階段也對應于U(VI) 含量迅速降低的時間范圍,表明該時期內MR-1? 在Fe(III)和U(VI)的還原過程中可能扮演著重要角色。體系反應至3~12 h時,Fe(II)濃度上升速率逐漸降低,直至12 h時達到平衡,但纖鐵礦/蒙脫石反應體系中的Fe(II)? 濃度仍在持續上升。在50 mg·L-1的鈾處理組中,不同反應體系中平衡后Fe(II) 的濃度存在很大差異(P<0.05),其中針鐵礦/蒙脫石體系中Fe(II) 的濃度最低(0.371 mmol·L-1),這可能是因為低濃度鈾處理促進了Fe(II) 的還原過程,但對不同類型的鐵氧化物/蒙脫石的促進效果存在差異。
2.3礦物-微生物-腐殖酸聯合體系中U(VI),Fe(II)濃度的變化
礦物-微生物-腐殖酸聯合還原體系中U(VI) 的含量變化結果如圖5所示。結果表明,腐殖酸對聯合體系還原U(VI) 影響顯著(P< 0.05),但不同的鐵氧化物/蒙脫石對腐殖酸的響應存在差異,表現為“完全促進”“低促高抑”和“高促低抑” 3種情況。腐殖酸對赤鐵礦/蒙脫石體系的U(VI) 還原能力均表現為“完全促進”作用,且與腐殖酸的處理濃度呈顯著正相關(P<0.05),在200 mg·L-1的腐殖酸處理組中,U(VI) 在反應平衡后的濃度為28.8 mg·L-1,去除率達到了71.2%,相較于未添加腐殖酸(26.4%)得到了顯著提升(P<0.01)。腐殖酸對針鐵礦/蒙脫石的U(VI) 還原能力整體表現為“低促高抑”,50~100 mg·L-1的腐殖酸添加顯著促進了體系中的U(VI) 還原過程(P<0.05),而150,200 mg·L-1的腐殖酸添加組中U(VI) 的濃度則顯著低于對照組(P<0.05)。纖鐵礦/蒙脫石則表現為“高促低抑”的現象,即150,200 mg·L-1的腐殖酸處理組中U(VI) 的濃度分別為28.4,27.7 mg·L-1,顯著低于對照組的33.0 mg·L-1(P<0.05),而50~100 mg·L-1處理組中的U(VI) 則分別為42.6,38.4 mg·L-1。因此,腐殖質提升了鐵氧化物/蒙脫石-希瓦氏菌MR-1對U(VI) 的還原能力,但腐殖酸的具體添加量針對不同礦物有所差異,導致這種差異的原因尚不明確,需進一步研究。
圖6為礦物-微生物-腐殖酸聯合體系中Fe(II)濃度的變化情況。Fe(II)濃度在聯合體系中的變化與U(VI)濃度的變化具有十分緊密的聯系,但Fe(II)濃度的變化幅度沒有U(VI)濃度變化劇烈。腐殖酸對聯合體系中的Fe(II) 的影響主要分為抑制和促進兩種類型,腐殖酸對纖鐵礦/蒙脫石、赤鐵礦/蒙脫石表現出顯著的促進作用(P<0.05),但這二者之間又存在細微差別。腐殖酸顯著促進了纖鐵礦/蒙脫石聯合體系中Fe(II) 濃度的增加,不同劑量的腐殖酸處理組之間并未出現顯著性差異(P>0.05)。而赤鐵礦/蒙脫石聯合體系中Fe(II) 濃度不僅因腐殖酸的處理而增加,并且出現了隨腐殖酸處理濃度的上升促進效果不斷增強的現象。在200 mg·L-1的腐殖酸處理中,赤鐵礦/蒙脫石聯合體系中的Fe(II) 濃度為0.773 mmol·L-1,顯著高于對照組的0.562 mmol·L-1(P<0.05)。腐殖酸對針鐵礦/蒙脫石則表現為抑制其對應聯合體系中的Fe(II) 生成,但并未表現出明顯的濃度效應。這有可能是因為針鐵礦/蒙脫石中Fe含量較高,促進了U(VI) 的還原反應,并抑制了Fe(II) 的生成。
3討論
3.1Fe對礦物-微生物聯合體系生物還原過程的影響
在鐵氧化物/硅酸鹽礦物復合體合成過程中人為地添加了一定的Fe(III)并且以結構 Fe(III) 的形式存在于其中,結構Fe(III) 在礦物-微生物聯合體系發生生物還原作用時具有重要作用。本研究結果表明,礦物-微生物聯合體系的U(VI) 還原能力與礦物中Fe(III) 含量具有緊密關系,Fe含量最高的纖鐵礦/蒙脫石,其對應的礦物-微生物聯合體系的U(VI) 還原能力也最強。某些具有金屬還原性的異養微生物在厭氧環境且生長體系缺乏電子受體的情況下,雖然能夠完成有機物的氧化分解,但需要將代謝過程中產生的電子轉移至礦物中Fe(III) 等電子受體上才能完成整個代謝過程[22]。在該過程中,Fe(III) 得到電子后被還原為Fe(II),生成的Fe(II) 又具有較高的還原性,可對體系中存在的高價態金屬離子(如Cr6+)進行還原[23]。Zhang等[24]通過構建含Fe(III) 礦物與腐敗希瓦氏菌CN32(Shewanella putrefaciens CN32)聯合體系,考察了U(VI) 的還原情況,結果表明該體系能有效進行U(VI)? 的生物還原過程,同時當體系中存在檸檬酸或EDTA等有機配體時,U(VI) 的生物還原速率顯著提升。這是因為有機配體可以通過影響鈾的形態、吸附、生物利用度、U(VI)/U(IV)氧化還原電位,進而影響U(VI) 的還原動力學[25]。Zhao等[26]發現黏土礦物中的結構Fe(III)是控制Fe(III) 還原菌、As(V) 還原菌和 Fe(III)-As(V) 還原菌還原As(V) 并釋放As(III) 的關鍵因素。因此,Fe(III) 可有效提升微生物-礦物聯合體系的還原能力,降低U(VI) 的生物毒性。
3.2有機質增強礦物-微生物聯合體系生物還原過程
有機物是異養微生物生長代謝的物質基礎,為細胞的基礎生命活動提供了能量來源。在微生物實現其功能時,有機物的添加是必不可少的。另外,腐殖酸中存在醌和芳香族等具有氧化還原功能的官能團,腐殖酸在礦物-微生物聯合體系中,尤其針對于金屬還原微生物的代謝過程中,可充當電子穿梭體的作用,并且在厭氧環境中該電子穿梭體是可再生的,顯著增加了微生物的生長代謝速率。本研究為了增強鐵氧化物/蒙脫石與希瓦氏菌MR-1聯合體系的U(VI) 生物還原能力,向該體系添加了不同濃度的水溶性腐殖酸。促進了鐵氧化物/蒙脫石-希瓦氏菌MR-1聯合體系對U(VI) 的還原,但腐殖酸的具體添加量針對不同礦物有所差異。對Fe元素相對含量較高的體系,僅需少量腐殖酸便可促進對U(VI) 的還原。然而高濃度的腐殖酸處理可能會使體系中大量的Fe(II) 或Fe(III) 與腐殖酸發生絡合,進而抑制體系的還原能力[27];礦物可能覆蓋細胞表面并中斷電子轉移[28],故需要更多的腐殖酸充當電子穿梭體的作用。Dong等[29]將天然黏土礦物和腐殖酸加入到受污染土壤中,并通過土壤中的微生物群落共同作用,實現了釩污染土壤的有效修復,經修復后的土壤對營養物質的固定能力以及微生物群落多樣性顯著提升。Zuo等[30]通過向礦物-腐敗希瓦氏菌CN32聯合體系中添加適當的腐殖酸,成功地增強了黏土-Fe(III) 的生物還原過程,同時證實了腐殖酸在聯合體系下還能轉化為氨基酸和其他化合物,進而為微生物的生長代謝提供一定的物質基礎。Wang等[31]直接將由腐殖酸改性的蒙脫石應用于Cd和Hg污染土壤中,僅添加5% 的改性蒙脫石便使Cd,Hg質量分數分別降低94.1%,93.0%。這些研究均證明了腐殖酸可促進礦物-微生物聯合體系的生物還原過程。
3.3礦物-微生物聯合體系對U(VI) 的生物還原途徑
微生物、土壤礦物和有機物是土壤活躍成分,它們相互作用,共同影響土壤性質和土壤物質循環,同時對其中的污染離子進行固定和轉化。在土壤多組分對鈾進行污染治理時存在著鐵元素循環和鈾元素循環,且在U(VI) 的去除過程中存在著多種作用途徑。在厭氧條件下,希瓦氏菌MR-1通過厭氧呼吸產生電子,這些電子可以直接被U(VI)、礦物中Fe(III)、腐殖酸利用。得到電子的腐殖酸可將電子傳遞給U(VI) 和礦物中Fe(III),腐殖酸在其中充當電子穿梭體。得到電子的礦物中的Fe(III) 變為Fe(II),后將電子傳遞給U(VI),結構中的Fe(II) 又變回Fe(III)。通過以上3條途徑(微生物直接還原U(VI),腐殖酸介導,Fe(III) 的電子傳遞)將U(VI) 轉化為U(IV),降低了六價鈾的生物毒性,從而達到污染治理的目的。
4結論
本研究通過將蒙脫石合成鐵氧化物/蒙脫石,并與希瓦氏菌MR-1(Shewanella oneidensis MR-1)構成聯合體系,在厭氧條件下對U(VI) 進行生物還原。結果發現:(1)蒙脫石在合成為鐵氧化物/蒙脫石后,其層狀結構出現了較大變化,同時引入了含量不等的Fe,其中纖鐵礦中引入的Fe原子含量最高(67.71%);(2)在礦物-微生物聯合體系中,纖鐵礦/蒙脫石聯合希瓦氏菌MR-1體系對U(VI ) 的還原能力最強,在鈾處理濃度為50 mg·L-1時的還原率為85.8%,Fe(II) 的含量與U(VI) 呈反比關系,在反應的0~3 h時迅速上升;(3)腐殖酸對聯合體系還原U(VI) 的影響表現為“完全促進”“低促高抑”和“高促低抑”3種現象,對聯合體系中的Fe(II) 的影響主要分為抑制和促進兩種類型。因此,鐵氧化物/蒙脫石與希瓦氏菌MR-1構成的聯合體系在厭氧條件下能夠實現對U(VI) 的生物還原。在后續研究中,可借助代謝組學等技術考察聯合體系中小分子物質的變化情況,進一步了解礦物-微生物聯合體系還原U(VI) 過程中微生物的作用以及參與方式。
參考文獻
[1]CHEN H Y, TENG Y G, LU S J, et al. Contamination features and health risk of soil heavy metals in China[J]. Science of the Total Environment, 2015, 512/513: 143-153.
[2]SU C, JIANG L Q, ZHANG W J. A review on heavy metal contamination in the soil worldwide: Situation, impact and remediation techniques[J]. Environmental Skeptics and Critics, 2014, 3(2): 24-38.
[3]TODOROV P T, ILIEVA E N. Contamination with uranium from natural and antropological sources[J]. Romanian Journal of Physics, 2006, 51(1/2): 27-34.
[4]DONG W Q Y, CUI Y, LIU X. Instances of soil and crop heavy metal contamination in China[J]. Soil and Sediment Contamination: an International Journal, 2001, 10(5): 497-510.
[5]WALL D H, NIELSEN U N, SIX J. Soil biodiversity and human health[J]. Nature, 2015, 528(7580): 69-76.
[6]唐垂云, 鐘娟, 呂瑩, 等. 土壤中鈾污染修復技術研究進展[J]. 化工進展, 2021, 40(8): 4587-4599.
[7]CHEN L, LIU J R, ZHANG W X, et al. Uranium (U) source, speciation, uptake, toxicity and bioremediation strategies in soil-plant system: a review[J]. Journal of Hazardous Materials, 2021, 413: 125319.
[8]YAO Z T, LI J H, XIE H H, et al. Review on remediation technologies of soil contaminated by heavy metals[J]. Procedia Environmental Sciences, 2012, 16: 722-729.
[9]LI Y H, GONG X F. Effects of dissolved organic matter on the bioavailability of heavy metals during microbial dissimilatory iron reduction: a review[J]. Reviews of Environmental Contamination and Toxicology, 2021, 257: 69-92.
[10]JIANG Z, SHI M M, SHI L. Degradation of organic contaminants and steel corrosion by the dissimilatory metalreducing microorganisms Shewanella and Geobacter spp[J]. International Biodeterioration & Biodegradation, 2020, 147: 104842.
[11]MOLINAS M C A. Insights into the microbial reduction of pentavalent and hexavalent uranium species by Shewanella oneidensis MR-1 [D]. Lausanne, Swiss Confederation, EPFL, 2021.
[12]陳文達, 倪微琪, 胡寶蘭, 等. 細菌胞際電子轉移及其生態生理學意義研究進展[J]. 應用生態學報, 2019, 30(2): 694-702.
[13]徐柳, 宋琴, 茆燦泉. 金屬結合蛋白(肽)與環境重金屬生物修復[J]. 中國生物工程雜志, 2004, 24(4): 39-43.
[14]徐天生, 歐杰, 馬晨晨. 微生物還原Cr(Ⅵ) 的機理研究進展[J]. 環境工程, 2015, 33(1): 32-36.
[15]ZHAO M H, XU Y, ZHANG C S, et al. New trends in removing heavy metals from wastewater[J]. Applied Microbiology and Biotechnology, 2016, 100(15): 6509-6518.
[16]盧靜, 朱琨, 趙艷鋒, 等. 腐殖酸在去除水體和土壤中有機污染物的作用[J]. 環境科學與管理, 2006, 31(8): 151-154.
[17]GU B H, CHEN J. Enhanced microbial reduction of Cr(VI) and U(VI) by different natural organic matter fractions[J]. Geochimica et Cosmochimica Acta, 2003, 67(19): 3575-3582.
[18]LIU G F, YU H L, WANG N, et al. Microbial reduction of Ferrihydrite in the presence of reduced Graphene oxide materials: Alteration of Fe(III) reduction rate, biomineralization product and settling behavior[J]. Chemical Geology, 2018, 476: 272-279.
[19]SCHWERTMANN U, CORNELL R M. Iron oxides in the laboratory: preparation and characterization[M]. Weinheim: VCH, 1991.
[20]SATPATHY A, CATALANO J G, GIAMMAR D E. Reduction of U(VI) on chemically reduced montmorillonite and surface complexation modeling of adsorbed U(IV)[J]. Environmental Science & Technology, 2022, 56(7): 4111-4120.
[21]王麗娟, 廖立兵. 干燥方法對鈦柱撐蒙脫石結構的影響[J]. 硅酸鹽學報, 2005, 33(2): 215-219, 224.
[22]SHI L, DONG H L, REGUERA G, et al. Extracellular electron transfer mechanisms between microorganisms and minerals[J]. Nature Reviews Microbiology, 2016, 14(10): 651-662.
[23]馬曉旭, 孟穎, 張鑒達, 等. 含鐵黏土礦物與電子傳遞體強化生物還原固定地下水中Cr(Ⅵ)的過程和機理分析[J]. 環境工程學報, 2020, 14(9): 2527-2536.
[24]ZHANG L M, CHEN Y, XIA Q Y, et al. Combined effects of Fe(III)bearing clay minerals and organic ligands on U(VI) bioreduction and U(IV) speciation[J]. Environmental Science & Technology, 2021, 55(9): 5929-5938.
[25]BELLI K M, TAILLEFERT M. Biogeochemical processes regulating the mobility of uranium in sediments [J]. Trace Elements in Waterlogged Soils and Sediments, 2016(1):185-223.
[26]ZHAO Z W, MENG Y, YUAN Q K, et al. Microbial mobilization of arsenic from ironbearing clay mineral through iron, arsenate, and simultaneous ironarsenate reduction pathways[J]. Science of the Total Environment, 2021, 763: 144613.
[27]AMSTAETTER K, BORCH T, KAPPLER A. Influence of humic acid imposed changes of ferrihydrite aggregation on microbial Fe(III) reduction[J]. Geochimica et Cosmochimica Acta, 2012, 85: 326-341.
[28]MOHAMED A, YU L, FANG Y, et al. Iron mineral-humic acid complex enhanced Cr(VI) reduction by Shewanella oneidensis MR-1[J]. Chemosphere, 2020, 247: 125902.
[29]DONG Y B, LIN H, ZHAO Y M, et al. Remediation of vanadiumcontaminated soils by the combination of natural clay mineral and humic acid[J]. Journal of Cleaner Production, 2021, 279: 123874.
[30]ZUO H Y, KUKKADAPU R, ZHU Z H, et al. Role of clayassociated humic substances in catalyzing bioreduction of structural Fe(III) in nontronite by Shewanella putrefaciens CN32[J]. Science of the Total Environment, 2020, 741: 140213.
[31]WANG L W, LI X R, TSANG D C W, et al. Green remediation of Cd and Hg contaminated soil using humic acid modified montmorillonite: Immobilization performance under accelerated ageing conditions[J]. Journal of Hazardous Materials, 2020, 387: 122005.

