毛蘭素通過CCL2-CCR2信號軸介導的免疫逃避抑制食管癌細胞的惡性進展
王 靜, 袁兆林, 李 偉
(山東省滕州市中心人民醫院, 山東 滕州 277500)
食管癌(EC)是全球最致命的惡性腫瘤之一,近年來其發病率在急劇增加[1]。盡管EC患者的管理和治療有所改善,但總體5年生存率依然較低。因此仍需要開發更安全新型藥物,進而優化現有的治療方法,以改善EC預后,提高EC患者的生活質量。毛蘭素(Erianin)是從傳統中藥石斛中提取出來的,具有抗癌、抗菌、抗氧化和改善糖尿病腎病等多種藥理活性。大量研究表明,毛蘭素抑制腫瘤遷移,侵襲和血管生成以及誘導炎癥,細胞凋亡、自噬和G2/M周期停滯來發揮其抗癌活性[2-3]。C-C趨化因子配體2(CCL2)又名單核細胞趨化蛋白-1(MCP-1)通過參與腫瘤免疫耐受調節,誘導腫瘤血管生成,促進腫瘤細胞生長與存活、侵襲和轉移,從而在腫瘤的發生發展中發揮重要作用[4]。CCL2在EC腫瘤中異常高表達,與C-C趨化因子受體2(CCR2)相互作用,與EC患者的預后密切相關,在EC病變過程中,CCL2-CCR2軸募集腫瘤相關巨噬細胞(TAM),通過PD-1信號誘導免疫逃逸[5]。但毛蘭素通過CCL2-CCR2信號軸介導的免疫逃避對EC細胞增殖、遷移、侵襲和凋亡的影響還不甚清楚,因此本實驗旨在探討毛蘭素對EC細胞增殖、遷移、侵襲和凋亡的影響及其作用機制,以期為臨床治療EC提供一定參考價值。
1 材料與方法
1.1標本收集和細胞來源:2021年3月至2022年12月期間在本院根治手術治療的EC患者(40例),收集癌組織及距離癌組織3cm處的癌旁組織。所有患者均未接受化療或放療等形式的治療,且簽署了知情同意書,本研究獲得本院倫理委員會的批準。人正常食管上皮細胞HEEC及人EC細胞ECA109、EC9706、TE-1購于美國ATCC。
1.2主要試劑與儀器:毛蘭素(J13282)上海金穗生物科技有限公司;MTT試劑盒(MH1001)江蘇麥格生物科技有限公司;實時熒光定量PCR試劑盒(IBIO-C583)、IFN-γ(IB-E10033)、IL-2(IB-E10055)、TNF-α(IB-E10131)ELISA試劑盒江西艾博因生物科技有限公司;兔源一抗PCNA(ab152112)、Bax(ab182733)、PD-L1(ab239749)、CCL2(ab214819)、CCR2(ab223366)、GAPDH(ab9485)以及辣根過氧化物酶標記的羊抗兔二抗(ab6721)美國Abcam公司;多功能酶標儀(LD-96A)山東萊恩德智科技有限公司;離心機(型號:5424)艾本德中國有限公司;實時熒光定量PCR儀(CFX96 Touch)上海艾研生物科技有限公司;光學顯微鏡(CX31)日本奧林巴斯公司;流式細胞儀(NOVOCYTE3130)美國艾森公司。
1.3方 法
1.3.1qRT-PCR法檢測CCL2、CCR2的表達:組織和細胞的總RNA用Trizol試劑提取。以RNA為模板合成cDNA后,再以cDNA為模板配置qRT-PCR反應體系。CCL2上游引物:5'-TCATAGCTACCACCATCAGTCCTCAG-3'和下游引物:5'-CTGGCTGCTTGTGATTCTCCTGTAG-3';CCR2上游引物:5'-CGCTTCGGCAGCATTACT-3'和下游引物:5'-GTCGAGATGGGATACCCTT-3';GAPDH上游引物:5'-CTTTGGTATCGTGGAAGGACTC-3'和下游引物:5'-GTAGAGGCAGGGATGATGTTCT-3';以2-ΔΔCT法計算組織和細胞中CCL2、CCR2的相對表達量。
1.3.2毛蘭素對ECA109細胞增殖活性的影響:將ECA109細胞以1×104/孔,接種到96孔板中常規培養,設6個復孔,培養24h后,加入含0、10、20、40、60、80、160nmoL/L毛蘭素的培養液48h后加入MTT溶液20μL/孔。再培養4h后,每孔加入二甲基亞砜150μL。在酶標儀上于490nm波長處檢測各孔的吸光度(OD490)值,計算細胞增殖抑制率(%)和半數抑制濃度(IC50)。
1.3.3細胞干預與分組:將ECA109細胞分為control組、毛蘭素低、中、高劑量組、pcDNA組、pcDNA-CCL2組,使用轉染試劑盒進行轉染,毛蘭素低、中、高劑量組用20、40、60nmoL/L毛蘭素進行干預48h,pcDNA組、pcDNA-CCL2組用60nmoL/L毛蘭素干預48h,隨后qRT-PCR法檢測轉染效率。
1.3.4細胞增殖檢測:1.3.2中MTT試劑盒方法檢測各組ECA109細胞增殖。另取轉染后的各組ECA109細胞按照800~1000個細胞接種于6孔板中,連續培養14d,固定后用0.5%結晶紫溶液染色觀察集落形成數。
1.3.5細胞遷移與侵襲實驗:轉染后的ECA109細胞生長至對數期時,使用涂有Matrigel基質膠的Transwell小室進行侵襲實驗,遷移實驗未涂有Matrigel基質膠,各組細胞取200μL(2×105)細胞懸液加入上室,下室加入600μL含10%FBS的DMEM培養基,培養24h,固定染色,顯微鏡下隨機選取5個視野計算穿膜細胞數。
1.3.6細胞凋亡檢驗:收集各組細胞,以預冷的PBS洗滌2次,添加100μL結合緩沖液懸浮各組ECA109細胞,Annexin V-FITC和PI染液避光染色15min,重懸后,使用流式細胞儀檢測細胞凋亡。
1.3.7CD8+T細胞增殖和凋亡及上清中IFN-γ、IL-2、TNF-α水平檢測:使用Ficoll試劑盒從健康志愿者全血中分離和純化人類外周血單核細胞,再用流式細胞儀從外周血單核細胞中分離出CD8+T細胞。將CD8+T分為T細胞組(CD8+T細胞)、共培養組(ECA109和CD8+T細胞共培養)、毛蘭素組(ECA109和CD8+T細胞共培養+80nmoL/L毛蘭素)、pcDNA組(轉染后ECA109和CD8+T細胞共培養+80nmoL/L毛蘭素)、pcDNA-CCL2組(轉染后ECA109和CD8+T細胞共培養+80nmoL/L毛蘭素),通過Transwell小室將ECA109細胞和CD8+T細胞共培48h,收集各組細胞,MTT法和流式細胞儀檢測CD8+T細胞增殖和凋亡,根據ELISA試劑盒說明書,檢測CD8+T細胞上清中IFN-γ、IL-2、TNF-α水平。
1.3.8PCNA、Bax、PD-L1、CCL2、CCR2蛋白檢測:采用Western blot法檢測PCNA、Bax、PD-L1、CCL2、CCR2蛋白表達,PCNA、Bax、PD-L1、CCL2、CCR2及GAPDH一抗稀釋液按照1∶1500稀釋,HRP標記的二抗按照1∶1000稀釋,實驗結束后,以GAPDH為內參,采用Image J軟件分析各蛋白表達。

2 結 果
2.1CCL2、CCR2在組織和細胞中的表達:與癌旁組織比較,EC組織中CCL2、CCR2蛋白及mRNA表達水平降低,差異具有統計學意義(P<0.05),見圖1和表1;與HEEC細胞比較,ECA109、EC9706、TE-1細胞中CCL2、CCR2蛋白及mRNA表達水平降低(P<0.05),且ECA109細胞中CCL2、CCR2蛋白及mRNA表達水平最低,差異具有統計學意義,因此,選擇ECA109細胞進行后續實驗,見圖2和表2。

表1 CCL2 CCR2在癌旁組織和EC組織中的表達比較
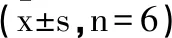
表2 不同EC細胞中CCL2 CCR2的表達比較

圖1 癌旁組織和EC組織中CCL2、CCR2蛋白表達

圖2 不同EC細胞中CCL2、CCR2蛋白表達
2.2毛蘭素對ECA109細胞的增殖抑制情況:與0 μmoL/L比較,ECA109細胞增殖抑制率在0、10、20、40、60、80、160nmoL/L毛蘭素干預下以劑量依賴性的方式顯著增加(P<0.05),IC50分別為74.30nmoL/L,本研究選取20、40、60nmoL/L毛蘭素進行后續實驗。見表3。
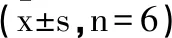
表3 不同濃度的毛蘭素對ECA109細胞的增殖抑制率
2.3毛蘭素對ECA109細胞中CCL2、CCR2表達的影響:與control組比較,毛蘭素低、中、高劑量組ECA109細胞中CCL2、CCR2 mRNA表達水平降低(P<0.05);與pcDNA組比較,pcDNA-CCL2組ECA109細胞中CCL2、CCR2 mRNA表達水平升高(P<0.05),見表4。
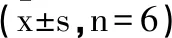
表4 各組ECA109細胞中CCL2 CCR2表達比較
2.4毛蘭素對ECA109細胞增殖能力的影響:與control組比較,毛蘭素低、中、高劑量組ECA109細胞OD490值、集落形成數顯著降低(P<0.05);與pcDNA組比較,pcDNA-CCL2組ECA109細胞OD490值、集落形成數顯著升高(P<0.05),見圖3和表5。
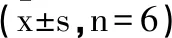
表5 各組ECA109細胞OD490值集落形成數比較

圖3 各組細胞集落形成數比較
2.5毛蘭素對ECA109細胞遷移與侵襲能力的影響:與control組比較,毛蘭素低、中、高劑量組ECA109細胞遷移與侵襲細胞數顯著降低(P<0.05);與pcDNA組比較,pcDNA-CCL2組ECA109細胞遷移與侵襲細胞數顯著升高(P<0.05),見圖4和表6。
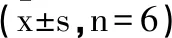
表6 各組ECA109細胞遷移與侵襲細胞數比較

圖4 Transwell小室檢測ECA109細胞遷移與侵襲
2.6毛蘭素對ECA109細胞凋亡的影響:與control組比較,毛蘭素低、中、高劑量組ECA109細胞凋亡率顯著升高(P<0.05);與pcDNA組比較,pcDNA-CCL2組ECA109細胞凋亡率顯著降低(P<0.05),見圖5和表7。
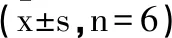
表7 各組ECA109細胞凋亡率比較

圖5 各組ECA109細胞凋亡情況比較
2.7毛蘭素對免疫細胞及免疫因子的影響:與T細胞組比較,共培養組CD8+T細胞OD490值、IFN-γ、IL-2、TNF-α水平降低,細胞凋亡率增加(P<0.05);與共培養組比較,毛蘭素組CD8+T細胞OD490值、IFN-γ、IL-2、TNF-α水平升高,細胞凋亡率降低(P<0.05);與pcDNA組比較,pcDNA-CCL2組CD8+T細胞OD490值、IFN-γ、IL-2、TNF-α水平降低,細胞凋亡率增加(P<0.05),見圖6和表8。
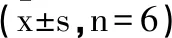
表8 各組CD8+T細胞增殖凋亡和IFN-γ IL-2 TNF-α水平比較
2.8毛蘭素對ECA109細胞內PCNA、Bax、PD-L1、CCL2、CCR2蛋白表達水平的影響:與control組比較,毛蘭素低、中、高劑量組ECA109細胞內PCNA、PD-L1、CCL2、CCR2蛋白表達水平顯著降低,Bax蛋白表達水平顯著升高(P<0.05);與pcDNA組比較,pcDNA-CCL2組ECA109細胞PCNA、PD-L1、CCL2、CCR2蛋白表達水平顯著升高,Bax蛋白表達水平顯著降低(P<0.05),見圖7和表9。
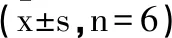
表9 各組ECA109細胞中PCNA Bax PD-L1 CCL2 CCR2蛋白表達比較

圖7 ECA109細胞內中PCNA、Bax、PD-L1、CCL2、CCR2蛋白表達
3 討 論
EC是最具侵襲性的癌癥之一,其病死率較高,嚴重威脅患者的身體健康和生活質量。因此,揭示EC發生的關鍵分子機制,對于提高EC患者的治療水平具有重要意義。
毛蘭素在體內和體外因具有良好的抗腫瘤活性而備受關注。毛蘭素通過激活PI3K/Akt信號通路抑制三陰性乳腺癌細胞的增殖并誘導細胞周期停滯和凋亡[6]。毛蘭素通過調節Nrf2、ALOX12通路,誘導細胞脂質過氧化和鐵死亡,從而抑制膀胱癌、腎癌細胞生長[7-8]。毛蘭素通過線粒體凋亡和激活JNK途徑抑制膀胱癌細胞生長[9]。本研究發現,毛蘭素抑制ECA109細胞的增殖、遷移、侵襲,促進其凋亡,由此推測,毛蘭素可作為治療EC的潛在藥物。
目前發現,腫瘤細胞具有抑制腫瘤微環境中T細胞分泌TNF-α、IL-2和IFN-γ的能力,從而有利于腫瘤細胞逃逸免疫細胞的免疫檢查,在惡性腫瘤治療中,調節免疫抑制途徑發揮了重要作用,PD-L1信號通路是腫瘤免疫抑制的重要組成部分,可抑制T淋巴細胞活化,增強腫瘤細胞免疫耐受性,從而實現腫瘤免疫逃逸。此外研究發現,毛蘭素具有免疫調節的作用。毛蘭素顯著影響肝癌中免疫相關細胞因子(TNF-α、CCL2)水平[10]。CD47通常在腫瘤細胞中上調以逃避先天免疫,毛蘭素通過調節CD47啟動子上的H3K27乙酰標記富集來降低CD47的表達,增強巨噬細胞的吞噬作用,抑制結直腸癌細胞生長[11]。毛蘭素可增加肺癌小鼠的胸腺指數,IL-2和TNF-α水平,降低IL-10水平和脾臟指數,增強肺癌小鼠的免疫功能[12]。毛蘭素抑制PD-L1表達并增強細胞毒性及T淋巴細胞活性,增強宮頸癌細胞的免疫應答,從而抑制宮頸癌細胞血管生成、增殖、侵襲和遷移。本研究發現,毛蘭素能升高CD8+T細胞的OD490值及細胞內IFN-γ、IL-2、TNF-α的水平,降低CD8+T細胞凋亡率及PD-L1蛋白表達。提示,毛蘭素可通過促進免疫細胞增殖及提高免疫因子的水平,抑制免疫細胞凋亡,抑制ECA109細胞的惡性行為,從而起到抗EC的作用。
CCL2是免疫系統中重要調節因子,CCL2-CCR2通路的激活可抑制免疫細胞活化,利于惡性腫瘤的發展。越來越多的研究表明,在前列腺癌、黑色素瘤、乳腺癌、肺癌和肝癌等不同的實驗模型中,抑制CCL2可以清除炎性單核細胞和巨噬細胞,減少腫瘤的生長和轉移[5-6]。在EC中,研究表明CCL2表達增加與巨噬細胞浸潤和腫瘤侵襲有關[6]。本研究發現,毛蘭素能抑制CCL2、CCR2 mRNA及蛋白表達,并且過表達CCL2后,升高了CCL2、CCR2 mRNA表達及免疫因子水平,抑制免疫細胞增殖、促進其凋亡,從而減輕毛蘭素對ECA109細胞惡性行為的抑制作用。提示,毛蘭素可能通過抑制CCL2-CCR2信號通路,增強免疫細胞和免疫因子水平,從而抑制ECA109細胞的惡性行為。
綜上所述,毛蘭素可能通過抑制CCL2-CCR2信號通路,增強免疫細胞和免疫因子水平,從而抑制ECA109細胞增殖、遷移、侵襲,促進其凋亡。為治療EC提供了新的參考,但本研究尚有不足之處,僅僅在細胞水平上驗證了毛蘭素的作用,并未在體內水平上進行探討,后續研究將會在體內水平上進行進一步探索。

