ST段抬高型心肌梗死患者并發心肌內出血危險因素及風險預測模型建立
高光仁, 馮連榮, 李 毅, 王佳傲, 張倩玉, 張 軍
滄州市中心醫院1.心血管內科;2.神經內科,河北 滄州 061000;3.北部戰區總醫院 心血管內科,遼寧 沈陽 110016
近年來,發達國家ST段抬高型心肌梗死(ST-segment elevation myocardial infarction,STEMI)患者病死率顯著改善,但我國急性心肌梗死病死率仍呈整體上升趨勢[1]。早期再灌注治療是STEMI的標準治療方案。但再灌注損傷增加了梗死面積,部分抵消了再灌注獲益。心肌內出血(intramyocardial hemorrhage,IMH)是恢復心外膜冠狀動脈血流后組織灌注不良的病理表現之一[2]。IMH反映了紅細胞的聚集和溢出,是微血管嚴重受損的表現[3]。因此,早期發現IMH并給予干預尤為重要。但目前,仍缺乏理想的可用于IMH早期預測的生物標志物。本研究旨在探討STEMI患者并發IMH的獨立危險因素,同時聯合多項危險因素構建聯合預測因子,評價其預測價值。現報道如下。
1 對象與方法
1.1 研究對象 回顧性分析自2018年10月至2021年10月滄州市中心醫院收治的283例STEMI患者的臨床資料。納入標準:參照相關指南[4]診斷為STEMI;發病至入院時間<15 d;院內行冠狀動脈造影;發病3~15 d于我院行心臟磁共振成像(cardiac magnetic resonance,CMR)檢查。排除標準:陳舊性心肌梗死病史。依據有無IMH將患者分為有IMH組(n=62)與無IMH組(n=221)。本研究經醫院倫理委員會批準。所有研究對象均簽署知情同意書。
1.2 研究方法 所有患者經皮冠狀動脈介入治療(percutaneous transluminal coronary intervention,PCI)前均口服負荷劑量阿司匹林300 mg聯合替格瑞洛180 mg(或氯吡格雷300 mg),然后阿司匹林100 mg/d聯合氯吡格雷75 mg/d(或替格瑞洛90 mg,2次/d)口服至少1年。通過電子病歷系統收集患者的臨床資料,包括性別、年齡、入院收縮壓、入院舒張壓、入院心率、前壁梗死、左室射血分數、既往史、介入情況、實驗室指標、住院用藥等。CMR檢查具體方法參照文獻[5],采用CVI42軟件分析圖像,應用T2-STIR序列評價IMH。

2 結果
2.1 兩組患者一般資料比較 有IMH組男性比例、前壁梗死比例、白細胞計數、肌酸激酶、肌酸激酶同工酶(creatine kinase isoenzyme,CKMB)、直接膽紅素、中性粒細胞計數、中性粒細胞與淋巴細胞比例(neutrophil to lymphocyte ratio,NLR)高于無IMH組,既往PCI比例、三支病變比例、左室射血分數低于無IMH組,差異有統計學意義(P<0.05)。見表1。
2.2 影響因素分析及聯合預測因子構建 單因素分析結果顯示,男性、前壁梗死、白細胞計數、肌酸激酶、CKMB、直接膽紅素、NLR及中性粒細胞計數升高為STEMI患者并發IMH的危險因素,而三支病變、左室射血分數升高為STEMI患者并發IMH的保護因素(P<0.05)。多因素Logistic回歸分析結果顯示,CKMB、直接膽紅素及中性粒細胞計數為STEMI患者并發IMH的獨立危險因素(P<0.05)。見表2。Hosmer-lemeshow擬合優度檢驗結果χ2=6.720,P=0.567。通過對Logistic回歸的模型方程進行轉換得到聯合預測因子的計算公式,即L聯合=CKMB+直接膽紅素×34.8+中性粒細胞計數×18.6,其中,L聯合表示聯合預測因子。
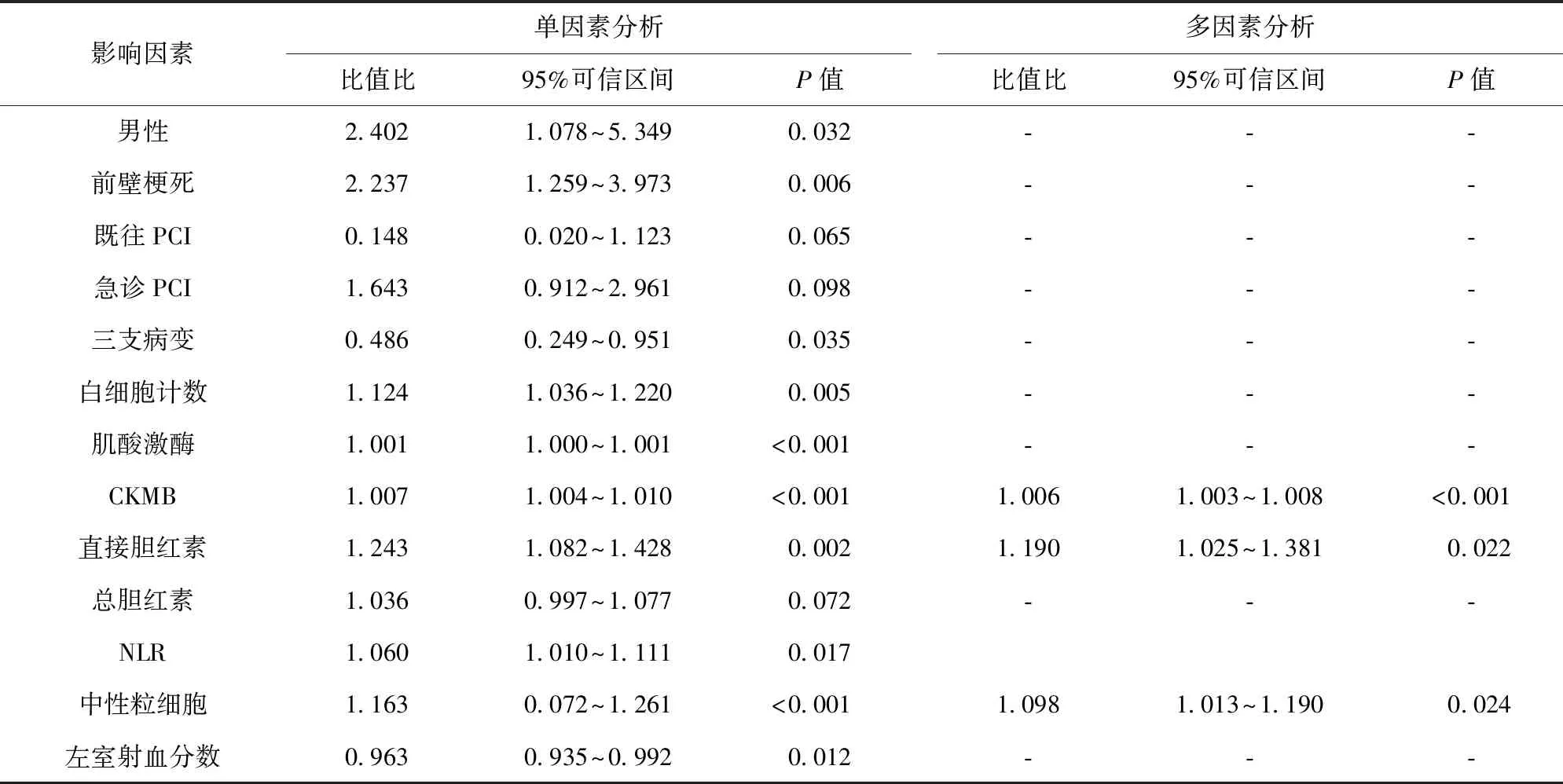
表2 單因素及多因素Logistic回歸分析結果
2.3 聯合預測因子的ROC曲線分析結果 ROC曲線分析結果顯示,中性粒細胞計數、直接膽紅素、CKMB、聯合預測因子的ROC曲線下面積分別為0.682、0.596、0.648、0.720,差異有統計學意義(P<0.05)。聯合預測因子的截斷值為390。見表3、圖1。
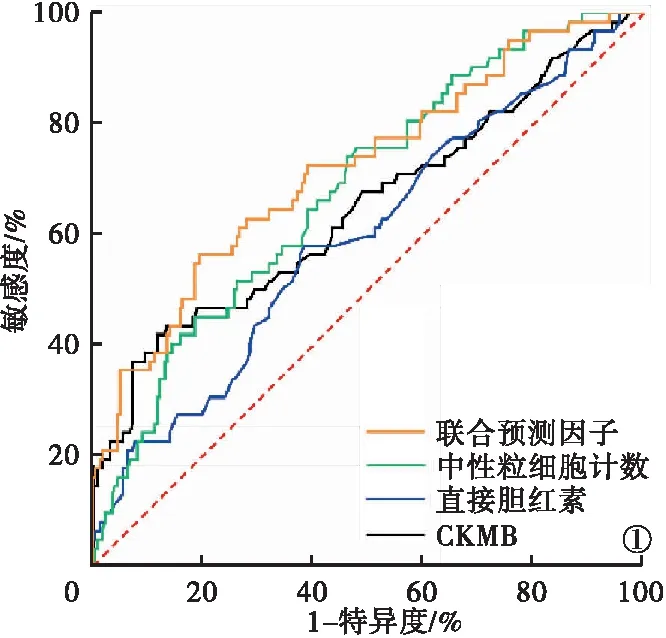
圖1 ROC曲線
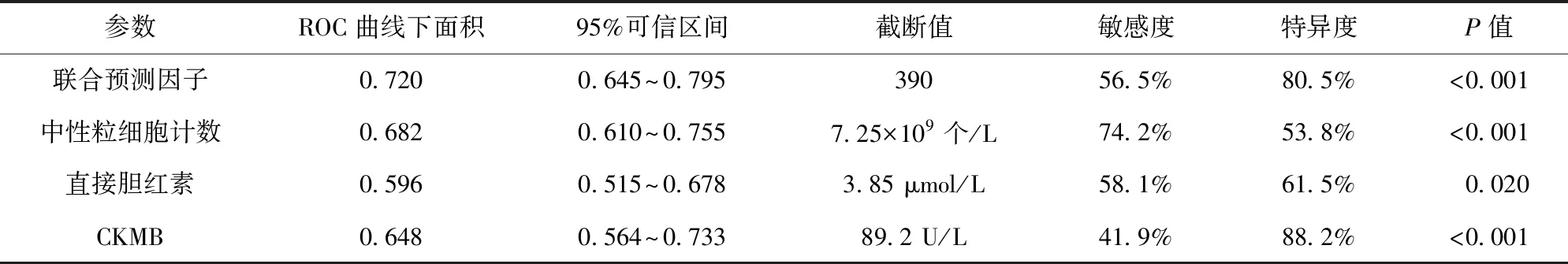
表3 ROC曲線分析結果
3 討論
早期再灌注是治療STEMI患者的關鍵方法,但再灌注損傷增加了近50%的最終梗死面積[6],部分抵消了再灌注帶來的獲益。IMH發生于再灌注的梗死心肌[7]。再灌注后,心肌損傷可能發生 “波前現象”,這與缺血節段的“波前現象”鏡像呼應[8]。再灌注治療后,微血管可能依然存在微循環阻塞(microvascular obstruction,MVO),且MVO區域在再灌注后持續擴展達48 h[9]。此外,MVO區域內也會合并微血管結構損傷,導致IMH。IMH在再灌注介導的梗死面積擴展過程中發揮關鍵作用,是梗死面積的關鍵因素[6]。雖然,紅細胞在攜氧轉運方面發揮關鍵作用,但其進入組織間隙后是有害的,再灌注后IMH通過外部擠壓和痙攣損傷微血管,使缺氧區域擴大[10]。紅細胞溶血產生的血紅素對心肌細胞有毒害作用。直接膽紅素作為紅細胞代謝過程的中間產物,是急性心肌梗死患者遠期全因死亡的獨立危險因素[11]。本研究發現,有IMH組直接膽紅素水平高于無IMH組,推測IMH患者紅細胞分解增多可能是直接膽紅素水平升高的原因之一,需要進一步研究證實。
有研究報道,前壁心肌梗死與IMH的發生相關[2,12-13]。本研究發現,IMH組前壁梗死比例更高,單因素分析顯示,前壁梗死是STEMI患者發生IMH的危險因素,但在納入包括中性粒細胞計數、直接膽紅素、CKMB等因素后,該影響不再顯著。有研究報道,再灌注后的冠狀動脈內膜和中膜可以觀察到中性粒細胞涌入,浸潤的中性粒細胞分泌MMP-9,導致血管壁基底膜完整性減弱,中性粒細胞釋放的MMP-9可能是發生IMH的潛在機制[14-15]。本研究發現,基線中性粒細胞計數水平增高與STEMI患者發生IMH密切相關,這也證實了炎性因子在IMH發生發展中的重要性。有研究報道,中位缺血時間163 min的STEMI患者入院后行急診PCI,在入院4 h至1周內,IMH組中性粒細胞顯著高于對照組,且在入院4 h中性粒細胞水平達到峰值[16],與本研究結果一致。STEMI患者發生MVO包含多種機制,包括血栓殘渣的遠端血栓栓塞、白細胞浸潤、血管收縮、炎癥通路的激活,以及細胞水腫[17]。IMH繼發于微血管破壞及缺氧,包括紅細胞溢出至血管外組織間隙并聚集。再灌注增加了內皮交界處的滲漏和損傷,導致紅細胞在組織血管外間隙溢出[18-19]。Kali等[20]在一項臨床前研究中提出假設,梗死區域中血紅蛋白降解產物轉化為鐵結晶,這些鐵結晶導致促炎性反應延長。而持續廣泛的炎癥又導致了左室重構,增加了梗死后遠期心血管事件的發生風險[21]。
本研究ROC曲線分析結果顯示,聯合預測因子預測STEMI并發IMH的截斷值為390,即聯合預測因子≤390時發生IMH的可能性較小。聯合預測因子較單純中性粒細胞計數、直接膽紅素及CKMB具有較高的預測價值。因此,聯合預測因子可以作為STEMI患者發生IMH較為合理和可行的風險評估指標之一。本研究存在局限性:為單中心回顧性分析;納入患者為發病15 d內行CMR檢查者,而IMH在該段時間內可能存在動態變化,后續將完善亞組分析;本研究采用T2序列評價IMH,而采用T2*更敏感準確,后續將以T2*序列作為評價手段;缺少外部數據對該模型的驗證,后續將采用多中心前瞻性研究進一步驗證。
綜上所述,中性粒細胞計數、直接膽紅素及肌酸激酶同工酶為STEMI患者發生IMH的獨立危險因素,聯合預測因子對STEMI患者發生IMH具有良好的預測價值。

