血清三葉因子、程序性死亡配體1、糖類抗原153、癌胚抗原在乳腺癌診斷及預后中表達及意義
丁興龍 , 李慶妍, 霍 青, 杜沙莎, 張先娥, 李洪春
徐州醫科大學第二附屬醫院1.檢驗科;2.藥劑科,江蘇 徐州 221006;3.徐州醫科大學 醫學技術學院,江蘇 徐州 221000
乳腺癌為臨床常見惡性腫瘤之一,我國乳腺癌發病率呈遞增趨勢,以45~49歲較為高發[1-3]。盡早診斷乳腺癌對提高治療效果及改善預后尤為重要。血清腫瘤標志物檢測是用于惡性腫瘤篩查與預后評估的常用手段,其中以糖類抗原153(carbohydrate antigen 153,CA153)、癌胚抗原(carcinoembryonic antigen,CEA)在乳腺癌診斷中較為常用。有研究報道,血清三葉因子(trefoil factor family 1,TFF1)、程序性死亡配體1(programmed death-ligand-1,PD-L1)在乳腺癌中呈較高表達,在乳腺細胞增殖、凋亡中有一定的調控作用[4]。本研究旨在探討TFF1、PD-L1、CA153、CEA在乳腺癌診斷及預后中的表達及意義,為臨床診治提供參考。現報道如下。
1 資料與方法
1.1 一般資料 選取徐州醫科大學第二附屬醫院自2020年9月至2021年9月收治的200例可疑性乳腺癌患者為研究對象。納入標準:因乳腺腫塊、疼痛、乳頭溢液、糜爛或皮膚凹陷等癥狀就診;經影像學檢查有明確活檢指征或手術指征后,行病理穿刺活檢或手術病理檢查;資料完整且能配合隨訪。排除標準:既往有病灶切除史者;合并其他惡性腫瘤或存在放化療史者;檢查前1個月存在影響相關檢測指標藥物治療史者;合并嚴重免疫性、血液性疾病或其他嚴重器官疾病者。根據病理檢查結果將患者分為良性組(n=133)與惡性組(n=67)。良性組:平均年齡(50.8±8.5)歲;平均體質量指數(23.46±24.57)kg/m2;合并糖尿病23例。惡性組:平均年齡(51.1±9.0)歲;平均體質量指數(23.16±3.01)kg/m2;合并糖尿病11例。兩組患者一般資料比較,差異無統計學意義(P>0.05),具有可比性。本研究經醫院倫理委員會批準。所有患者均簽署知情同意書。
1.2 研究方法 采集所有患者空腹靜脈血5 ml,以3 000 r/min離心15 min后,獲得血清樣本,并將血清樣本分為2份,置于-20℃冰箱中保存待檢。采用酶聯免疫吸附試驗法(enzyme linked immunosorbent assay,ELISA)對患者血清TFF1水平進行檢測。采用免疫組化法對PD-L1進行檢驗,根據陽性細胞占組織所有細胞比例與陽性細胞染色深淺進行計分。顯色細胞占比<5%為0分;顯色細胞占比5%~25%為1分;顯色細胞占比26%~50%為2分;顯色細胞占比51%~75%為3分;顯色細胞占比>75%為4分。陽性細胞染色深淺計分:無顯色為0分;淺黃色(1+)為1分;棕色(2+)為2分;深褐色(3+)為3分。采用化學發光免疫法對患者血清CA153、CEA進行檢測。
1.3 觀察指標 比較兩組患者TFF1、PD-L1、CA153、CEA水平,并評估其診斷效能[5]。對惡性組患者進行為期1年的隨訪,統計其存活率。分析TFF1、PD-L1、CA153、CEA水平表達對患者預后的判斷價值。
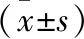
2 結果
2.1 兩組患者TFF1、PD-L1、CA153、CEA水平比較 惡性組患者TFF1、PD-L1、CA153、CEA水平均高于良性組,差異均有統計學意義(P<0.05)。見表1。
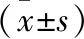
表1 兩組患者TFF1、PD-L1、CA153、CEA水平比較
2.2 TFF1、PD-L1、CA153、CEA單獨及聯合對乳腺癌診斷效能比較 TFF1、PD-L1、CA153、CEA單獨及聯合診斷的ROC曲線見圖1。ROC曲線顯示,TFF1+PD-L1+CA153+CEA聯合診斷的ROC曲線下面積(area under the curve,AUC)、靈敏度、特異度、準確度高于各項指標單獨檢測。見表2。
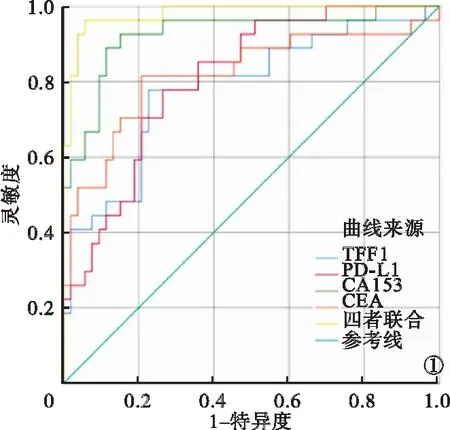
圖1 TFF1、PD-L1、CA153、CEA單獨及聯合診斷乳腺癌的ROC曲線
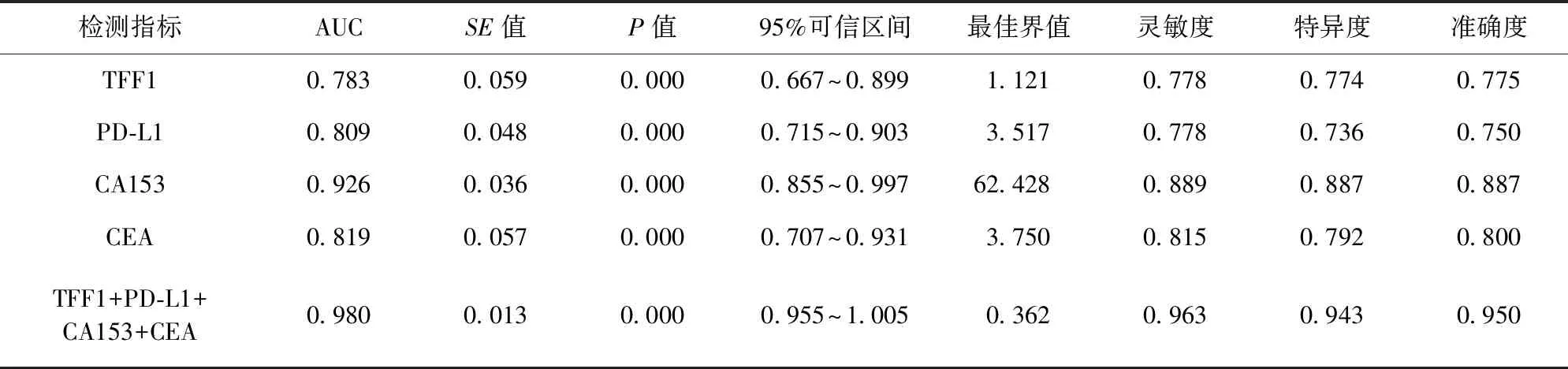
表2 TFF1、PD-L1、CA153、CEA單獨及聯合對乳腺癌診斷效能比較
2.3 TFF1、PD-L1、CA153、CEA單獨及聯合對預后診斷效能 隨訪1年后,67例惡性組患者中,17例死亡,50例存活,存活率為74.63(50/67)。TFF1+PD-L1+CA153+CEA聯合對預后診斷的AUC、靈敏度、特異度、準確度均較高。見表3。
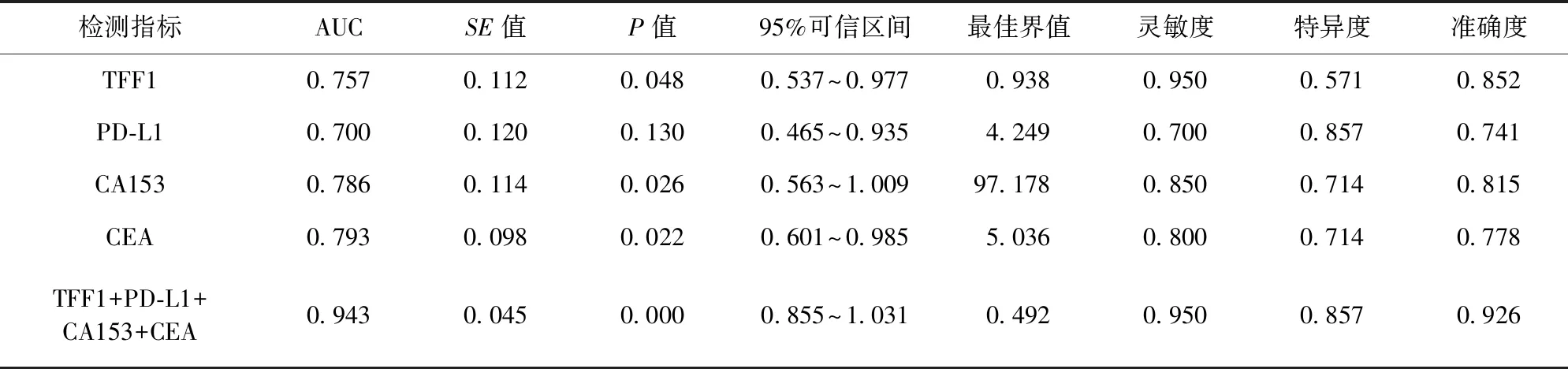
表3 TFF1、PD-L1、CA153、CEA單獨及聯合對預后診斷效能
3 討論
近年來,乳腺癌發病率不斷升高且呈年輕化趨勢,加強對乳腺癌的篩查成為臨床關注的焦點。遺傳、婚育、飲食模式、肥胖等均可成為誘發乳腺癌的因素[6-7]。
乳腺鉬靶攝片、病理活檢是目前臨床用于鑒別乳腺良惡性腫瘤的主要方式,但由于價格、操作便捷性以及創傷性等問題,用于早期篩查有一定的局限性[8]。與影像學或病理活檢相比,腫瘤標志物由于檢測便捷、可重復操作以及能夠對預后起到一定的預測作用,逐漸成為臨床診斷惡性腫瘤的常用手段。CA153、CEA是乳腺癌診斷的常用腫瘤標志物,在陽性患者中通常呈高表達。有研究報道,TFF1、PD-L1均參與乳腺癌的發生發展,對臨床診斷與疾病預后監測有一定效果[9-10]。
本研究結果顯示,惡性組患者TFF1、PD-L1、CA153、CEA水平均高于良性組,差異均有統計學意義(P<0.05)。這提示,TFF1、PD-L1、CA153、CEA表達水平與乳腺癌惡性程度具有相關性,乳腺惡性腫瘤細胞的增殖及腫瘤組織的擴大均會持續刺激機體產生TFF1、PD-L1、CA153及CEA。有研究報道,TFF1為腫瘤抑制因子,但在乳腺癌中的表達水平變化表明其可能與腫瘤發生、發展具有正相關性[11]。本研究中ROC曲線發現,各項指標診斷乳腺癌的AUC≥0.78,特異度、靈敏度均較高,準確度≥75%。這說明,乳腺癌患者CA153、CEA、TFF1、PD-L1水平呈高表達狀態,對腫瘤良惡性均具有一定的鑒別診斷價值。CA153是由癌細胞粘蛋白1基因表達的特異性腫瘤標志物,當腺體細胞發生癌變時,激活細胞膜上的糖基轉化酶,造成唾液酶、蛋白酶活性升高,繼而使得腺體細胞骨架、癌細胞膜上CA153過量表達,導致淋巴因子激活殺傷細胞和細胞毒性細胞被抑制[9-10]。CEA是一種非特異性腫瘤標志物,其在健康人群肝、胰腺組織中有少量表達[11]。TFF1作為三葉因子家族成員之一,主要在胃腸道黏膜表達,其能夠與黏膜蛋白結合,起到保護、修復胃腸道屏障功能的作用。在正常的乳腺組織中,TFF1往往呈低表達狀態,當其水平升高時,可造成雌激素分泌紊亂,并促進細胞內細胞周期蛋白D1的表達,由此加速細胞增殖,誘發乳腺癌發生[12]。程序性死亡受體1(programmed cell death protein-1,PD-1)屬于免疫調控分子,主要在活化的T細胞中表達,起到抑制T細胞活性以調節免疫系統平衡的作用。PD-L1主要在抗原遞呈細胞、活化的T淋巴細胞、巨噬細胞中表達,能夠抑制T細胞增值與細胞因子產生的作用[13-16]。當PD-L1與PD-1結合后,可反向活化T細胞傳遞抑制型號,誘導T細胞凋亡,從而促進惡性腫瘤的發生與發展。本研究結果還發現,TFF1+PD-L1+CA153+CEA聯合對預后診斷的AUC、靈敏度、特異度、準確度均較高。這說明,CA153、CEA、TFF1、PD-L1的表達對惡性患者預后的預測有一定價值。隨著CA153、CEA、TFF1、PD-L1水平升高,機體對于免疫細胞、T細胞的抑制作用增強,進而導致免疫系統對癌細胞增殖、分化、轉移的抑制作用減弱,并形成惡性循環,進一步增加CA153、CEA、TFF1、PD-L1的表達水平[17-20]。
綜上所述,血清TFF1、PD-L1、CA153、CEA均在乳腺惡性腫瘤中呈高表達,4者聯合用于乳腺癌診斷及其預后評估效果較好。

