肥胖/超重對哮喘發作期患兒Th1/Th2和Th17/Treg細胞因子的影響
丁肖媛 戴勁盛 焦榮紅 馬素麗 朱海峰 吳夢雅 車艷然 張 蕾
(1.上海市浦東新區人民醫院兒科,上海 201299;2.上海市浦東新區人民醫院檢驗科,上海 201299)
支氣管哮喘是兒童常見的慢性呼吸道疾病。近20年來,我國兒童哮喘患病率呈明顯上升趨勢,2010年全國14歲以下城市兒童的哮喘患病率為3.02%[1]。與此同時,兒童肥胖人群數量也在不斷增長,流行病學統計結果顯示,2000年,我國7~18歲男、女性肥胖檢出率分別為4.94%~8.41%、2.25%~4.85%[2-3]。肥胖患兒不僅存在代謝紊亂,同時也伴隨著慢性炎癥,會導致一系列的合并癥。有研究結果顯示,超重是肥胖和哮喘的高危因素,而肥胖和哮喘之間存在著復雜的交互機制[4],肥胖兒童哮喘的嚴重程度顯著高于正常體重的哮喘患兒[5-6]。2014年,肥胖型哮喘作為新的哮喘表型被全球哮喘防治創議(Global Initiative for Asthma,GINA)提出[7]。2020年,GINA指出,肥胖可能是哮喘發病的危險因素[8]。與過敏性哮喘不同的是,肥胖型哮喘可能由的輔助性T細胞(T helper cell,Th)2機制介導的[9]。為此,本研究擬探討肥胖/超重合并哮喘患兒在哮喘急性發作期血清瘦素、白細胞介素(interleukin,IL)6、外周血Th1炎癥因子[腫瘤壞死因子α(tumor necrosis factor-alpha,TNF-α)]、Th2炎癥因子(IL-10、IL-13)、Th17細胞炎癥因子(IL-17F)和調節性T細胞(regulatory T-cell,Treg)炎癥因子(IL-35)水平的變化,并分析其與體重指數(body mass index,BMI)的關系,探討超重/肥胖合并哮喘的發病機制。
1 材料和方法
1.1 研究對象
選取2020年1月—2021年12月上海市浦東新區人民醫院哮喘發作期患兒112例,符合《兒童支氣管哮喘診斷與防治指南(2016年版)》中的診斷標準[10]。收集所有患兒的年齡、性別、身高和體重數據,年齡精確到月,身高精確到1 cm,體重精確到0.1 kg,計算BMI。根據《中國0~18歲兒童、青少年體塊指數的生長曲線》中不同年齡、性別的BMI標準[11],將哮喘患兒分為哮喘組[56例,其中男40例、女16例,年齡(4.39±1.57)歲,BMI為(16.16±0.71)kg/m2]和肥胖/超重合并哮喘組[56例,其中男36例、女20例,年齡(4.46±1.77)歲,BMI為(19.70±2.33)kg/m2]。同時選取符合超重、肥胖診斷標準[11]的非哮喘患兒56例(肥胖/超重組),其中男41例、女15例,年齡(4.13±1.59)歲,BMI為(19.35±2.20)kg/m2。3組之間年齡、性別差異均無統計學意義(P>0.05),BMI差異有統計學意義(P<0.001)。本研究經上海市浦東新區人民醫院倫理委員會批準(prylz2020-101),所有患兒監護人均簽署知情同意書。
1.2 方法
采集所有患兒空腹靜脈血3 mL,室溫下靜置30 min,以1 500×g離心5 min,分離血清,-80 ℃保存待測。采用酶聯免疫吸附試驗檢測血清瘦素、IL-6、TNF-α、IL-10、IL-13、IL-17F和IL-35水平,試劑盒均購自美國CUSABIO公司(貨號分別為CSB-E04649h、CSB-E04638h、CSB-E04740h、CSB-E04593h、CSB-E04601h、CSB-E15916h、CSB-E13126h)。檢測儀器為Microlab STAR全自動酶免分析儀(瑞士Hamilton公司)。
1.3 統計學方法
采用SPSS 23.0軟件進行統計分析。呈非正態分布的計量資料以中位數(M)[四分位數(P25~P75)]表示,組間比較采用Kruskal Wallis檢驗,兩兩比較采用Mann WhitneyU檢驗,采用Bonferroni法控制假陽性。計數資料以例或率表示,組間比較采用χ2檢驗或Fisher精確檢驗。采用Spearman相關分析評估各項指標之間的相關性。以P<0.05為差異有統計學意義。
2 結果
2.1 哮喘組、肥胖/超重合并哮喘組和肥胖/超重組各項指標比較
哮喘組、肥胖/超重合并哮喘組和肥胖/超重組之間血清IL-6、IL-10、IL-13和瘦素水平比較,差異均有統計學意義(P<0.05)。肥胖/超重合并哮喘組血清TNF-α水平高于哮喘組(P<0.05)。肥胖/超重組血清IL-17F水平高于哮喘組和肥胖/超重合并哮喘組(P<0.05)。哮喘組血清IL-35水平高于肥胖/超重合并哮喘組和肥胖/超重組(P<0.05)。見表1。
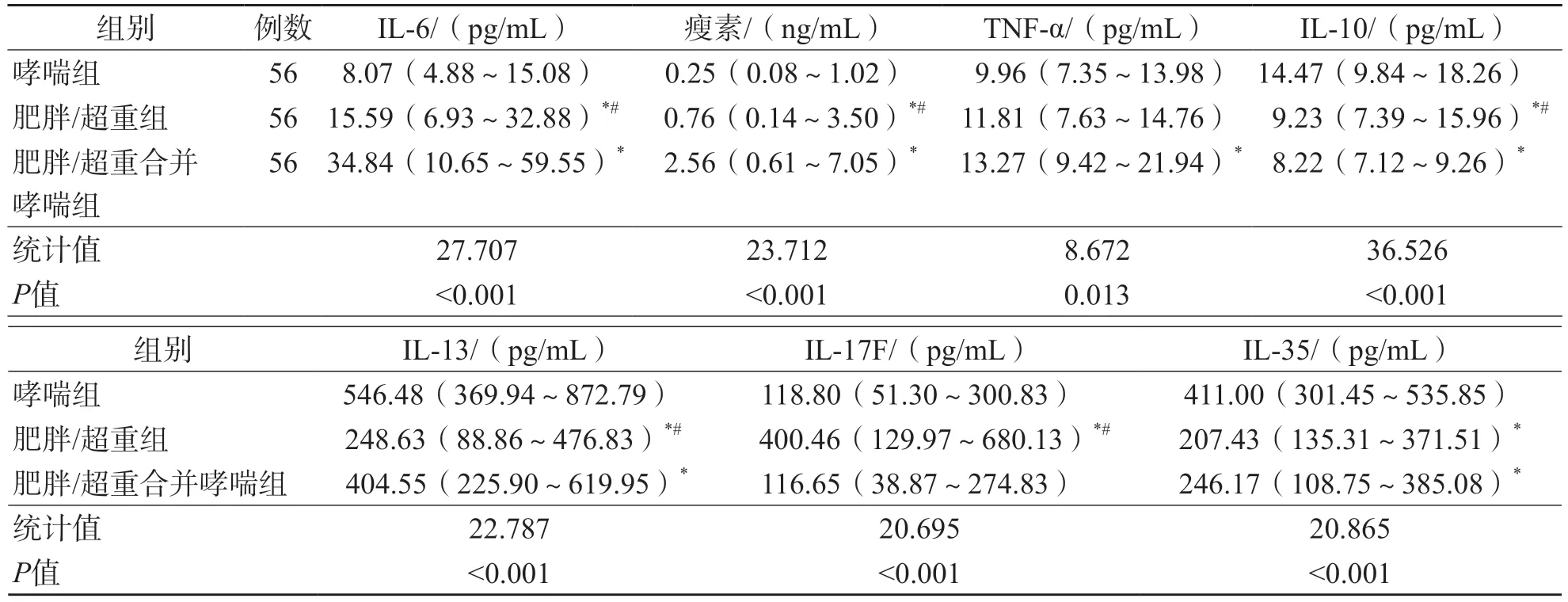
表1 3組之間血清IL-6、TNF-α、IL-10、IL-13、IL-17F、IL-35和瘦素水平比較
2.2 各組BMI與各項指標之間的相關性
將肥胖/超重合并哮喘患兒和肥胖/超重非哮喘患兒進一步分為超重合并哮喘組、肥胖合并哮喘組、超重組和肥胖組。Spearman相關分析結果顯示,超重合并哮喘組、肥胖合并哮喘組、超重組和肥胖組BMI與IL-6呈正相關(r值分別為0.515、0.510、0.515、0.432,P<0.05)。超重合并哮喘組、肥胖合并哮喘組和肥胖組BMI與瘦素呈正相關(r值分別為0.488、0.578、0.546,P<0.05),與IL-35呈負相關(r值分別為-0.491、-0.517、-0.524,P<0.05)。見表2。

表2 各組BMI與IL-6、TNF-α、IL-10、IL-13、IL-17F、IL-35和瘦素的相關性
3 討論
哮喘是一類由包括嗜酸性粒細胞、中性粒細胞、T淋巴細胞、肥大細胞等在內的多種炎癥細胞和氣道平滑肌細胞、上皮細胞等氣道結構細胞,以及細胞組分參與的慢性氣道炎癥性疾病。有研究結果顯示,哮喘患兒IL-4、IL-5和IL-13水平均高于喘息性支氣管炎患兒(P<0.01),基于IL-4、IL-5和IL-13構建的風險評分模型鑒別重癥哮喘的敏感性為90.24%[12]。Th1/Th2失衡(表現為IL-4、IL-5、IL-13高表達,IL-2、γ-干擾素(interferon gamma,IFN-γ)低表達,以Th2占優)介導了過敏性哮喘的發作。Th17/Treg失衡是哮喘發病的另一機制,Th17分化過多,產生IL-6和IL-17,造成中性粒細胞的炎性浸潤,在臨床上表現為喘息癥狀嚴重,且激素療效不佳的哮喘表型[13-14]。中性粒細胞是哮喘患者氣道中IL-6的主要來源[15]。有學者認為肥胖型哮喘可能不是由Th2介導的,更有可能是Th1型或中性粒細胞炎癥表型[16]。
IL-6是一種促炎細胞因子,包括T細胞、髓系細胞和內皮細胞在內的多種細胞均可分泌[17]。動物實驗結果顯示,外界壓力會誘導小鼠棕色脂肪細胞分泌IL-6,導致棕色脂肪細胞無法正常調節葡萄糖等物質的代謝和脂肪分解,最終造成肥胖,并引起相關并發癥[18]。有研究結果顯示,肥胖兒童Th1呈高表達,可分泌更多的IL-6、IFN-γ和TNF-α[19-20]。肥胖可促進Th1的細胞因子IFN-γ升高,減少Treg的分化,BMI與Treg呈負相關(r=-0.404 4,P=0.035 5)[21]。本研究結果顯示,肥胖/超重合并哮喘組、肥胖/超重組和哮喘組IL-6和TNF-α水平依次降低(P<0.05);Spearman相關分析結果顯示,超重合并哮喘患兒、肥胖合并哮喘患兒、超重患兒和肥胖患兒BMI與IL-6呈正相關(r值分別為0.515、0.510、0.515、0.432,P<0.05)。提示在超重/肥胖合并哮喘患兒中,IL-6和TNF-α可能參與了哮喘急性期的發病,肥胖型哮喘存在Th1介導的炎癥因子水平升高。
瘦素可刺激脂肪細胞分泌IL-6、TNF-α、IL-12等促炎癥因子[22-23],刺激外周血單個核細胞(peripheral blood mononuclear cell,PBMC)分泌IL-6和TNF-α[24]。有研究結果顯示,哮喘患者瘦素水平顯著高于健康對照者(P<0.05),且哮喘發作期患兒瘦素水平顯著高于無癥狀期哮喘患兒(P=0.025)[25]。提示瘦素可能參與了肥胖型哮喘的發病。本研究結果顯示,肥胖/超重合并哮喘組、肥胖/超重組、哮喘組瘦素水平依次降低(P<0.05),且超重合并哮喘組、肥胖合并哮喘組和肥胖組BMI與瘦素呈正相關(r值分別為0.488、0.578、0.546,P<0.05)。由于本研究未納入健康對照兒童和哮喘穩定期的兒童,因此無法驗證瘦素參與哮喘的機制。有研究結果顯示,瘦素可促進Th1的分化和活化,同時抑制Th2分泌IL-4、IL-5和IL-10,激活Th17的前炎癥因子[26-28]。本研究結果顯示,肥胖/超重合并哮喘組IL-10和IL-13水平均低于哮喘組(P<0.05),提示肥胖/超重患兒的哮喘可能不是由Th2介導的。
動物實驗結果顯示,敲除TNF-α受體的肥胖小鼠能耐受氣道高反應的固有免疫反應,且IL-17表達降低[29]。BANTULà等[30]針對成人的研究結果顯示,瘦素可刺激脂肪細胞釋放炎癥因子,激活M1巨噬細胞內的核苷酸結合寡聚化結構域樣受體蛋白3(nucleotide-binding domainlike receptor protein 3,NLRP3),導致脂肪細胞內的IL-1β升高,進而激活3型先天淋巴細胞(innate lymphoid cell type-3,ILC3),同時產生IL-17。本研究結果顯示,肥胖/超重合并哮喘組和哮喘組之間IL-17F水平差異無統計學意義(P>0.05),與文獻[30]不一致。原因可能為:1)研究對象不同,本研究為兒童,文獻[30]為成人;2)本研究檢測的是IL-17F,未檢測IL-17A(又稱IL-17)。
IL-12細胞因子家族包括IL-12、IL-23、IL-27和IL-35,其中IL-35是最新的家族成員,具有促進Treg增殖的作用。MA等[31]的研究結果顯示,哮喘患兒IL-35 mRNA和蛋白表達均下調,血清IL-35水平與血清IL-4水平呈負相關(r=-0.352,P=0.032 7),與IFN-γ水平呈正相關(r=356.9,P=0.022 0)。LI等[32]的研究結果顯示,在類風濕關節炎患者中,超重者血清IL-35水平明顯低于消瘦者(P<0.05)。目前尚未見肥胖型哮喘患兒IL-35水平的研究。本研究結果顯示,肥胖/超重合并哮喘組和肥胖/超重組的IL-35水平均低于哮喘組(P<0.05),且超重合并哮喘患兒、肥胖合并哮喘患兒和肥胖患兒BMI與IL-35呈負相關(r值分別為-0.491、-0.517、-0.524,P<0.05),肥胖合并哮喘患兒和肥胖患兒BMI與IL-35的r值更高,提示肥胖可能參與了IL-35表達的下調。由于本研究未納入健康對照組,缺乏健康兒童與肥胖兒童IL-35水平的比較,未來需進一步驗證。
綜上所述,肥胖/超重會引起Th1/Th2失衡,哮喘患兒在發作期以Th2介導為主,肥胖/超重合并哮喘患兒則以Th1介導為主。

