CMV和EBV共感染可影響造血干細胞移植患者預后
張 娜 牛偉華 孫媛媛 賈 玫
(北京大學人民醫院檢驗科,北京 100044)
巨細胞病毒(cytomegalovirus,CMV)和EB病毒(Epstein-Barr virus,EBV)是普遍存在的人類特異性DNA病毒,屬于皰疹病毒科,在免疫抑制/移植患者和先天性感染新生兒中起重要作用[1]。CMV和/或EBV感染是異基因造血干細胞移植(hematopoietic stem cell transplantation,HSCT)后常見的并發癥,可引發致命的病毒相關性疾病,如移植后淋巴增生性疾病[2-3]。相關研究結果表明,CMV或EBV感染降低了HSCT患者的生存率[4-5],但對CMV和EBV共同感染與HSCT患者預后的研究較少。本研究收集HSCT患者的臨床基本資料和病毒感染情況,分析CMV和EBV共感染與HSCT患者預后的相關性,以期對患者的抗病毒治療和疾病轉歸相關研究提供參考。
1 材料和方法
1.1 研究對象
收集2018年1月—2019年1月北京大學人民醫院血液科327例接受HSCT的患者,其中男193例、女134例,年齡(34.55±12.10)歲。根據患者HSCT術后CMV和EBV感染情況,分為共感染組(75例)、單一感染組(165例)、無感染組(87例)。本研究經北京大學人民醫院倫理委員會批準( 2018PHB155-01)。
1.2 方法
1.2.1 CMV DNA和EBV DNA檢測
采集所有患者乙二胺四乙酸抗凝全血2 mL,離心后取上層血漿,提取DNA。采用實時熒光定量聚合酶鏈反應(polymerase chain reaction,PCR)檢測患者CMV DNA和EBV DNA載量,每周2次。CMV DNA檢測試劑盒購自上海之江生物科技股份有限公司,EBV DNA檢測試劑盒購自廣州達安基因股份有限公司,Light Cycler擴增儀購自瑞士Roche公司。PCR擴增條件:37 ℃孵育3 min,95 ℃預變性1 min,93 ℃變性5 s,60 ℃退火40 s,40個循環。以CMV DNA≥1 000 拷貝/mL,EBV DNA≥500 拷貝/mL為陽性。嚴格按儀器和試劑說明書要求進行操作。
1.2.2 患者臨床基本資料收集
收集所有患者的臨床資料,包括性別、年齡、疾病類型[急性髓系白血病(acute myeloid leukemia,AML)、急性淋巴細胞白血病(acute lymphoblastic leukemia,ALL)、骨髓增生異常綜合征(myelodysplastic syndrome,MDS)]、人白細胞抗原(human leukocyte antigen,HLA)位點、輸入單個核細胞(mononuclear cell,MNC)數量、輸入CD34+細胞數量、急性移植物抗宿主病(acute graft versus host disease,aGVHD)和慢性移植物抗宿主病(chronic graft versus host disease,cGVHD)發生情況、中性粒細胞和血小板植入情況、CMV血癥和EBV血癥發生情況、移植后1年總體生存率(overall survival,OS)和緩解生存率(leukemia-free survival,LFS)。
1.2.3 干預措施
所有患者在行HSCT術前2~9 d給予更昔洛韋1周預防病毒感染。對HSCT術后CMV DNA陽性患者,靜脈注射磷甲酸酯(每天90 mg/kg)或更昔洛韋(5 mg/kg,Bid),直至連續2次未檢出CMV DNA;對于EBV DNA陽性患者,行利妥昔單抗治療。
1.3 統計學方法
采用SPSS 25.0軟件進行統計分析。非正態分布計量資料用中位數(四分位間距)表示,比較采用非參數U檢驗。計數資料以例或率表示,組間比較采用χ2檢。采用 Kaplan-Meier生存曲線分析不同病毒感染情況患者的預后。采用Cox比例回歸分析評價影響HSCT患者預后的危險因素。以P<0.05為差異有統計學意義。
2 結果
2.1 HSCT患者的基本特征
327例HSCT患者中,男性占59.0%(193/327),≤40歲患者占69.1%(226/327)。AML患者所占比例最高(47.1%,154/327)。HLA匹配方面,半相合在共感染組中所占比例明顯高于其他組(P<0.05)。見表1。
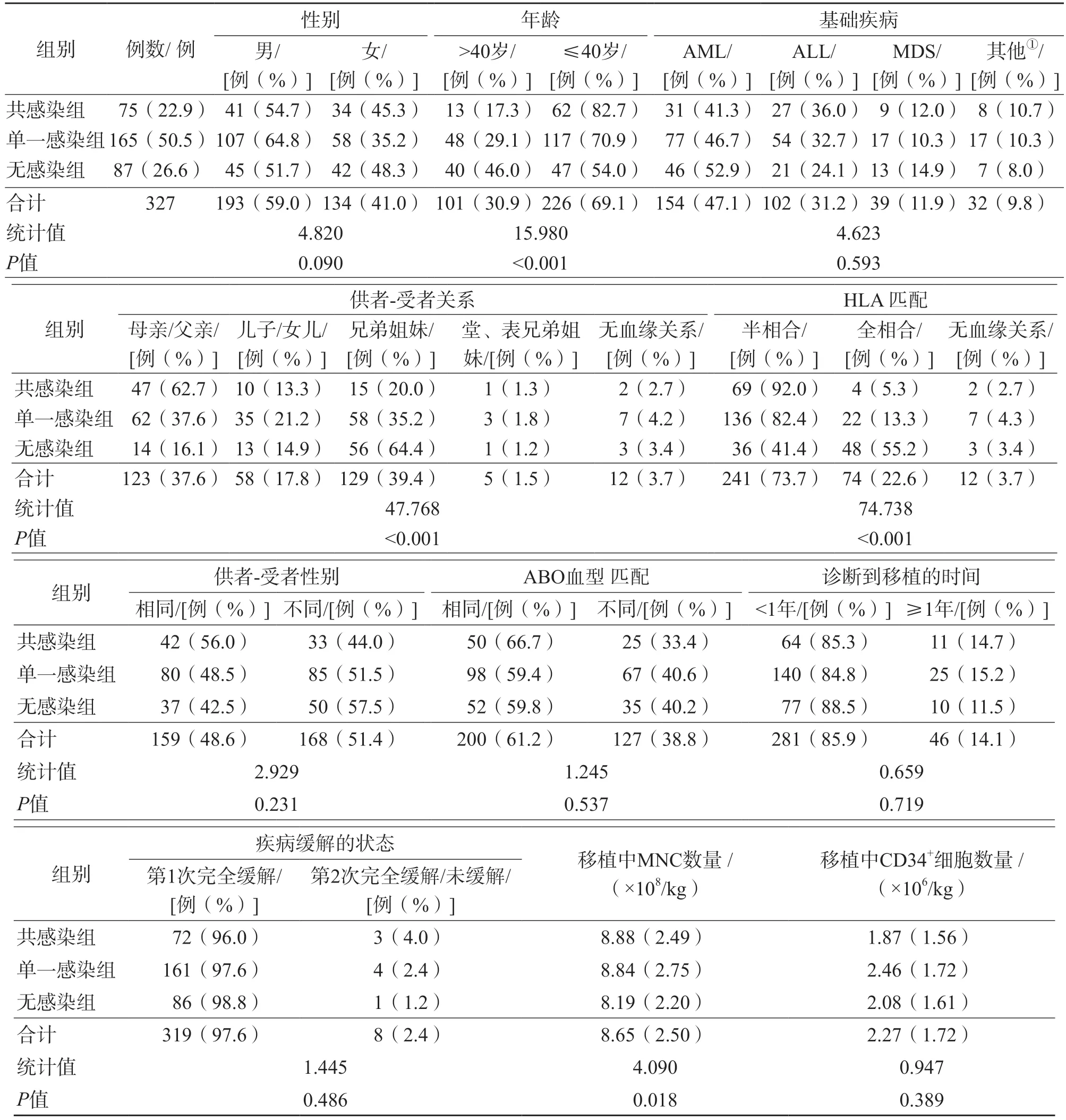
表1 HSCT患者基本特征
2.2 共感染組、單一感染組、無感染組相關臨床指標比較
共感染組、單一感染組、無感染組aGVHD發生率分別為56.3% 、61.0%、37.0%,差異有統計學意義(P=0.002)。共感染組CMV和EBV感染持續時間均明顯長于單一感染組(P<0.05)。共感染組移植后第1次感染EBV的時間早于單一感染組(P<0.001);共感染組EBV最高病毒載量高于單一感染組(P<0.001)。見表2。

表2 CMV和EBV病毒感染對患者HSCT后的影響
2.3 CMV和EBV感染狀況與HSCT患者預后的關系
共感染組、單一感染組、無感染組1年OS分別為86.7%、85.4%和95.4%,差異有統計學意義(P=0.044);共感染組、單一感染組、無感染組1年LFS差異無統計學意義(P=0.444)。見表2。
Kaplan-Meier生存曲線分析結果顯示,CMV和EBV共感染與HSCT患者術后1年OS降低有關(P=0.048),與HSCT患者術后1年LFS無關(P=0.479)。見圖1、圖2。

圖1 HSCT患者術后1年OS Kaplan-Meier生存曲線

圖2 HSCT患者術后1年LFS Kaplan-Meier生存曲線
采用Cox比例回歸分析結果顯示,校正年齡、性別、基礎疾病、HLA匹配和疾病狀態等因素后,CMV和/或EBV感染是HSCT患者術后1年OS降低的危險因素[風險比(hazardratio,HR)值分別為12.553、13.108,95%可信區間(confidence interval,CI)分別為1.456~108.230、1.683~102.062,P<0.05)。有GVHD是HSCT患者術后1年LFS的危險因素(HR=2.129,95%CI為1.152~3.935,P=0.016)。見表3。
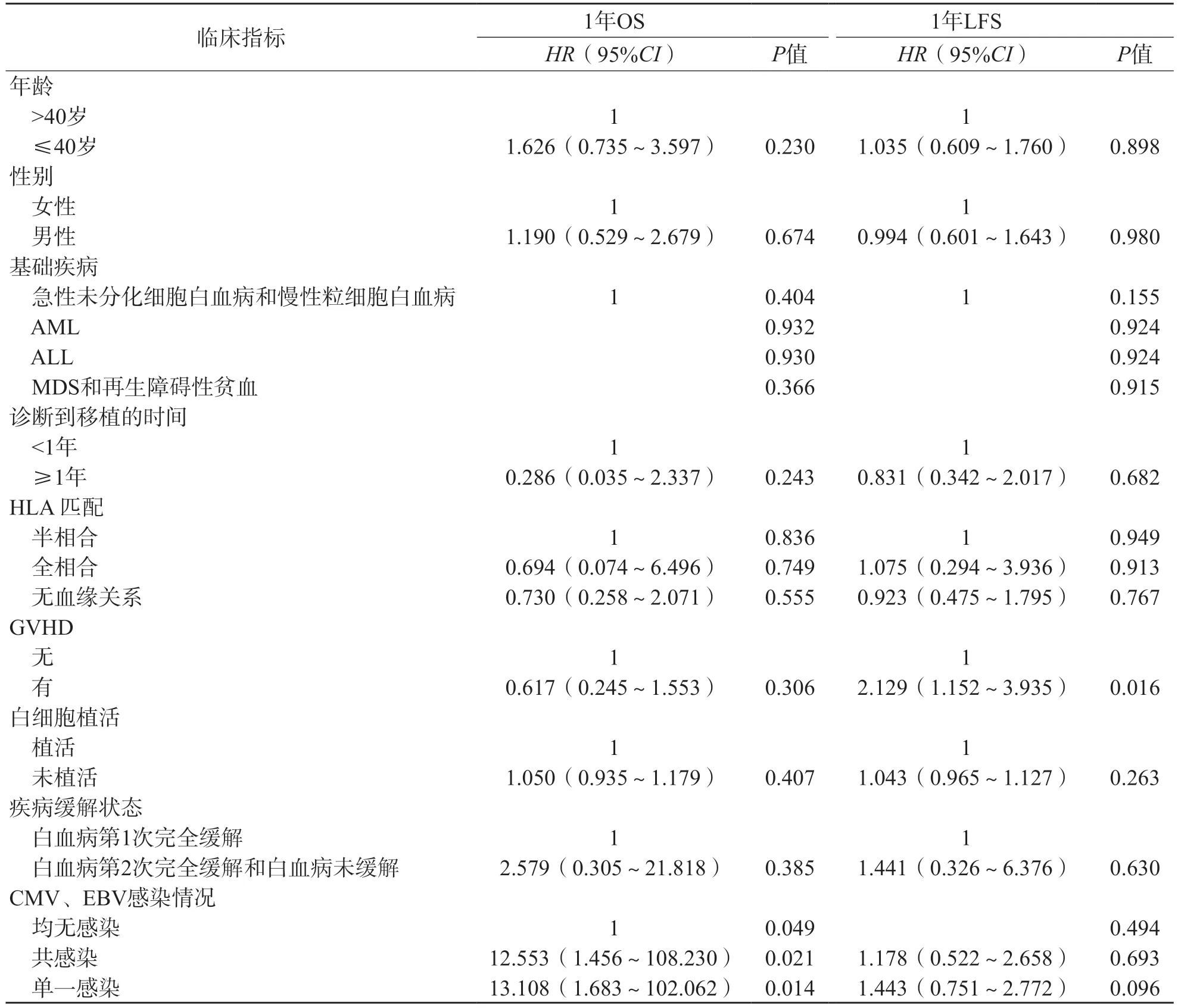
表3 HSCT患者預后影響因素
3 討論
1957年,HSCT作為一種新的癌癥治療方法被應用于臨床[6]。全球每年有5萬多例患者接受HSCT,以治療各種惡性和良性疾病[7]。HSCT患者移植后CMV感染發生率約為60%,是導致移植失敗和患者死亡的重要原因之一[8],也是GVHD和移植相關血栓性微血管病(transplantassociated thrombotic microangiopathy,TATMA)的重要危險因素之一,特別嚴重的CMV肺炎、CMV腦炎、CMV腸炎和CMV視網膜炎等可能直接導致患者死亡[9-10]。因處于深度免疫抑制狀態,移植后EBV感染患者易發生移植后淋巴組織障礙(post-transplant lymphoproliferative disorder,PTLD)[11]。本研究分析了CMV和EBV共感染與HSCT患者預后的相關性,結果顯示,≤40歲患者在CMV和EBV共感染組中所占比例明顯高于>40歲的患者(P<0.05)。CMV感染可引起慢性炎癥,導致免疫衰老、分化和T淋巴細胞、自然殺傷細胞的膨脹[12]。CMV潛伏感染和老化有助于改變T淋巴細胞的功能和表型,在青年和中年個體中,血清CMV陽性與多功能CD57+T淋巴細胞在不同刺激下的擴增有關。CMV感染和年齡對T淋巴細胞亞群的影響是不同的,CMV是高功能CD57+T淋巴細胞擴增的主要驅動力[13-14],提示在任何免疫衰老研究中,考慮CMV血清學狀態非常必要,可能與年輕患者基礎疾病和特殊的免疫狀態有關。
本研究發現,CMV和/或EBV感染是HSCT患者術后1年OS的危險因素[HR(95%CI)為12.553(1.456~108.230),P=0.021;HR(95%CI)為13.108(1.683~102.062),P=0.014]。有研究結果表明,CMV感染會降低HSCT術后患者OS[15-16]。HSCT患者在造血重建過程中,CMV特異性免疫重建、CMV易感性和感染保護能力可能因HLA型別不同而有所差異[17-18]。CMV抗原表位與細胞毒性T淋巴細胞(cytotoxic T lymphocyte,CTL)結合力的高低與HLA等位基因密切相關,HLA等位基因識別位點的空間構象差異及其與抗原肽的親和力與抗病毒免疫有重要關系[19]。EBV感染會增加成人和兒童HSCT患者的病死率[20-21]。EBV感染伴隨持續炎癥和T淋巴細胞/自然殺傷細胞克隆增殖,主要表現為淋巴液腫瘤和炎癥性疾病[22]。HSCT過程也是患者免疫系統重建的過程,而此時感染CMV或EBV,病毒的免疫保護等各種免疫過程均會與患者的免疫重建互相影響,但目前尚有許多機制不明。
綜上所述,CMV和EBV共感染會導致HSCT后患者1年總病死率升高。移植后的免疫系統重建和病毒感染免疫是極其復雜、多變的過程,但目前機制不明。限于本研究觀察例數的限制,需要進一步設計多中心前瞻性研究,來驗證本研究成果,以便為臨床應用提供最直接的指導。

