規模豬場的豬瘟凈化新思路及實例初探
吳麗艷 王 楊 曾容愚 韓金鳳 戴 琦
(1 佳和農牧股份有限公司,湖南長沙 410000;2 天康生物制藥有限公司,江蘇蘇州 215028)
豬瘟(Classical swine fever,CSF)是由豬瘟病毒(Classical swine fever virus,CSFV)引起的一種急性、熱性、高度接觸性傳染病,因其對養豬業危害嚴重,該病被世界動物衛生組織(OIE)列入須申報的動物疫病目錄,我國將其列為一類動物傳染病[1,2]。豬瘟對養豬業的危害主要表現在以下4 方面,一是造成了嚴重的經濟損失;二是阻礙養豬業的健康發展,挫傷養豬生產者的積極性;三是造成母豬帶毒綜合癥和先天感染仔豬,嚴重影響母豬的繁殖性能和育肥豬的生產性能,降低飼料報酬、延遲上市時間,影響種豬和豬肉銷售;四是造成豬只出現免疫抑制和免疫耐受,嚴重影響豬群健康水平,增加其他豬病防控難度等[3-6]。由于豬瘟對養豬業的危害較大,因此,被定義為豬場中需要防控的最重要的疫病之一[7]。
動物疫病凈化是經過國內外實踐證明了的非常有效的疫病消滅方法[8],歐盟于20 世紀80 年代開始實施豬瘟凈化項目,主要是通過采用C 株疫苗免疫,降低感染率,然后再采取非免疫和撲殺策略,并通過限制生豬及豬產品的流通,從而使一些國家凈化了豬瘟[9,10]。我國豬瘟凈化的難點主要存在于生物安全防范不嚴格、疫苗免疫覆蓋率低、免疫不到位及綜合防控措施不到位等[11,12]。2018 年我國發生非洲豬瘟后,集約化進程越來越快,新建豬場生物安全等級更高,同時豬瘟標記疫苗及相應配套的鑒別診斷技術也開始發展與成熟,在抵御非洲豬瘟疫情的前提下,豬瘟凈化時機及條件均已具備[13]。豬瘟凈化按進程分為免疫凈化階段和非免疫凈化階段,在免疫凈化階段,疫苗的防治作用仍不容忽視,國內許多規模化豬場一直使用豬瘟兔化弱毒疫苗(C 株)來防控豬瘟,但由于弱毒疫苗對保存和運輸溫度、免疫程序和免疫時機具有較高的要求,同時不能阻斷病毒的傳播途徑,且誘導產生的抗體與野生毒株誘導產生的抗體因極其相似而無法區別[14,15],因此,需要通過豬瘟標記疫苗來實現豬瘟凈化。區別于豬瘟活疫苗、豬瘟E2 亞單位疫苗的唯一抗原為豬瘟病毒E2 蛋白,是最主要的保護性抗原,免疫豬后只產生針對E2 的抗體。豬場可以通過對E2 疫苗免疫豬只的E0 蛋白抗體檢測,來區分免疫和野毒感染豬,進而為豬瘟的防控和凈化提供科學診斷和依據。本研究通過2 個試驗分別對比了豬瘟傳統弱毒疫苗與豬瘟E2 基因工程苗的免疫效果,并進一步驗證了豬瘟E2 基因工程苗在推進豬瘟凈化進程中的實際使用效果,以期為豬瘟凈化提供新的思路。
1 試驗材料與方法
1.1 試驗材料
豬瘟E2 基因工程苗、豬瘟傳統弱毒疫苗、英迪康CSFV Erns Ab Test Kit、IDEXX 豬瘟病毒ELISA 抗體檢測試劑盒,TaKaRa 反轉錄試劑盒,恒溫培養箱KE054N、HNGY-YQ-027、酶標儀KE082M、HNGYYQ-082、全自動核酸提取儀HNGY-YQ-109、基因擴增儀HNGY-YQ-013、電泳儀HNGY-YQ-037、凝膠成像分析系統HNGY-YQ-033 等。
1.2 試驗時間與地點
試驗于2018 年9 月至2022 年3 月在湖南省某集團規模豬場完成。
1.3 試驗方法與分組
1.3.1 2 種豬瘟疫苗免疫效果對比試驗
選擇健康的同批次保育仔豬80 頭,隨機分為試驗組和對照組,每組40 頭豬,試驗組接種豬瘟基因工程苗(E2),對照組接種傳統弱毒疫苗。分別在首免前、首免后21 d 及二免后30 d 采血,進行豬瘟抗體水平檢測,對比2 種豬瘟疫苗的實際免疫效果。
1.3.2 豬瘟E2 基因工程苗的免疫效果試驗
2019 年3 月后,豬場母豬群使用豬瘟E2 基因工程苗,商品豬繼續使用豬瘟傳統弱毒苗,持續跟蹤豬場母豬群更換使用豬瘟E2 基因工程苗后的情況,對母豬群和商品豬按照不同胎次、不同日齡進行采血檢測,并采集病死豬病料進行檢測,評估該豬場E2 和E0 的抗體水平和豬瘟野毒感染情況。試驗分組與設計詳見表1、表2 和表3。
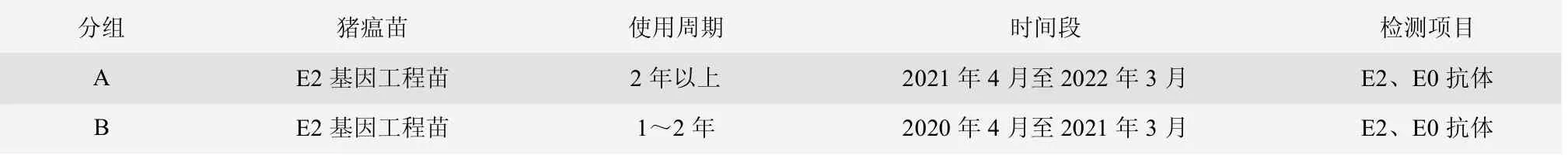
表1 試驗分組

表2 母豬群采血表

表3 商品豬群采血表
1.3.3 評估指標
豬瘟E2 抗體(IDEXX 的阻斷法);豬瘟E0 抗體(INDICAL 的間接ELISA);豬瘟病毒核酸PCR(TaKaRa 的RT-PCR)。
1.4 數據處理
用Excel 軟件進行試驗數據錄入、整理和初步分析,用SPSS 統計分析軟件進行方差分析,結果用“平均數±標準差(X±SD)”表示。P<0.05 表示有顯著差異。
2 結果與分析
2.1 豬瘟E2 抗體檢測結果
從表4、圖1、圖2、圖3 和圖4 可知,對照組豬群在首免后21 d 時豬瘟抗體陽性率為25.00%,阻斷率均值為29.40%,離散度為51.80%;試驗組豬群在首免后21 d 時的豬瘟抗體陽性率為55.00%,阻斷率均值為40.49%,離散度為27.40%。對照組豬群在二免后30 d時豬瘟抗體陽性率為80.00%,阻斷率均值為55.48%,離散度為32.70%;實驗組豬群在二免后30 d 時豬瘟抗體陽性率為100%,阻斷率均值為76.32%,離散度為10.3%。

圖1 對照組豬瘟抗體水平
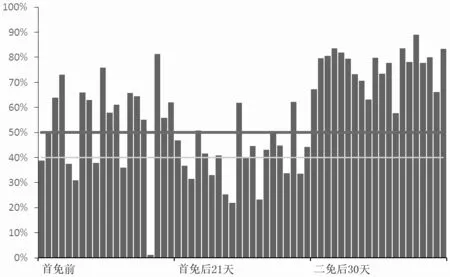
圖2 試驗組豬瘟抗體水平
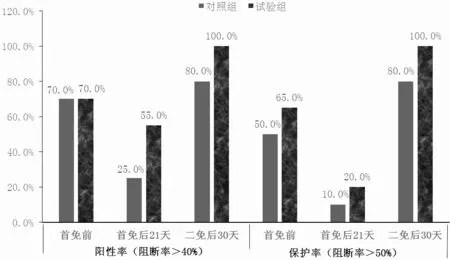
圖3 豬瘟抗體陽性率、保護率
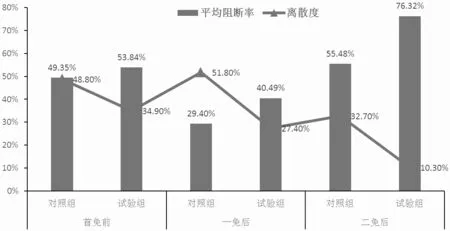
圖4 豬瘟抗體平均阻斷率、離散度
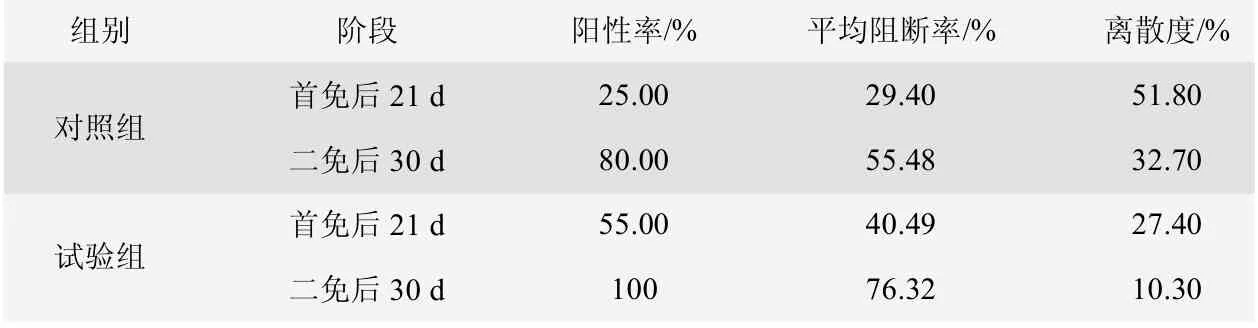
表4 免疫豬瘟疫苗后E2 抗體檢測水平
2.2 豬瘟E2 基因工程苗的免疫效果
2.2.1 豬瘟E2 抗體
由表5、圖5、圖6 可知,A 組0~2 胎次母豬的豬瘟E2 抗體陽性率為100.00%,3 胎次及以上母豬豬瘟E2 抗體陽性率為100.00%,37 日齡仔豬豬瘟E2 抗體陽性率為100.00%,58 日齡仔豬豬瘟E2 抗體陽性率為91.67%。B 組0~2 胎次母豬的豬瘟E2 抗體陽性率為100.00%,3 胎次及以上母豬豬瘟E2 抗體陽性率為100.00%,28 日齡仔豬豬瘟E2 抗體陽性率為100.00%,62 日齡仔豬豬瘟E2 抗體陽性率為100.00%。
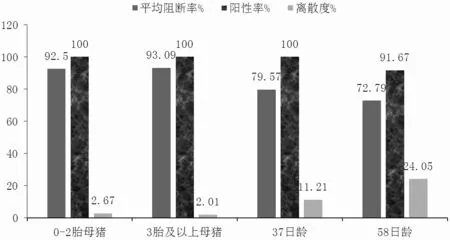
圖5 A 組豬瘟E2 抗體陽性率、平均阻斷率、離散度
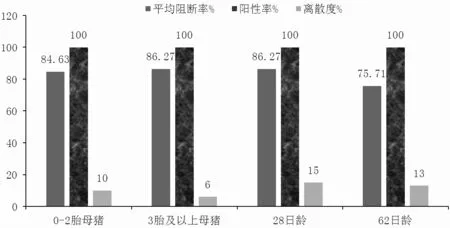
圖6 B 組豬瘟E2 抗體陽性率、平均阻斷率、離散度
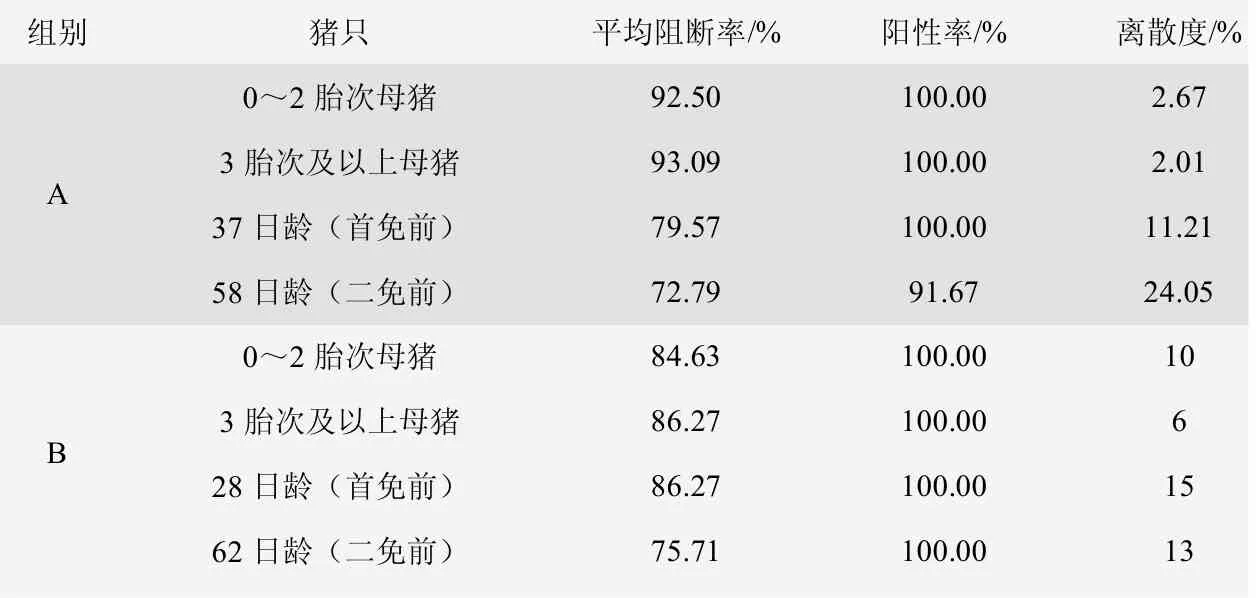
表5 豬瘟E2 抗體檢測情況表
2.2.2 豬瘟E0 抗體
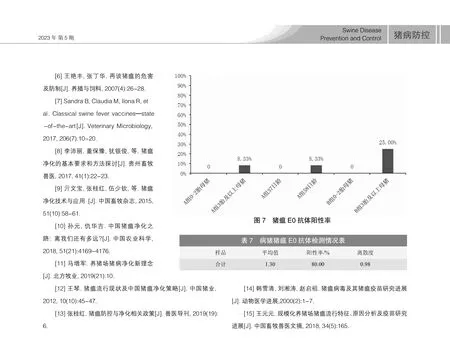
由表6、圖7 可知,A 組0~2 胎次母豬豬瘟E0 抗體陽性率為0%,3 胎次及以上母豬豬瘟E0 抗體陽性率為8.33%,37 日齡仔豬豬瘟E0 抗體陽性率為0%,58 日齡仔豬豬瘟E0 抗體陽性率為8.33%。B 組0~2 胎次母豬豬瘟E0 抗體陽性率為0%,3 胎及以上母豬豬瘟E0 抗體陽性率為25.00%。
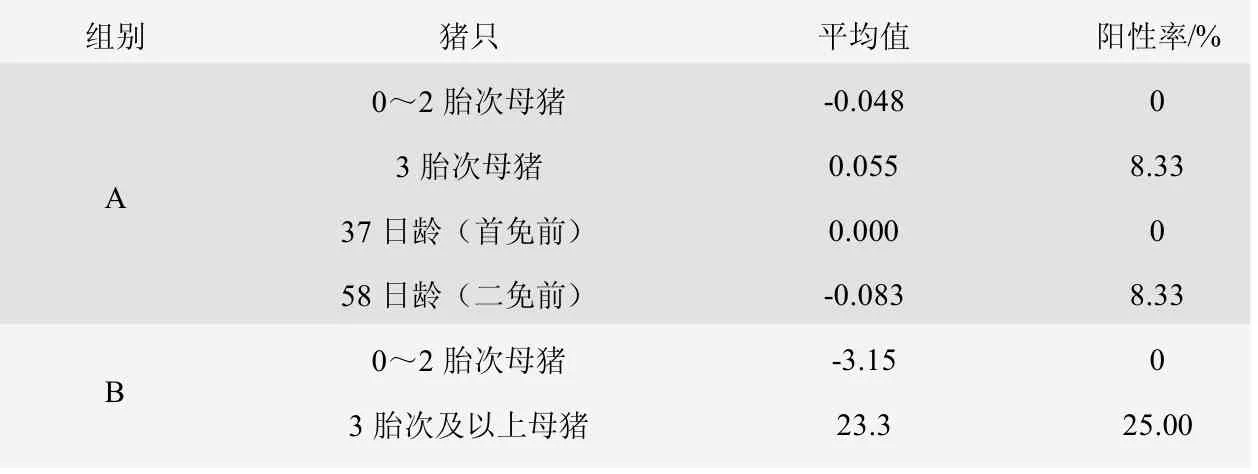
表6 豬瘟E0 抗體檢測情況表
2.2.3 病豬豬瘟E0 抗體及豬瘟病原PCR 檢測
由表7 可知,對5 頭斷奶前病豬(病死豬均采集自3 胎次以上高胎齡母豬所產仔豬)采血檢測豬瘟E0 抗體,有4 頭豬只呈陽性,陽性率80%;而對病死豬豬瘟病毒核酸檢測全部為陰性。
3 討論
傳統豬瘟弱毒苗在首免后受母源抗體影響較大,其免疫效果不佳,CSFV 抗體水平低、整齊度差,無法提供較好的保護,且在二免后其免疫效果仍不理想。豬瘟E2 基因工程苗首免后在一定程度上仍會受到母源抗體影響,但相較傳統豬瘟弱毒苗,其受影響較小。且在二免后,CSFV 抗體水平明顯上升,陽性率及保護率均達100%,抗體水平整齊度好,免疫效果佳,表明豬瘟E2亞單位疫苗在二免后能為豬群提供強有力的保護。
豬瘟E2 抗體結果顯示,A、B組母豬E2 抗體的陽性率均高達100%,A 組相較B 組整齊度更好、阻斷率更高,表明豬場更換E2 基因工程苗后,母豬的豬瘟抗體水平較高,且隨著E2 基因工程苗使用時間越長,E2 抗體整齊度越好、保護力越高;A、B 組商品豬的E2抗體水平整體均較好,首免前抗體陽性率均為100%,二免前抗體陽性率均可達90%以上,阻斷率稍低,在72%~75%;首免至二免的抗體水平變化說明目前豬場的免疫程序較合適,但仔豬首免前抗體水平較高,為減少母源抗體干擾,首免時間可從當前實施的5 周齡適當延后至6~7 周齡。
豬瘟E0 抗體檢測結果顯示,A、B 組0~2 胎次母豬E0 抗體陽性率均為0,而3 胎次及以上母豬E0 抗體陽性率均超過5%,這可能是由于豬場有過豬瘟感染史,且豬場之前使用弱毒疫苗造成的E0 抗體陽性率較高,隨著時間的推移,在母豬群調整使用豬瘟E2 基因工程苗2 年后E0 抗體陽性率從25%下降至8.33%,有明顯下降的趨勢。
5 頭病死豬的死因均與豬瘟感染無關,而其中4 頭豬的豬瘟E0抗體陽性,有可能是母豬的豬瘟E0 抗體為陽性,通過乳汁將E0 抗體傳遞給仔豬所造成的。病死豬均采集自3 胎次以上高胎齡母豬所產仔豬,該結果與上述E0 抗體結果相符,說明3 胎及以上母豬所產仔豬病癥情況更多,且隨著母豬調整使用E2 苗,E0 抗體陽性率下降明顯,病癥減輕。
綜上所述,豬場在更換E2 基因工程苗后不同時間段監測豬瘟E2 抗體水平均較好,E0 抗體陽性率也呈明顯下降的趨勢,通過核酸檢測跟蹤發現,豬場無豬瘟野毒感染,豬場在免疫豬瘟E2 苗后免疫效果較好,保護力較強。
4 結論
本研究通過評估E2 基因工程苗的實際免疫效果,并跟蹤豬場母豬群更換使用E2 苗2 年后的情況,對比使用不同豬瘟疫苗后豬場的母豬、商品豬的E0 抗體的陽性率與病原情況,了解豬場的野毒感染情況,同時通過對比使用豬瘟E2 基因工程苗與使用傳統豬瘟弱毒苗在豬瘟抗體水平及豬瘟野毒感染上的差異,驗證了使用豬瘟E2 基因工程苗豬場的豬瘟凈化效果,為指導豬場豬瘟凈化提供參考依據。
對比傳統豬瘟弱毒苗,E2 基因工程苗具有明顯優勢,且豬場在更換使用豬瘟E2 基因工程苗后豬瘟E2 抗體水平較好、保護力高,E0抗體陽性率有明顯下降的趨勢,豬場無豬瘟野毒感染現象,生產成績穩定,可以繼續依照調整后的免疫程序實施、推進豬瘟凈化進程。本研究結果初步驗證了E2 基因工程苗在臨床上評估豬瘟凈化進展的可行性,且作為豬瘟凈化的實例,具有可推廣性。