維生素A調(diào)控DDR1介導(dǎo)的細(xì)胞自噬對(duì)孤獨(dú)癥大鼠神經(jīng)行為學(xué)的影響
王凌嘯,劉 陽(yáng),袁俊梅,張 浩,王 瑞
(1. 黃淮學(xué)院直屬附屬駐馬店市中心醫(yī)院兒童康復(fù)科, 河南 駐馬店 463003;2.西安交通大學(xué)醫(yī)學(xué)部藥學(xué)院藥理學(xué)系,陜西 西安 710061;3.西安交通大學(xué)附屬兒童醫(yī)院兒童保健中心, 陜西 西安 710065)
孤獨(dú)癥譜系障礙(autism spectrum disorder,ASD)是發(fā)生于兒童發(fā)育早期的一種異質(zhì)性神經(jīng)發(fā)育障礙性疾病,主要表現(xiàn)為社會(huì)交流和交往困難、興趣范圍狹窄及重復(fù)性刻板行為,嚴(yán)重的影響兒童身心健康及生活質(zhì)量[1]。
維生素A(vitamin A,VA)是人體必需的一種脂溶性微量營(yíng)養(yǎng)素,在維持機(jī)體腦生長(zhǎng)發(fā)育及穩(wěn)態(tài)平衡中發(fā)揮重要作用。既往研究顯示,孕期VA缺乏可導(dǎo)致大腦發(fā)育異常,其中VA水平與ASD臨床癥狀表現(xiàn)呈顯著相關(guān)性[2]。另外,幼年期VA缺乏會(huì)明顯損害動(dòng)物空間學(xué)習(xí)記憶能力及社交活動(dòng)[3]。與正常嬰幼兒相比,ASD兒童血清VA水平顯著降低[4],提示VA可能與ASD疾病發(fā)生存在一定的相關(guān)性。但是,目前有關(guān)VA治療ASD的分子機(jī)制尚不完全清楚。因此,以VA為核心的ASD藥物治療機(jī)制研究尤為重要。ASD病因機(jī)制復(fù)雜,其中突觸功能障礙已成為ASD研究領(lǐng)域的焦點(diǎn)。研究發(fā)現(xiàn),自噬參與ASD突觸的形成及連接間的建立,在ASD大鼠模型中,自噬水平顯著降低,而增強(qiáng)自噬能夠促進(jìn)神經(jīng)系統(tǒng)中異常蛋白消除,提高海馬組織興奮性,從而改善ASD核心癥狀[5],提示自噬可能與ASD海馬神經(jīng)功能異常存在一定的相關(guān)性。盤狀結(jié)構(gòu)域受體1(discoid domain receptor 1,DDR1)為酪氨酸蛋白家族成員之一,參與如腫瘤、心血管、神經(jīng)等疾病的發(fā)生發(fā)展[6]。研究顯示,在局灶性腦缺血/再灌注損傷大鼠模型中DDR1表達(dá)升高,而抑制DDR1表達(dá)能夠明顯減輕腦神經(jīng)損傷[7],提示DDR1可能與神經(jīng)功能障礙存在一定的相關(guān)性。但是,目前有關(guān)DDR1是否參與ASD神經(jīng)功能障礙無(wú)相關(guān)報(bào)道。本研究擬通過(guò)丙戊酸鈉(sodium valproate acid,VPA)誘導(dǎo)孕鼠子代ASD模型,觀察VA對(duì)ASD大鼠神經(jīng)行為學(xué)的影響及可能的作用機(jī)制,以期為VA在ASD早期康復(fù)治療中提供可靠的理論依據(jù)。
1 材料與方法
1.1 材料
1.1.1動(dòng)物 成年,SPF級(jí)雌、雄Wistar大鼠各10只,體質(zhì)量(200~250)g,購(gòu)買于鄭州大學(xué)醫(yī)學(xué)院實(shí)驗(yàn)動(dòng)物學(xué)部,生產(chǎn)許可證號(hào):SCXK(豫)2018-0007,使用許可證號(hào):SYXK(豫)2019-0013。動(dòng)物實(shí)驗(yàn)符合3R原則,且本實(shí)驗(yàn)通過(guò)我院動(dòng)物醫(yī)學(xué)倫理委員會(huì)審查(批件號(hào):2021LL017),放置于(24±2)℃,相對(duì)濕度為55%~65%,晝夜交替光照,自由飲食、飲水,適應(yīng)性喂養(yǎng)1周。
1.1.2藥物與試劑 VA棕櫚酸酯(上海阿拉丁公司,貨號(hào):R106319-100g);VPA(美國(guó)Sigma公司,批號(hào):1069-66-5);DDR1抑制劑(DDR1-IN-5)(美國(guó)MedchemExpress公司,貨號(hào):HY-133669);pcDNA3.1質(zhì)粒(BioVector質(zhì)粒載體菌種細(xì)胞基因保藏中心);蘇木素-伊紅(hematoxylin eosin,HE)檢測(cè)試劑盒、β-actin一抗、HRP標(biāo)記的山羊抗鼠IgG、山羊抗兔IgG(碧云天生物技術(shù)公司,貨號(hào):C0105S、AF0003、A0412、A0408);NeuN抗體、DDR1抗體、LC3抗體、p62抗體(美國(guó)Cell Signaling Technology,貨號(hào):24307、5583、3868、88588)。
1.1.3儀器 熒光倒置顯微鏡(日本/奧林巴斯Olympus,型號(hào):CKX53);高速冷凍離心機(jī)(湖南可成儀器設(shè)備有限公司,型號(hào):H3-18KR);恒溫?fù)u床(南京威美特科學(xué)儀器有限公司,型號(hào):LM61-HWT);凝膠成像系統(tǒng)(美國(guó)Bio-Rad伯樂(lè)公司,型號(hào):Gel Doc XR+);Morris水迷宮成像系統(tǒng)(北京智多寶生物科技有限責(zé)任公司,型號(hào):DB001X);透射電鏡(日本電子株式會(huì)社,型號(hào):JEM1230)。
1.2 方法
1.2.1ASD大鼠模型建立及分組處理 參照Schneider等[8]方法構(gòu)建ASD大鼠模型,將雌雄大鼠按照1 ∶1比例混合,若出現(xiàn)陰栓則記為懷孕D1(E1),E12.5 d時(shí)大鼠腹腔注射VPA(600 mg·kg-1)構(gòu)建ASD模型,對(duì)照組(Control)大鼠腹腔注射等量生理鹽水。隨后將ASD組孕鼠生產(chǎn)的子代雄性幼鼠分為:ASD組、VA組、DDR1抑制劑組(DDR1 inhibitor)以及VA+DDR1過(guò)表達(dá)質(zhì)粒組(VA+OVE-DDR1),Control組孕大鼠所產(chǎn)子代記為正常對(duì)照組,每組各10只。子鼠出生D1記為P1,5組子鼠均從P7開始進(jìn)行實(shí)驗(yàn)干預(yù)。VA組子鼠以50 000 U/2.5 kg的VA灌胃[9],每日1次,連續(xù)3周;DDR1 inhibitor組子鼠以5 μg DDR1-IN-5側(cè)腦室一次性注射;VA+OVE-DDR1組子鼠給予3 μg/10 μL DDR1過(guò)表達(dá)質(zhì)粒側(cè)腦室注射的同時(shí)連續(xù)3周進(jìn)行VA灌胃,其中DDR1重組質(zhì)粒制備參照BioVector公司試劑盒說(shuō)明書進(jìn)行制備,取重組pcDNA3.1-DDR1加入至感受態(tài)細(xì)菌中進(jìn)行轉(zhuǎn)化,挑選單菌落培養(yǎng),質(zhì)粒提取,限制性內(nèi)切酶酶切鑒定,由上海生工公司測(cè)序鑒,采用脂質(zhì)體轉(zhuǎn)染法進(jìn)行。Control組子鼠給以等量大豆油灌胃。以上各組大鼠于P23時(shí)斷奶,P28時(shí)進(jìn)行相關(guān)實(shí)驗(yàn)檢測(cè)。
1.2.2重復(fù)刻板行為學(xué)實(shí)驗(yàn) P28時(shí),將各組大鼠放入鼠盒中(30 cm×25 cm×20 cm),其中盒底放置1 cm厚度輔料覆蓋,以阻止大鼠挖掘盒底。保持周圍環(huán)境安靜,適應(yīng)性放置5 min,之后通過(guò)計(jì)時(shí)10 min內(nèi)各組大鼠轉(zhuǎn)圈、跳躍及梳理毛發(fā)的總時(shí)間,評(píng)價(jià)大鼠重復(fù)刻板行為。
1.2.3三箱實(shí)驗(yàn) 通過(guò)三箱實(shí)驗(yàn)進(jìn)行大鼠社交能力檢測(cè)。實(shí)驗(yàn)箱尺寸長(zhǎng)×寬×高(123 cm×50 cm×40 cm)的長(zhǎng)方體,并使用不透明玻璃板將其隔離成大小相等的三室,各室間通過(guò)隔板相連(隔板上留有大小適宜的孔洞能夠保證大鼠自由通過(guò)三室)。左右兩室外側(cè)各與大鼠鼠箱相連并通過(guò)帶孔擋板與左右兩室相通。實(shí)驗(yàn)開始前將測(cè)試大鼠放置于中間室并擋住隔板孔洞適應(yīng)性活動(dòng)5 min,之后打開擋板,使測(cè)試大鼠自由活動(dòng)5 min。實(shí)驗(yàn)開始前右邊鼠箱中放置1只陌生大鼠,通過(guò)JLBehv動(dòng)物行為分析系統(tǒng)統(tǒng)計(jì)分析各組大鼠10 min內(nèi)分別與陌生鼠及空箱社交時(shí)間。
1.2.4水迷宮實(shí)驗(yàn) VA給藥3周后,行Morris水迷宮實(shí)驗(yàn),將水迷宮劃分為4個(gè)象限,并隨機(jī)性選取一個(gè)象限下放置隱蔽平臺(tái),將大鼠從4個(gè)象限隨機(jī)性放入水中,記錄大鼠尋找到平臺(tái)的時(shí)間,即為逃避潛伏期。通過(guò)上海吉量軟件公司視頻采集分析系統(tǒng)記錄大鼠尋找到水下隱匿平臺(tái)的時(shí)間及運(yùn)動(dòng)軌跡。大鼠經(jīng)過(guò)5 d平臺(tái)尋找訓(xùn)練:4個(gè)象限入水點(diǎn),每天訓(xùn)練1次,每次間隔20 min,于5 d記錄各組大鼠逃避潛伏期時(shí)間。空間探索實(shí)驗(yàn):于6 d,撤去隱蔽平臺(tái),將大鼠從4個(gè)象限中任一象限隨機(jī)入水,記錄大鼠60 s內(nèi)穿越平臺(tái)的次數(shù)以及目標(biāo)象限的停留時(shí)間占比。
1.2.5HE染色觀察海馬CA1區(qū)域形態(tài)變化 大鼠麻醉后,大鼠頸椎脫臼處死,摘取腦片(摘取視交叉至漏斗柄),組織固定、石蠟包埋、切片,行HE染色,并于200倍鏡下觀察海馬CA1區(qū)域形態(tài)變化。半定量評(píng)估海馬CA1區(qū)域神經(jīng)元損傷。1級(jí):海馬CA1區(qū)域分散零散損傷神經(jīng)元(<20%);2級(jí):海馬CA1區(qū)域存在少量損傷神經(jīng)元(20%~40%);3級(jí):海馬CA1區(qū)域伴有中等數(shù)量損傷神經(jīng)元(40%~60%);4級(jí):海馬CA1區(qū)域有大量損傷神經(jīng)元(60%~80%);5級(jí):海馬CA1區(qū)域神經(jīng)元存在廣泛性損傷(80%~100%)。
1.2.6免疫組化檢測(cè)海馬CA1區(qū)域NeuN陽(yáng)性細(xì)胞 海馬組織切片,經(jīng)內(nèi)源性過(guò)氧化物酶阻斷劑阻斷、抗原修復(fù)、組織封閉后,滴加NeuN單克隆抗體(1 ∶500),孵育過(guò)夜,對(duì)應(yīng)二抗孵育2 h,滴加DAB顯色液,顯微鏡下觀察海馬神經(jīng)元NeuN著色情況。
1.2.7透射電鏡檢測(cè)海馬CA1區(qū)域自噬體數(shù)量 將大腦海馬組織修剪成大小為1 mm×1 mm組織塊,在1%四氧化鋨中固定3 h。乙醇和丙酮梯度脫水后,將樣品嵌入Spurr樹脂中,并切成70 nm厚的薄片,最后采用醋酸鈾酰和檸檬酸鉛染色,并于10 000×透射電子顯微鏡觀察自噬小體形態(tài)與數(shù)量。
1.2.8免疫熒光檢測(cè)LC3表達(dá) 快速取出大腦海馬組織,20%的蔗糖溶液脫水,組織冷凍切片機(jī)切片獲得厚度為10~20 μm腦片,PBS清洗腦片殘留血漬,組織透化液Triton X-100透化時(shí)長(zhǎng)約15 min,胎牛血清封閉非特異性位點(diǎn)30 min,滴加LC3抗體(綠色),4 ℃條件下,孵育過(guò)夜,37 ℃條件下孵育二抗60 min,PBS潤(rùn)洗切片,進(jìn)行海馬神經(jīng)元NeuN細(xì)胞核染色5 min(紅色),最后加載蓋玻片,封片。實(shí)驗(yàn)結(jié)果以熒光顯微鏡下觀察切片視野中LC3陽(yáng)性細(xì)胞數(shù)與細(xì)胞總數(shù)比值反映LC3相對(duì)表達(dá)量。
1.2.9Western blot檢測(cè)海馬組織DDR1、LC3、p62蛋白表達(dá) 大鼠海馬組織剪碎后混合加入蛋白酶抑制劑的RIPA細(xì)胞裂解液,于4 ℃條件下,裂解30 min。將離心管放置于離心機(jī)內(nèi),并設(shè)置:4 ℃,12 000 r·min-1離心10 min,吸取上清液。BCA法測(cè)定蛋白質(zhì)濃度,蛋白質(zhì)變性,蛋白上樣,電泳,分離蛋白,轉(zhuǎn)膜。室溫條件下PVDF采用6% BSA封閉1 h,TBST洗膜后孵育DDR1一抗、LC3一抗、p62一抗、β-actin一抗,稀釋比例均為1 ∶1 000,4 ℃下孵育16 h。次日取出PVDF膜TPST洗滌后加入相應(yīng)HRP標(biāo)記的山羊抗鼠IgG、山羊抗兔IgG孵育2 h。TBST洗滌3次,滴加顯影液,采用ImageJ軟件進(jìn)行DDR1、LC3、p62蛋白表達(dá)定量。
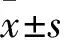
2 結(jié)果
2.1 各組大鼠海馬組織DDR1表達(dá)變化與Control組相比,Model組大鼠海馬組織DDR1蛋白表達(dá)明顯升高(P<0.01)。與Model組相比。VA組和DDR1 inhibitor組大鼠海馬組織DDR1蛋白表達(dá)均明顯降低(P<0.01)。與VA組相比,VA+OVE-DDR1組大鼠海馬組織DDR1蛋白表達(dá)明顯升高(P<0.01)(Fig 1)。

Fig 1 The protein of DDR1 expression in hippocampus of rats in each group
2.2 各組大鼠社交行為及重復(fù)刻板行為的變化情況曠場(chǎng)實(shí)驗(yàn)結(jié)果顯示,5組大鼠移動(dòng)總行程及活動(dòng)時(shí)間均有顯著性差異。與Control組相比,Model組大鼠移動(dòng)總行程及活動(dòng)時(shí)間均增加(P<0.01)。與Model組相比,VA和DDR1 inhibitor組大鼠移動(dòng)總行程及活動(dòng)時(shí)間均降低(P<0.05或P<0.01)。與VA組相比,VA+OVE-DDR1組大鼠移動(dòng)總行程及活動(dòng)時(shí)間均明顯增加(P<0.05)。三箱實(shí)驗(yàn)檢測(cè)顯示,與Control組相比,Model組大鼠與陌生大鼠接觸時(shí)間變短,與空箱接觸時(shí)間變長(zhǎng)(P<0.01)。與Model組相比,VA組和DDR1 inhibitor組大鼠接觸時(shí)間變長(zhǎng),與空箱接觸時(shí)間變短(P<0.05)。與VA組相比,VA+OVE-DDR1組大鼠與陌生大鼠接觸時(shí)間變短,與空箱接觸時(shí)間變長(zhǎng)(P<0.05)。自梳理實(shí)驗(yàn)檢測(cè)顯示,與Control組相比,Model組大鼠重復(fù)刻板行為時(shí)間變長(zhǎng)(P<0.01)。與Model組相比,VA組和DDR1 inhibitor組大鼠重復(fù)刻板行為時(shí)間變短(P<0.01)。與VA組相比,VA+OVE組大鼠重復(fù)刻板行為時(shí)間變長(zhǎng)(P<0.01)(Fig 2)。
2.3 各組大鼠學(xué)習(xí)記憶能力變化情況與Control組相比,Model組大鼠逃避潛伏期時(shí)間延長(zhǎng),穿越目標(biāo)平臺(tái)次數(shù)及目標(biāo)平臺(tái)停留時(shí)間占比均明顯降低(P<0.01)。與Model組相比,VA組和DDR1 inhibitor組大鼠逃避潛伏期時(shí)間時(shí)長(zhǎng)降低,穿越目標(biāo)平臺(tái)次數(shù)及目標(biāo)平臺(tái)停留時(shí)間占比均明顯增加(P<0.01)。

Fig 2 Comparison of social behavior and repetitive stereotype of rats in each group
與VA組相比,VA+OVE-DDR1組大鼠逃避潛伏期時(shí)間延長(zhǎng),穿越目標(biāo)平臺(tái)次數(shù)及目標(biāo)平臺(tái)停留時(shí)間占比均明顯降低(P<0.05或P<0.01)(Fig 3)。
2.4 各組大鼠海馬CA1區(qū)域神經(jīng)元損傷情況HE染色顯示,Control組大鼠海馬CA1區(qū)域神經(jīng)元排列整齊,結(jié)構(gòu)完整。Model組大鼠海馬CA1區(qū)域神經(jīng)元排列紊亂,部分神經(jīng)元細(xì)胞核固縮,嗜酸性粒細(xì)胞數(shù)目明顯增多,海馬神經(jīng)元損傷評(píng)分增加(P<0.01)。與Model組相比,VA組和DDR1 inhibitor組大鼠海馬CA1區(qū)域大部分神經(jīng)元結(jié)構(gòu)正常,酸性粒細(xì)胞數(shù)目明顯增加減少,神經(jīng)元損傷評(píng)分降低(P<0.01)。與VA組相比,VA+OVE-DDR1組大鼠海馬CA1區(qū)神經(jīng)元損傷較Model組相似。免疫組化檢測(cè)顯示,與Control組相比,Model組大鼠海馬CA1區(qū)域NeuN+陽(yáng)性細(xì)胞數(shù)量明顯減少(P<0.01)。與Model組相比,VA組和DDR1 inhibitor組大鼠海馬CA1區(qū)域NeuN+陽(yáng)性細(xì)胞數(shù)量明顯增多(P<0.01)。與VA組相比,VA+OVE-DDR1組大鼠海馬CA1區(qū)域NeuN+陽(yáng)性細(xì)胞數(shù)量明顯減少(P<0.01)(Fig 4)。
2.5 各組大鼠海馬神經(jīng)元自噬水平比較透射電鏡觀察顯示,海馬CA1區(qū)域可見自噬小體,自噬小體形狀是由細(xì)胞質(zhì)成分或廢棄細(xì)胞器在不同降解階段的消化和降解形成的層狀結(jié)構(gòu),包裹在單層或雙層膜中,邊界清晰可見。與Control組相比,Model組自噬體數(shù)量明顯降低(P<0.01)。與Model組相比,VA組和DDR1 inhibitor組自噬體數(shù)量明顯增加(P<0.01)。與VA組相比,VA+OVE-DDR1組噬體數(shù)量明顯降低(P<0.01)(Fig 5)。
2.6 各組大鼠海馬組織自噬標(biāo)志蛋白表達(dá)變化與Control組相比,Model組大鼠海馬CA1區(qū)神經(jīng)元LC3陽(yáng)性表達(dá)率及LC3Ⅱ/LC3Ⅰ均明顯降低(P<0.01),p62表達(dá)明顯升高(P<0.01)。與Model組相比,VA組和DDR1 inhibitor組大鼠海馬CA1區(qū)神經(jīng)元LC3陽(yáng)性表達(dá)率及LC3Ⅱ/LC3Ⅰ均明顯升高(P<0.01),p62表達(dá)明顯降低(P<0.01)。與VA組相比,VA+OVE-DDR1組大鼠海馬CA1區(qū)神經(jīng)元LC3陽(yáng)性表達(dá)率及LC3Ⅱ/LC3Ⅰ均明顯降低(P<0.01),p62表達(dá)明顯升高(P<0.05或P<0.01)(Fig 6)。

Fig 3 Comparison of learning and memory abilities of rats in each group

Fig 4 Neuronal damage in CA1 region of hippocampus of rats in each group
3 討論
VPA是臨床上常用的一線廣譜抗癲癇藥,在治療疾病的同時(shí),也會(huì)帶來(lái)一些副作用,研究發(fā)現(xiàn)孕婦在孕早期服用VPA可導(dǎo)致后代患ASD的可能性顯著增加[10]。以往眾多研究已證實(shí),在大鼠孕12.5 d腹腔一次性注射VPA(600 mg·kg-1)能夠顯著影響子宮內(nèi)胎鼠腦部發(fā)育,導(dǎo)致腦組織發(fā)育異常,其與ASD患者臨床病因、病理以及行為學(xué)癥狀等具有明顯的相似性,被認(rèn)為是經(jīng)典的ASD動(dòng)物造模方法[11]。本研究造模結(jié)果顯示,與Control組相比,Model組大鼠,學(xué)習(xí)記憶能力減弱,與臨床ASD患者癥狀極為相似,表明ASD仔鼠模型構(gòu)建成功,后續(xù)實(shí)驗(yàn)具有可行性。

Fig 5 Morphology and number of autophagosomes in hippocampal CA1 region of rats in each group

Fig 6 Changes of autophagy marker protein expression in hippocampus of rats in each group
VA是人體生長(zhǎng)發(fā)育必須的一種微量營(yíng)養(yǎng)素,在維持神經(jīng)系統(tǒng)的發(fā)育和功能上發(fā)揮重要作用。另外,袁小婕等[9]研究證實(shí),VA能夠改善VPA誘導(dǎo)的ASD大鼠的行為學(xué)表現(xiàn)。本研究觀察VA給藥后對(duì)VPA誘導(dǎo)的ASD大鼠神經(jīng)行為學(xué)的影響。結(jié)果顯示,與Model組相比,VA組大鼠社交能力增強(qiáng),重復(fù)刻板行為降低,學(xué)習(xí)記憶能力增強(qiáng),初步表明VA能夠改善Model大鼠ASD癥狀。海馬在空間學(xué)習(xí)和記憶能力上發(fā)揮關(guān)鍵作用,被認(rèn)為是ASD動(dòng)物模型中主要的受損腦區(qū)域之一。本研究結(jié)果顯示,與Control組相比,Model組大鼠海馬CA1區(qū)域神經(jīng)元明顯受損,而給予VA給藥處理后ASD大鼠海馬CA1區(qū)域神經(jīng)元損傷明顯減輕。神經(jīng)元核抗原(neuronal nuclei,NeuN)僅在成熟的神經(jīng)元內(nèi)表達(dá),其NeuN陽(yáng)性細(xì)胞表達(dá)數(shù)量可以有效反映海馬神經(jīng)元的發(fā)育的成熟程度。本研究結(jié)果顯示,與Control組相比,Model組大鼠海馬CA1區(qū)域NeuN陽(yáng)性細(xì)胞表達(dá)率顯著降低,而經(jīng)VA處理后ASD大鼠海馬CA1區(qū)域NeuN陽(yáng)性細(xì)胞表達(dá)率顯著增加,表明VA能夠改善ASD大鼠海馬CA1區(qū)域神經(jīng)元損傷。但是,目前有關(guān)VA對(duì)ASD海馬神經(jīng)元的保護(hù)機(jī)制尚不清楚。
自噬是維持細(xì)胞自我平衡的一種自我保護(hù)性機(jī)制,是細(xì)胞內(nèi)受損細(xì)胞器、蛋白聚集以及長(zhǎng)周期性蛋白質(zhì)等生物大分子降解的重要途徑,與中樞神經(jīng)系統(tǒng)發(fā)育和神經(jīng)功能穩(wěn)態(tài)密切相關(guān)。既往研究顯示,在ASD大鼠海馬神經(jīng)元自噬活性明顯降低,增強(qiáng)自噬可以顯著改善海馬組織興奮/抑制性突觸失衡,從而改善ASD癥狀,而抑制自噬則會(huì)加重ASD相關(guān)癥狀[12]。本研究結(jié)果顯示,與Control組相比,Model組自噬小體數(shù)量明顯減少,且自噬標(biāo)志性蛋白LC3表達(dá)顯著降低,p62表達(dá)顯著升高。與Model組相比,VA處理后海馬CA1區(qū)域自噬小體數(shù)量顯著增加,且自噬標(biāo)志性蛋白LC3表達(dá)升高,p62表達(dá)降低,提示VA可能通過(guò)增強(qiáng)自噬水平,改善ASD大鼠海馬神經(jīng)元損傷。DDR1是與細(xì)胞增殖、凋亡、炎癥等密切相關(guān)。另外,Fowler等[13]研究亦發(fā)現(xiàn),抑制DDR1表達(dá)能夠增加自噬活性,降低神經(jīng)毒性蛋白表達(dá)以及炎癥因子釋放,從而改善帕金森綜合征神經(jīng)退行性病變。本研究結(jié)果顯示,與Control組相比,社交能力減弱,重復(fù)刻板行為增加,Model組大鼠,海馬組織DDR1表達(dá)明顯增加;VA處理后,ASD大鼠海馬組織DDR1表達(dá)顯著降低,提示VA可能通過(guò)抑制DDR1表達(dá),增強(qiáng)自噬活性,從而改善VPA誘導(dǎo)的ASD大鼠海馬神經(jīng)元損傷。本研究通過(guò)ASD大鼠側(cè)腦室注射DDR1抑制劑,觀察神經(jīng)行為學(xué)變化。結(jié)果顯示,DDR1抑制劑與VA發(fā)揮同向抗ASD作用,大鼠社交能力增強(qiáng),重復(fù)刻板行為降低,學(xué)習(xí)記憶能力增強(qiáng),海馬CA1區(qū)域NeuN陽(yáng)性細(xì)胞表達(dá)率增加,自噬小體數(shù)量增加,且自噬標(biāo)志性蛋白LC3表達(dá)升高,p62表達(dá)降低,神經(jīng)元損傷減輕,提示DDR1介導(dǎo)自噬可能是VA抗ASD神經(jīng)元損傷的重要途徑。為進(jìn)一步明確DDR1介導(dǎo)細(xì)胞自噬途徑在VA抗ASD海馬神經(jīng)元損傷中的作用。本研究對(duì)VA組大鼠側(cè)腦室注射DDR1過(guò)表達(dá)質(zhì)粒,此時(shí)VA對(duì)ASD海馬神經(jīng)元的保護(hù)作用被逆轉(zhuǎn),大鼠社交能力減弱,重復(fù)刻板行為增加,學(xué)習(xí)記憶能力減弱,海馬CA1區(qū)域NeuN陽(yáng)性細(xì)胞表達(dá)率顯著降低,神經(jīng)元損傷加重,自噬小體數(shù)量顯著減少,且自噬標(biāo)志性蛋白LC3表達(dá)降低,p62表達(dá)增加,提示VA可以通過(guò)下調(diào)DDR1表達(dá),激活自噬,從而發(fā)揮ASD大鼠海馬神經(jīng)元保護(hù)作用。PI3K/Akt/mTOR通路是調(diào)控自噬的重要途徑,激活PI3K/Akt/mTOR通路能夠抑制細(xì)胞自噬,調(diào)控細(xì)胞增殖與凋亡[14]。以往研究顯示,DDR1能夠通過(guò)激活PI3K/Akt信號(hào)通路,調(diào)控細(xì)胞的增殖與凋亡等[15]。
綜上所述,本研究通過(guò)探究VA對(duì)VPA誘導(dǎo)的ASD大鼠神經(jīng)行為學(xué)的影響及作用機(jī)制。結(jié)果顯示,VA能夠改善ASD大鼠神經(jīng)行為,機(jī)制與抑制DDR1表達(dá),增強(qiáng)細(xì)胞自噬相關(guān)。以上研究初步揭示了VA抗ASD的作用機(jī)制,為VA用于ASD早期臨床治療提供了理論依據(jù)。

