4-氯-1-硝氨基-2,3,5,6-四硝基苯的合成及熱性能分析
曹 彩,閆宇民,廉鵬豹,王建龍
(1.山西北方興安化學工業有限公司,山西 太原 030008;2.中北大學 化學與化工學院,山西 太原 030051)
引 言
含有氮-硝基基團的含能材料(如常見的硝胺類炸藥)由于具有能量較高、綜合性好、原料來源廣泛、制造工藝日趨成熟等優點,在含能材料領域中發揮著重要的作用[1-2]。除此之外,硝胺炸藥(如RDX、HMX、CL-20等)還具有性能穩定、能量密度高等特點,被應用于陸、海、空軍武器以及爆炸裝置的能源[3],特別是多硝基富氮含能化合物的合成、結構及性能研究受到含能材料研究者的普遍關注[4-5]。
通過乙酰化和硝化兩步反應得到了一種硝銨化合物。對該材料進行了單晶培養、表征、能量計算、熱分解測試和熱分解參數計算等,充分證明了該材料是一種高能高氮且穩定的含能化合物。此外,物質中-CL基團的存在可以制備許多含能的唑類衍生物[6-8]。
為了使含能材料能夠在更為寬廣的領域得到應用,提高含能材料的能量和安全性已經成為其研究的新熱點。炸藥的爆速和爆壓是重要的爆轟參數,參數的計算對于爆轟理論和爆轟效應的研究以及新型炸藥的合成和設計都具有重要的理論和實際意義。1968年,Kamlet等[9]從爆熱和爆炸體積兩方面得到了一種計算CHNO類炸藥爆轟性能的簡便方法。1983年,國迂賢[10]和張厚生等[11]提出了計算爆速、爆壓的氮當量(NE)和修正氮當量公式(MNE),計算了6類166種元素炸藥,得到了628組爆速數據和20組爆壓數據,通過與相關公式(如Kamlet公式[9])進行比較后發現,MNE計算的誤差最小,與實測值最接近。因此,本研究采用NE和MNE計算合成所得化合物的爆速和爆壓。
本研究合成了一種新的高氮含能化合物,苯胺類物質進行硝化時,由于氨基易被硝酸氧化,一般先用酰基化反應保護氨基,再水解掉酰胺基[12-15],以4-氯-3,5-二硝基苯胺為原料,經乙酸酐酰化后合成了4-氯-3,5-二硝基乙酰苯胺(化合物Ⅰ),再硝化得到4-氯-1-硝氨基-2,3,5,6-四硝基苯(化合物Ⅱ),探究了化合物Ⅱ的爆轟性能和熱分解性能,充分證明該物質的能量較高,性質穩定,估算了化合物Ⅱ的熱爆炸臨界溫度,從熱力學角度分析其可應用性,以期能為評價高氮含能化合物的熱安全性提供更為詳細的理論支撐,并對后續開發與應用能量水平更高的含能化合物奠定基礎。
1 實 驗
1.1 試劑與儀器
發煙硝酸(質量分數98%),工業品,山西北方興安化學工業有限公司;濃硫酸(質量分數98%)、乙酸酐、二氯甲烷、乙酸乙酯、石油醚,均為分析純,西隴科技有限公司;蒸餾水,實驗室自制。原料4-氯-3,5-二硝基苯胺,實驗室自制[16]。
M-565熔點儀,瑞士BUCHI公司;Vario Micro Cube型全自動元素分析儀,德國Elementar公司;VERTEX 80 型傅里葉變換紅外光譜儀、AVANCE ⅢTM 600 MHz核磁共振儀,瑞士Bruker公司;Agilent Xcalibur &Gemini型X-射線單晶衍射儀,美國Agilent公司;METTLER-TOLEDO DSC-3差示掃描量熱儀、NETZSCH TG 209 F1 Libra型熱重分析儀,美國METTLER公司。
1.2 合成路線
以4-氯-3,5-二硝基苯胺為原料,經乙酰化、硝化兩步反應逐步合成了4-氯-3,5-二硝基乙酰苯胺(化合物Ⅰ)以及4-氯-1-硝氨基-2,3,5,6-四硝基苯(化合物Ⅱ),合成路線見圖1。
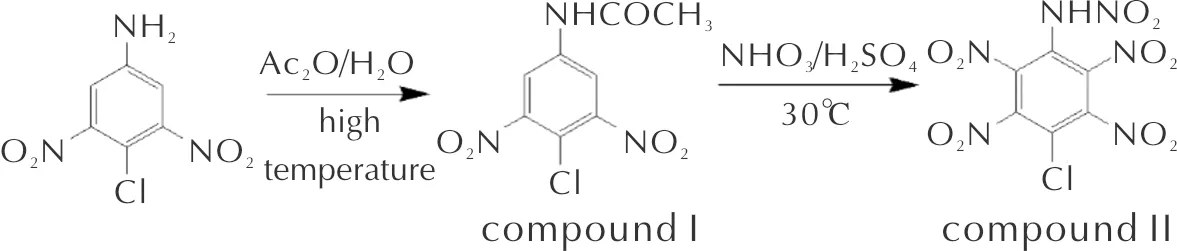
圖1 4-氯-1-硝氨基-2,3,5,6-四硝基苯合成路線Fig.1 The synthetic route of 4-chloro-1-nitroamino-2,3,5,6-tetranitrobenzene
1.3 合成實驗
1.3.1 化合物Ⅰ的合成
在裝有溫度計、冷凝管的250mL四口燒瓶中加入乙酸酐50mL,室溫攪拌下加入4-氯-3,5-二硝基苯胺5g(23mmol),固體完全溶解后,將溫度升至120℃,保溫反應2h,加入100mL蒸餾水,立即產生大量白色固體,降溫至60℃繼續攪拌0.5h,反應結束,降至室溫,過濾,水洗,得白色固體物質5.5g,產率91.7%,熔點為217~219℃。
FT-IR(KBr),ν(cm-1):3421.09(Ar—NH),3314.23(Ar—H),1686.90(C═O),1598.84(N—H),1539.18,1352.89(Ar—NO2),728.26(C—Cl);1H NMR (600MHz,Acetone-d6)δ=9.87(s 1 H),8.38(s 3 H),8.31(s 2 H)ppm。13C NMR(151MHz, Acetone-d6)δ=170.33(s 2 C),150.47(s 1 C),140.77(s 1 C),130.94(s 1 C),118.61(s 2 C),112.22(s 1 C)ppm;元素分析(C8H6ClN3O5, %):計算值:C,36.99;H,2.31;N,16.19;O,30.83;Cl,13.68;實測值:C,37.01;H,2.30;N,16.17;O,30.82。
化合物Ⅰ的傅里葉紅外光譜如圖2所示,核磁共振如圖3所示。

圖2 化合物Ⅰ的紅外光譜圖Fig.2 FT-IR spectrum of compound Ⅰ
圖3 化合物Ⅰ的核磁共振譜圖Fig.3 NMR spectrum of compoundⅠ
1.3.2 化合物Ⅱ的合成
在裝有溫度計、冷凝管的250mL四口燒瓶中加入濃硫酸80mL,25℃下將8mL發煙硝酸滴加在濃硫酸中,將4-氯-3,5-二硝基苯胺(5g, 23mmol)在25℃以下加入上述配好的混酸中,室溫攪拌2h。反應結束后,將混合物倒入碎冰中,產生大量黃色固體沉淀,過濾,石油醚洗滌得到黃色固體5.7g,產率為69.1%。
FT-IR(KBr),ν(cm-1):3424.41(Ar—N),1625.21(N—H),1564.98,1343.04(C—NO2),1385.32(N—NO2),770.71(C—Cl);1H NMR(600MHz,Acetone-d6)δ=8.77(s 1 H)ppm。13C NMR(151MHz, Acetone-d6)δ=147.96(s 1 C),137.35(s 1 C),131.09(s 2 C),120.64(s 2 C)ppm;元素分析(C6HClN6O10, %):計算值:C,20.43;H,0.28;N,23.83;O,45.39,Cl,10.07;實測值:C,20.50;H,0.31;N,23.78;O,45.76。
化合物Ⅱ的傅里葉紅外光譜如圖4所示,核磁共振如圖5所示。
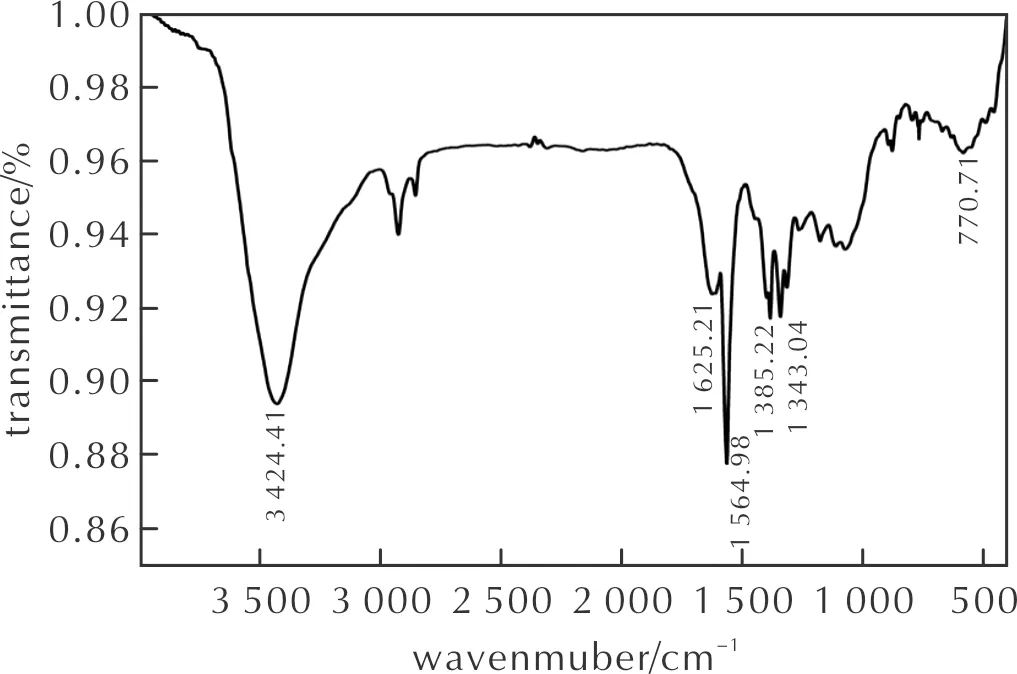
圖4 化合物Ⅱ的紅外光譜圖Fig.4 FT-IR spectrum of compound Ⅱ
圖5 化合物Ⅱ的核磁共振譜圖 Fig.5 NMR spectrum of compound Ⅱ
1.4 單晶制備及結構測試
分別稱取0.02g化合物Ⅰ和Ⅱ,將其分別加入10mL乙酸乙酯和10mL二氯甲烷中,超聲使其充分溶解,過濾除去未溶解的化合物樣品以及雜質,濾液靜置,室溫下緩慢揮發,得到白色針狀晶體以及無色塊狀晶體。
數據經LP因子及半經驗吸收校正,使用Olex2[17]、ShelXT[18]結構求解程序使用固有相位求解結構,ShelXL[19]優化包使用最小二乘法對F2修正,晶體結構由直接法和Fourier合成法解出。
2 結果與討論
2.1 晶體結構分析
單晶分析表明,化合物Ⅰ的相對分子質量為259.61,化合物每單位晶胞由12個分子組成。從晶體結構的角度來看,該化合物上硝基被扭曲到苯環平面外,并且扭轉角分別為43.646°、79.109°。乙酰基和苯環上的氨基之間的C(2)—N(1)鍵的長度為1.382?,表明該位置是單鍵,晶體結構數據表明該物質的共面性很強,因此該化合物較為穩定。
化合物Ⅱ的相對分子質量為352.5,晶體含結晶水,每個晶胞由4個分子組成。與原料4-氯-3,5-二硝基苯胺的晶體結構相比[20],硝基上的N原子分別與苯環的C(2)、C(3)、C(5)和C(6)相連,并且由于空間位阻效應,硝基及其母環的二面角分別為43.673°、65.133°、65.945°和48.329°。與化合物1,3,5-三氯-2,4,6-三硝基苯[21](鍵長為1.707?)相比,該化合物的C—Cl的鍵長為1.710?,鍵長相近,可見硝氨基的引入對于C—Cl鍵沒有明顯影響,C—Cl鍵較為穩定,不易被取代。
兩種物質的晶體結構如圖6所示,晶體結構具體參數見表1。

表1 兩種化化合物的晶體結構數據Table 1 Crystal structure data of two compounds
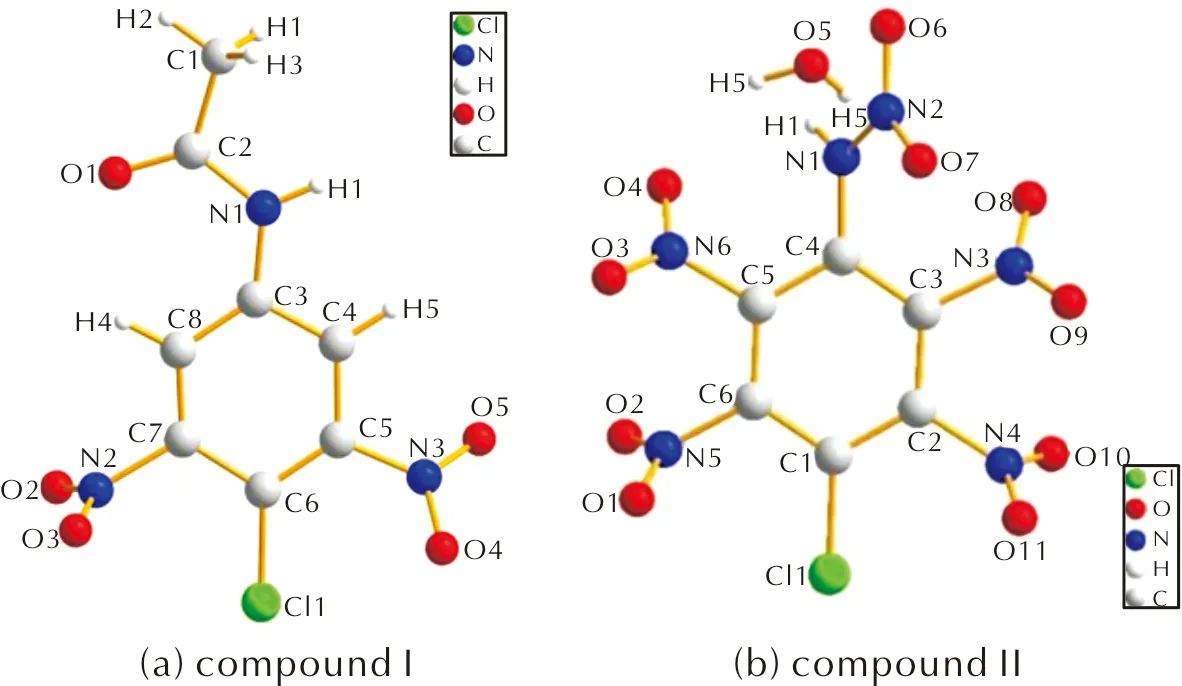
圖6 兩種化合物的晶體結構圖Fig.6 Crystal structure of two compounds
2.2 化合物Ⅱ的爆轟參數計算
爆速和爆壓的計算見公式(1)~(4),ME和NME見公式(5)和(6):
D=(690+1160ρ)∑N
(1)
D?=(690+1160ρ)∑N?
(2)
p=10.92(ρ∑N)2-5.74
(3)
p?=11.60(ρ∑N?)2-8.40
(4)
(5)
∑GjNGj)
(6)
式中:D為爆速(m/s);ρ為炸藥裝藥密度(g/cm3);∑N為炸藥的氮當量;D?為修正爆炸速度(m/s);∑N?為炸藥的修正氮當量;p為爆壓(kPa);p?為炸藥修正爆壓(kPa);M為炸藥摩爾分子質量(g/mol);Xi為每摩爾炸藥爆炸產生的第i個產物的摩爾數;Ni為第i個爆轟產物的氮當量系數;NPi為第i個爆轟產物的修正氮當量系數;Bk為分子中第k個化學鍵出現的次數;NBk為第k個化學鍵的修正氮當量系數;Gj為分子中第j個基團出現的次數;NGj為第j個基團的修正氮當量系數。化合物Ⅱ與其他幾種含能化合物的相關參數對比見表2。
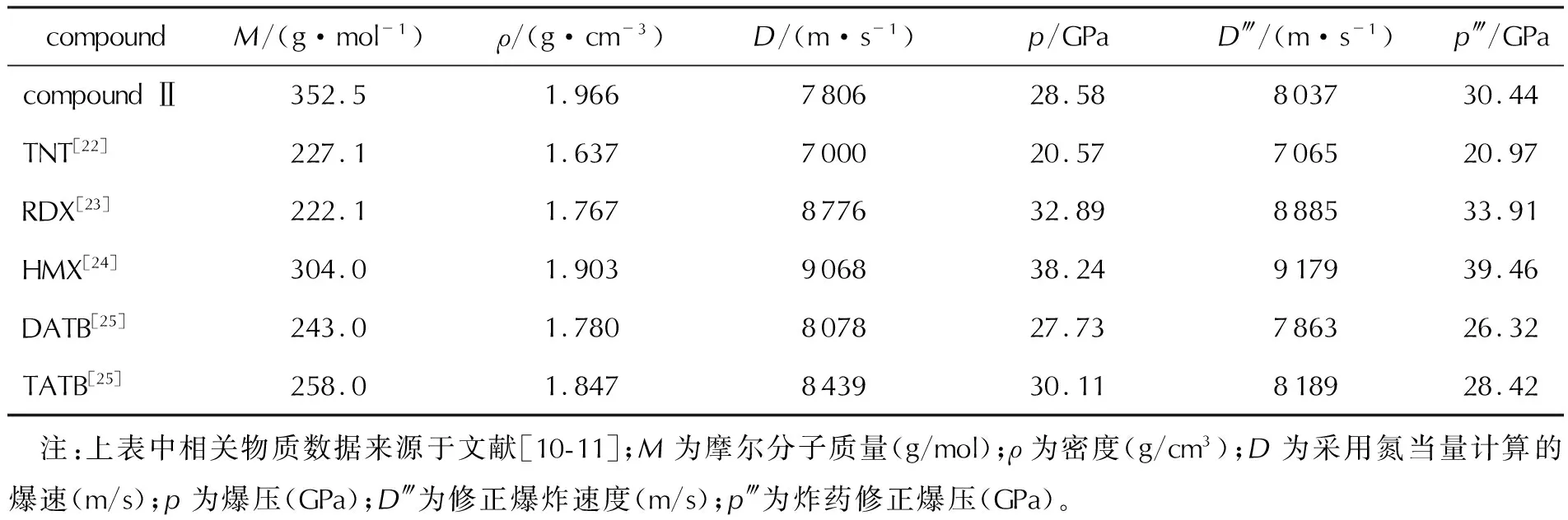
表2 爆轟性能的比較Table 2 The comparison of detonation performance
由表2可知,化合物Ⅱ的密度為1.966g/cm3,高于表中所列其他含能物質。修正后的爆速和爆壓計算結果表明,化合物Ⅱ的爆速(8037m/s)高于TNT(7065m/s)、DATB(7863m/s),與TATB(8189m/s)接近,但低于RDX(8885m/s)和HMX(9179m/s),化合物Ⅱ的爆壓(30.44GPa)高于TNT(20.97GPa)、DATB(26.32GPa)和TATB(28.42GPa),低于RDX(33.91GPa)和HMX(39.46GPa)。
2.3 化合物Ⅱ的熱分解性能
采用DSC和TG/DTG對化合物Ⅱ的熱穩定性進行了測試。實驗檢測了毫克級別物質加熱反應過程中所產生或消耗的熱量。在5、10、15和20K 4個不同升溫速率下對干燥后的化合物Ⅱ在300~575K的溫度范圍內進行測試,整個過程中充滿氮氣。以DTA數據作圖,計算了相關熱力學參數。化合物Ⅱ在升溫速率為20K/min的DSC和TG-DTG測試結果如圖7所示;在不同升溫速率(5、10、15、20K/min)下的TG和DTG曲線如圖8所示。
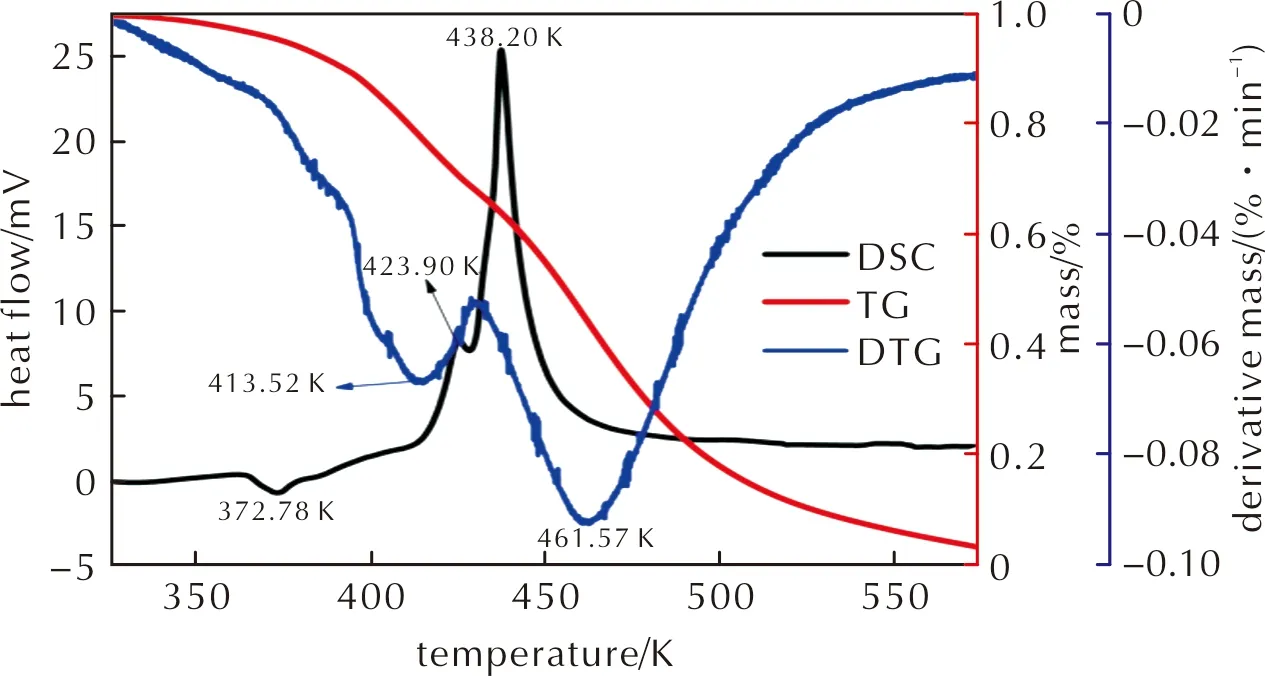
圖7 化合物Ⅱ的DSC和TG-DTG曲線Fig.7 The DSC and TG-DTG curves of compound Ⅱ
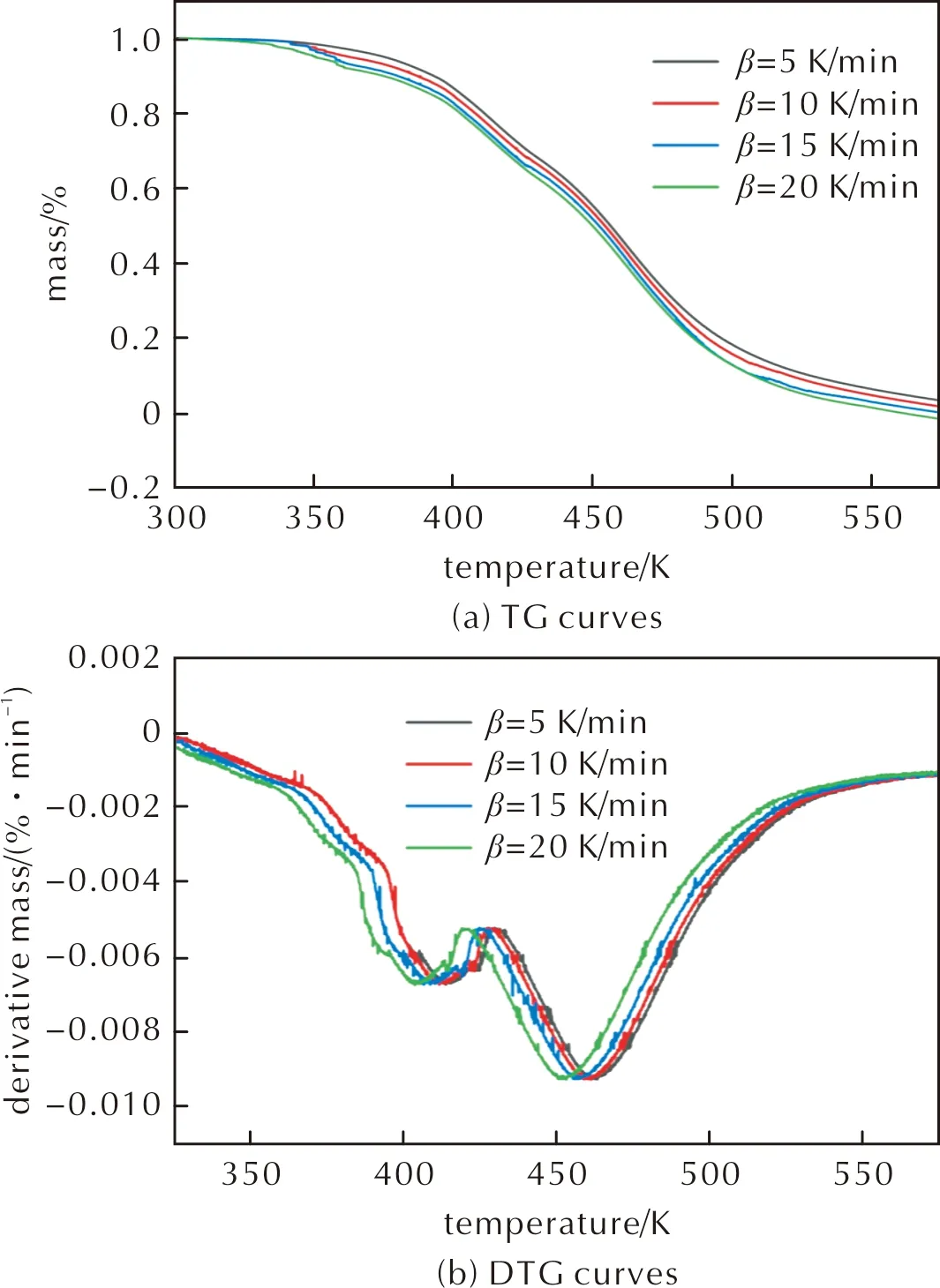
圖8 不同升溫速率下化合物Ⅱ的TG和DTG曲線Fig.8 The TG and DTG curves of compound Ⅱ at different heating rates
由圖7和圖8可知,該化合物的分解過程分為兩個階段。DSC曲線顯示,第二次分解的開始溫度與第一次分解的結束溫度非常接近。因此可得化合物Ⅱ在分解過程中在一次分解后容易迅速引起二次分解。從TG和DTG曲線上觀察到存在兩個質量損失過程。第一個過程是在365.13~428K范圍內的小分解過程,質量損失為27.38%,對應于DSC曲線上的第一段吸熱和第一段放熱過程,該過程中-NHNO2和-Cl基團被分解掉。該過程的理論計算值與實驗值完全一致。第二個過程為從428.51~497.77K的放熱分解,質量損失為53.62%,與DSC曲線上的第二個放熱過程相對應,峰值溫度為438.20K。這是一個-NO2基團被分解的過程。由于DSC和TG測試是在不同的儀器上進行的,所以第二階段的分解溫度范圍存在一定的偏差,但整個物質的分解趨勢是一致的。
2.4 非等溫分解動力學參數
采用Kissinger法和Flynn-Wall-Ozawa(FWO)法計算化合物Ⅱ的動力學參數[26-27]。Kissinger和FWO公式如下:
(7)
(8)
式中:β為線性升溫速率(K/min);TP為DSC曲線峰值溫度(K);A為指前因子(s-1);R為氣體常數(J·mol-1·K-1);E為表觀活化能(kJ/mol);G(α)為反應機理函數的積分形式[28]。DTG測試計算得到的分解動力學參數見表3。
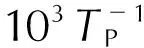

圖10 根據Kissinger法和FWO法擬合的第二段熱分解過程的與圖 and lgβ versus by Kissinger and FWO methods of the second decomposition
利用公式(7)和(8),可得到公式(9):
(9)
計算得到的活化能可用于計算指前因子的對數(logA/s-1)。其中,E表示根據Kissinger法或者FWO法計算得到的表觀活化能。數據logA、E以及線性相關系數的平方(r2)見表5和表6。
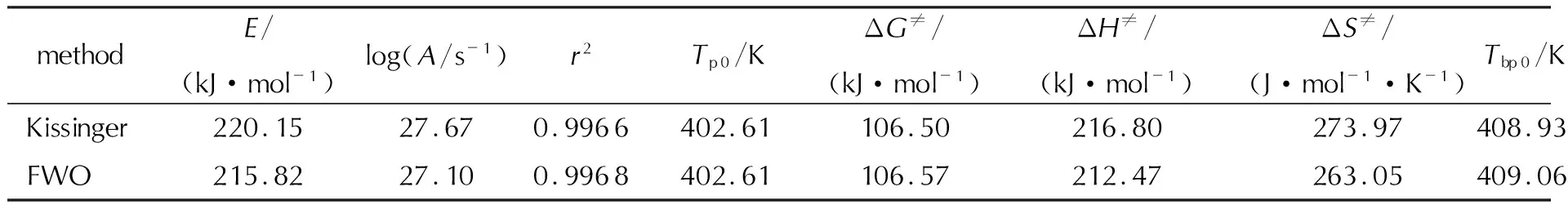
表5 化合物Ⅱ第一階段分解的非等溫動力學和熱力學參數Table 5 Non-isothermal kinetic and thermodynamic parameters of the first stage decomposition of compound Ⅱ

表6 化合物Ⅱ第二階段分解的非等溫動力學和熱力學參數Table 6 Non-isothermal kinetic and thermodynamic parameters of the second stage decomposition of compound Ⅱ
2.5 初始分解溫度(Tp0)下的熱力學參數
根據公式(10)計算得到的升溫速率β→0時所對應的放熱分解過程的初始分解溫度Tp0[29-30]。根據公式(11)~(13)分別計算得到自由活化能(ΔG≠)、活化焓(ΔH≠)和活化熵(ΔS≠)[9]:
(10)
(11)
ΔH≠=E-RTp0
(12)
(13)
式中:Tpi為βi升溫速率的峰值溫度;a和b為系數;kB為Boltzmann常數;h為Planck常數。詳細數據見表5和表6。
從表5和6中可以看出,使用Kissinger法計算第一段分解得到的ΔG≠、ΔH≠、ΔS≠分別為106.50kJ/mol、216.80kJ/mol、273.97J/(mol·K),第二段分解得到的ΔG≠、ΔH≠、ΔS≠分別為119.87kJ/mol、172.70kJ/mol、118.51J/(mol·K);使用FWO法計算第一段分解得到的ΔG≠、ΔH≠、ΔS≠分別為106.57kJ/mol、212.47kJ/mol、263.05J/(mol·K),第二段分解得到的ΔG≠、ΔH≠、ΔS≠分別為119.91kJ/mol、171.24kJ/mol、115.16J/(mol·K),表明該化合物并不會自發分解,整個過程物質由固態變為氣態,體系混亂度增大,ΔG≠越小,ΔS≠越大表明反應越易進行,因此該化合物第一段分解時比第二段更易發生。數據與實際情況一致,說明計算結果的可靠性。
2.6 熱爆炸臨界溫度(Tbp0)
熱爆炸臨界溫度(Tbp0)由式(14)[31-32]計算得到:
(14)
式中:Tbp0為熱爆炸臨界溫度(K);E為表觀活化能(kJ/mol);Tp0表示初始分解溫度(K);R為氣體常數(J·mol-1·K-1)。
Tbp0是評價含能材料熱安定性的有效指標之一[33]。由表5和表6可知,化合物Ⅱ采用Kissinger法和FWO法計算得到第一段分解的Tbp0為408.93和409.06K,第二段分解的Tbp0為455.57和455.67K,可與DSC和TG-DTG測試數據相互支撐,有效評估該化合物的熱穩定性。
3 結 論
(1)以4-氯-3,5-二硝基苯胺為原料,經乙酰化、硝化兩步反應合成了目標產物4-氯-1-硝氨基-2,3,5,6-四硝基苯(化合物Ⅱ),并通過表征分析確認了物質結構。對化合物晶體結構進行X-射線單晶衍射測試。結果表明化合物Ⅱ的空間群為C2/c,密度為1.966g/cm。
(2)采用氮當量公式(NE)和修正氮當量公式(MNE)計算了化合物Ⅱ與一些常用含能化合物的爆轟性能,進行比較后發現化合物Ⅱ能量較高。
(3)采用DSC和TG/DTG對化合物Ⅱ的熱穩定性進行了測試。采用Kissinger法和FWO法計算化合物Ⅱ的兩段分解表觀活化能(E)和熱爆炸臨界溫度(Tbp0),其中第二階段分解的E分別為176.41和174.95kJ/mol,Tbp0分別為455.57和455.67K。
(4)以上結論表明化合物Ⅱ結構穩定,密度較高,作為一種高能化合物,爆轟性能好,靈敏度低,具有較高的研究價值。

