Caveolin-1 蛋白及其對血腦屏障通透性改變調節作用研究
王娟,白雪,王廷華,李雙陽
1 西南醫科大學附屬中醫醫院 四川瀘州 646000
2 西南醫科大學 四川瀘州 646000
3 四川大學華西醫院 四川成都 610041
中樞神經系統疾病包括感染、創傷、腦卒中及神經退行性病變等,嚴重影響人類健康和社會發展,治療也仍是世界重大醫學難題。血腦屏障完整性的改變通常是各神經系統疾病臨床癥狀出現前最先出現的病理改變[1]。本綜述通過探討Caveolin-1 調節腦損傷后血腦屏障通透性改變,以期為中樞神經系統疾病的治療靶點提供一定依據。
血腦屏障是由腦微血管內皮細胞(brain microvascular endothelial cells,BMEC)、內皮細胞緊密連接、神經膠質細胞、星形膠質細胞、周細胞、基膜等組分構成。能夠有效的調控中樞與外周血液的物質交換,阻止血液中的親水極性和大分子進入大腦,保護神經系統內環境的穩定[2]。但同時也使大部分治療中樞神經系統(central nervous system,CNS)疾病的藥物無法穿過BBB,使藥物無法在腦內達到有效治療濃度。作為血液成分進入腦組織的第一道屏障,內皮細胞是血腦屏障的核心組分,具有特殊的結構和分子特性,其通透性改變主要與腦血管內皮細胞及其緊密連接、控制物質外排的P 糖蛋(P-glycoprotein,P-gp)轉運體、內皮細胞間隙的孔穴以及胞吞、胞飲等作用密切相關[3]。
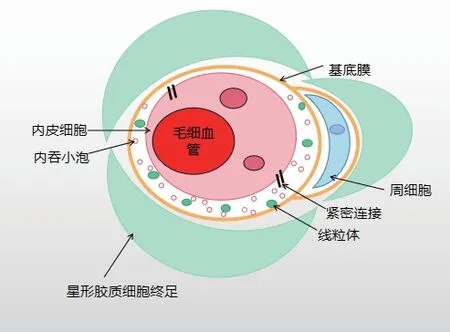
圖 血腦屏障結構與組成示意圖(抽象示意圖,根據文獻所繪制)
Caveolin-1 概述
小窩(caveolae)是存在于許多哺乳動物質膜上60- 80nm 的瓶狀凹陷結構,它們存在于多種細胞類型中,在脂肪細胞、肌肉和內皮細胞中尤為豐富,具有特殊的脂筏結構,含有豐富的膽固醇、鞘磷脂以及許多跨膜蛋白,它是內皮細胞胞吞、內吞和信號轉導的主要位點,其中包括三個成員:CAV1、CAV2 和CAV3,分別編碼具有相似結構的蛋白:Caveolin-1(CAV1)、caveolin-2(CAV2) 和caveolin 3(CAV3)[4-5]。Caveolin-1 是小窩的主要結構蛋白之一,是一個178-aa 的質膜蛋白,它在細胞質中采用具有N 端和C 端的發夾狀結構,其中心結構域包含在質膜中,在一些神經元和星形膠質細胞中被發現,但主要是存在于大腦血管內皮細胞中[6-7]。
Caveolin-1 作為細胞信號轉導的負調控或正調控,主要取決于所研究的細胞類型和特定的細胞信號轉導通路。一方面,Caveolin-1 可參與維持血腦屏障完整性,發揮神經保護作用[8]。研究表明,內源性Cav-1 在缺血后最初幾天,可以促進新生血管形成、星形膠質細胞增生和瘢痕形成,具有潛在的保護作用[9]。在Bend.3 細胞氧糖剝奪模型中,顱內慢病毒注射靶向Cav1 的短發夾RNA 降低Caveolin-1 的表達,能抑制苦參堿的神經保護功能,破壞神經功能的完整性[10]。在大腦中動脈阻塞(MCAO)大鼠模型中,Cav-1 可通過抑制TJ 蛋白表達的降解來改善血管源性水腫[11]。同時另一方面,Cav-1 在腦出血后早期腦血腦屏障損傷中起著有害作用,Cav-1 敲除的小鼠腦出血后1 天的腦損傷體積更小,神經功能缺損更輕,腦水腫更少,神經元死亡更少[12]。
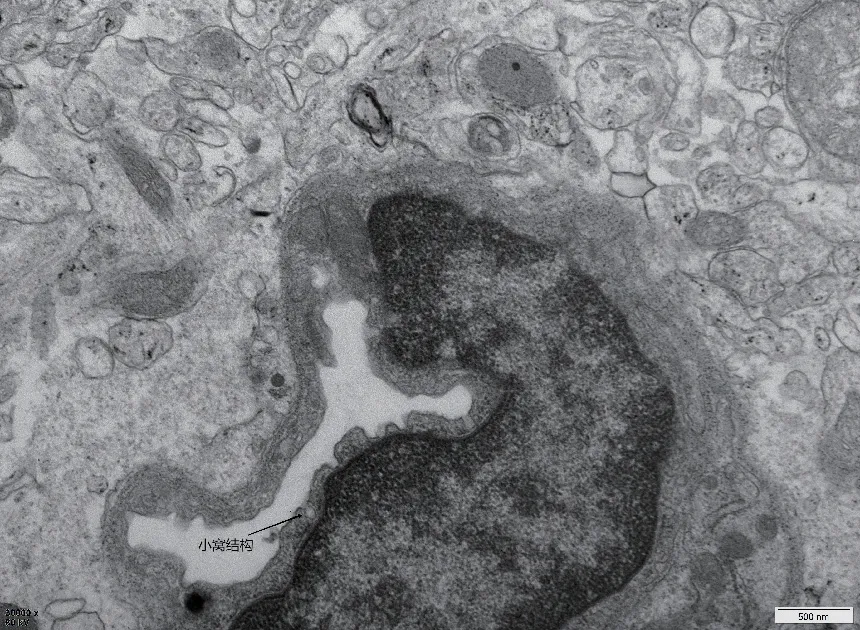
圖2 小窩結構(實驗室拍攝的透射電鏡照片)
Caveolin-1 調節血腦屏障通透性改變
1 調節腦微血管內皮細胞
腦微血管內皮細胞(Brain Microvascular Endothilial Cells,BMECs)是血腦屏障的基本骨架和關鍵結構,是體循環和腦實質之間交換分子的主要界面。相鄰ECs 之間的緊密連接(TJs)復合物保證了腦內皮的物理緊密性[13]。研究發現,Cav-1 在內皮細胞機制轉導中發揮重要作用,Cav-1 的缺乏會降低內皮細胞沿血流方向排列的能力,同時cave-1 與血流誘導的血管舒張、血管重塑、NO 生成受損等密切有關。Elizabeth Le Master 等研究發現,Cav-1 可能通過調控CD36 的表達,調節oxLDL 的攝取和oxLDL 誘導的內皮硬化,Cav-1 基因缺失可以消除oxLDL 誘導的內皮硬化[14]。內皮型一氧化氮合酶(eNOS)是血管壁一氧化氮(NO)的主要來源,eNOS 在血管內皮中表達,NO不僅是最重要的內皮源性血管舒張因子,參與調節基線血管張力和功能性充血,而且在神經功能的維持中發揮重要作用[15]。缺氧應激導致eNOS 活性受損和NO 生物利用度降低,使eNOS 和BH4 解耦聯,無法催化L-精氨酸產生NO,而與氧(O2)相互作用產生超氧化物,從而影響血管內皮結構與功能穩態。在內皮細胞中,Cav-1 磷酸化負調控eNOS 的活性,在缺血缺氧誘導CAV1 與eNOS 競爭性結合增加,特異地導致eNOS 在絲氨酸1177 位點磷酸化的減少,并導致NO生成的減少,從而出現腦灌注不足,內皮細胞功能障礙和CBF 失調,加重缺血缺氧損傷,進一步損害血腦屏障[16-18]。
2 調節緊密連接
緊密連接蛋白主要由跨膜蛋白、胞質附著蛋白、細胞骨架蛋白三類組成,Esther Sasson 等人研究血腦屏障緊密連接納米結構發現,在小鼠發育過程中,滲透性TJs 首先對大分子具有限制性,然后才對小分子具有限制性,在這一成熟過程中,claudin-5 蛋白排列緊密,同時,claudin-5 和ZO1 蛋白是以離散簇的中斷線組織,形成珠狀結構,防止有害物質通過[19]。缺氧會引起內皮細胞緊密連接的破壞觸發血腦屏障(BBB)損傷并誘導血管源性水腫。Yan Xue 等人研究表明,缺氧通過激活NRF1 誘導Cav-1 表達上調,下調了緊密連接蛋白,阻斷cav -1 介導的細胞內轉運可改善缺氧內皮細胞內TJs 的完整性,有效抑制血腦屏障通透性和腦水含量的增加[20]。
基 質 金 屬 蛋 白 酶(matrix metalloproteinase,MMPs)是一組鋅離子依賴性蛋白酶,主要的功能為降解細胞外基質(extracellular matrix,ECM),可影響緊密連接(TJ)的重塑和降解。在BBB 完整性中的起著重要作用[21]。MMP-9 主要在內皮細胞表達。MMP-2的表達細胞主要有小神經膠質細胞、脂肪細胞、星形膠質細胞、血管內皮細胞。急性腦損傷時,MMP-9 和MMP-2 的高表達加重了血腦屏障的破壞、腦水腫[22]。腦缺血再灌注過程中,Caveolin-1 可以通過抑制RNS的產生和MMPs 的活性,阻止TJ 蛋白的降解,保護BBB 的完整性[23-24]。在體外培養的腦微血管內皮細胞(BMECs)敲除Cav-1 和體內敲除Cav-1 小鼠(KO)中,Cav-1 敲除顯著增加了BMECs 中MMPs 的活性,介導了血腦屏障的損傷[25]。NMDA 是一種谷氨酸類似物,可以激活n-甲基-d-天冬氨酸受體(NMDAR),NMDA 暴露抑制了TJ 蛋白 occludin 和 claudin-5 的表達,誘導ZO-1,Cav-1 和ERK1/2 磷酸化的下調,用ERK1/2 抑制劑可防止 NMDA 誘導的緊密連接 ZO-1功能障礙以及腦中的 Cav-1 的表達。靶向Caveolin-1相關的ERK1/2 信號可能是治療由緊密連接蛋白表達減少引起的血腦屏障功能障礙的方法[26]。研究表明,激活ERK1/2 信號通路有利于降低缺血大鼠腦組織中MMP-9 的活性,減少神經細胞死亡[27]。
3 調節P-糖蛋白(P-gp)轉運體
P-糖蛋白(P-gp)是ATP 結合盒轉運體家族中重要的外排轉運體,能轉運內源性代謝產物或外源性異物誘導作用,對維持細胞內環境穩態有重要作用。越來越多的證據表明,ABC 運輸蛋白p -糖蛋白(Pgp)是血腦屏障的主要成分,腦源性代謝物通過血腦屏障的腦-血運輸障礙是各種中樞神經系統退行性疾病的主要發病機制[28]。一項隨機對照實驗表明,與對照組相比,輕度AD 受試者的頂顳葉、額葉、后扣帶皮層和海馬區血腦屏障p -糖蛋白活性顯著降低[29]。同時如在腫瘤患者的治療過程中,P-糖蛋白(P-gp)的存在,使治療藥物排出細胞外,使藥物達不到有效生物利用度及多藥耐藥的存在。從外排轉運系統出發探討Cave-1 調控P-糖蛋白(P-gp)介導血腦屏障通透性改變,調節內環境的穩定。
研究發現,P-gp 除主要表達于腦腫瘤毛細血管內皮細胞的腔膜面外,也部分表達于膠質細胞的足突,共同發揮藥物外排功能。熒光雙染證實P-gp 與Caveolin-1 在細胞膜上存在共表達現象,內皮細胞的腔膜面以及部分腔膜面與基底面的交界處存在 P-gp和Cav1 的共表達區域,說明 Cav1 可能參與了對 P-gp在細胞膜上的物質轉運作用的功能調節[30]。cave-1是Src 等非受體酪氨酸激酶的底物,Src 激酶在小穴介導的內吞作用啟動早期被激活。cave-1 的酪氨酸磷酸化發生在酪氨酸-14 處,可誘導小泡囊泡和/或融合[31-32]。Cav1 是一種調節P-gp 功能的支架蛋白,Src 激酶的激活導致Cav1 的Tyr14 快速磷酸化,誘導P-gp 的內化,從而降低血腦屏障的皮質醇外泄功能[33]。Yanling Fan 等人研究發現,Rack1 作為信號樞紐,可以介導Src 與P-gp 結合,從而促進Src 磷酸化Cav1,消除Cav1 對P-gp 的抑制作用[34]。
血管內皮生長因子(VEGF)是一種多效細胞因子,能促進細胞生長、存活和血管生成,VEGF 在大腦和/或大腦微血管系統中的過表達與中樞神經系統病理相關,包括阿爾茨海默病、腦瘤、缺血和腦損傷。Hawkins Brian T and Sykes Destiny B 等人研究發現,使用tyr14 磷酸化特異性抗體,發現將腦毛細血管暴露于VEGF 或Src 激活肽YEEIP 增加了腦毛細血管中酪氨酸-14 小泡蛋白-1 的磷酸化,增加了小洞穴蛋白-1 與p -糖蛋白的關聯,并對培養的腦內皮細胞中p -糖蛋白的轉運活性起到負調控作用,腦室內注射VEGF 增加了p -糖蛋白底物嗎啡和維拉帕米的腦分布[35]。綜上所述,P-糖蛋白是血腦屏障重要的外排轉運體,cave-1 通過不同信號通路調節p -糖蛋白的轉運活性,調節血腦屏障通透性。
4 調節胞吞轉運作用
胞吞作用又稱內吞作用或入胞作用,它是質膜內陷,包裹細胞外物質,形成胞吞泡,然后脫離細胞膜將其裹進并輸入細胞內的過程。根據胞吞物質大小可分為吞噬作用和胞飲作用兩種類型。細胞對固體顆粒的攝入過程稱為吞噬作用,對液體及溶解在液體中的溶質的攝入過程稱為胞飲作用[36]。胞吞轉運途徑是必需大分子物質(如多肽激素、金屬載體、脂蛋白等)入腦的主要途徑,在胚胎發育和成年生理狀態下,低水平的胞吞轉運抑制血腦屏障通透性,而在多種病理條件下其水平升高則對血腦屏障的破壞具有重要的促進作用[37]。
Hamid Salimi 等人研究表明委內瑞拉和西方馬腦炎病毒病毒通過小洞穴蛋白-1(Cav-1)介導的胞吞作用(Cav-MT)通過完整的血腦屏障向中樞神經系統進行血行播散[38]。蜘蛛毒液(PNV)誘導血腦屏障(BBB)的破壞,PNV 富含影響谷氨酸處理和干擾離子通道生理的神經毒性肽。小泡蛋白-1 是控制小泡形成的中心蛋白。研究表明pnv 誘導的血腦屏障打開與形成小泡框架的小泡蛋白-1α 的高表達有關,與內化和增強的胞吞過程有關[39]。聚焦超聲(FUS)聯合一定劑量的微泡治療可通過上調小泡蛋白-1 的表達水平,進而上調小泡的數量,通過小泡介導的跨細胞途徑增強血腦屏障的通透性[40]。
5 調節白細胞粘附作用
白細胞粘附分子可以抑制血液免疫細胞的粘附和轉運入腦,趨化因子和趨化因子受體在免疫細胞的募集和激活上起著重要的調控作用,腦缺血后調控外周免疫細胞浸潤入腦,例如單核/巨噬細胞。CC 趨化因子受體2(CCR2)是趨化因子受體中的重要一員,與其配體CC 趨化因子配體2(CCL2)在神經炎癥中發揮著重要的作用[41]。在腦實質中產生的趨化因子CCL2 如何招募位于血腦屏障(BBB)高度不透水的內皮后的白細胞,一直是一個悖論。Shujun Ge 等人研究表明CCL2 在炎癥發作時沉積在腦微血管壁側,可以通過血腦屏障傳遞促進白細胞的募集,Caveolin-1參與了ccl2 的這種運輸,小泡蛋白-1 的siRNA 敲除,導致CCL2 轉運顯著增加,增加血腦屏障通透性[42]。
各種藥物調節Caveolin-1 介導血腦屏障通透性改變
Caveolin-1 作為調節血腦屏障通透性改變的重要靶點,許多學者通過研究藥物干預Caveolin-1 的表達影響血腦屏障通透性改變。研究表明,抑制Cav-1活化后可減輕N- 甲基-D 天冬氨酸(NMDA)誘導HBEC-5i 中緊密連接蛋白ZO-1 的破壞,從而減輕緊密連接屏障的通透性[43]。雌二醇能增加局灶性腦缺血(MCAO)大鼠Caveolin-1、VEGF 的表達,改善模型大鼠的神經功能缺失癥狀[44]。三七有效成分三七皂苷通過下調MMP2、9,上調半暗帶zo1 和claudin5的表達和重新分配環抱素和caveolin,降低了BBB 滲漏和腦梗死體積,減弱了卒中后大鼠神經功能缺損[45]。氧化苦參堿能夠通過下調CAV1 和MMP9 表達改善腦缺血再灌注損傷后血腦屏障完整性[46]。養血清腦丸治療的高血壓大鼠,TJ 蛋白表達降低,而小窩的主要蛋白 Caveolin-1 的表達增加,能保持內皮完整,減輕能量代謝紊亂抑制大鼠海馬和皮層的血管周圍水腫[47]。苦碟子注射液能抑制腦內皮細胞中的Caveolin-1 和 Src 活性,改善血流量,減少梗塞體積和神經功能缺陷,保護血腦屏障通透性[48]。Caveolin-1磷酸化氧化應激導致血管通透性加重,去偶聯的槲皮素可以通過抑制Caveolin-1 磷酸化而保護內皮細胞,起到預防氧化應激狀態下血管通透性改變的作用[49]。人參皂苷是人參根中主要的具有生物活性化合物,張高嬌等研究表明沉默Cav-1 后人參皂苷Rb1 可以改善MCAO 小鼠的神經行為學評分,減少MCAO 小鼠腦梗死體積與腦含水量,增加Bcl-2/Bax 的比率,具有腦保護作用[50]。
總 結
血腦屏障結構和功能完整是治療腦缺血缺氧的重要突破口,經過以上研究表明,Cave-1 可通過作用于血管內皮細胞功能、緊密連接蛋白,聯合控制物質外排的P 糖蛋白、胞吞轉運、白細胞黏附等多個方面一起調控血腦屏障通透性。其中Cave-1 與VEGF 關系密切,病理性升高的 VEGF 可通過通過下游 PI3K/AKT 通路增強血管通透性和滲漏,并破壞血腦屏障的完整性,促進血腦屏障泄露,其中蛋白激酶 B(AKT)可特異性磷酸化內皮一氧化氮氧合酶(endothial nitric oxide synapse,eNOS),而在靜息狀態下,eNOS 鈣結合域在內皮細胞中特異性與小窩蛋白 Caveolin-1 結合而失活,當缺血缺氧發生時,eNOS Ser1177 位點磷酸化從 Caveolin-1 解離并催化 L-精氨酸產生一氧化氮(NO)介導血管內皮響應血流量調節。同時,VEGFR-2 是 VEGF 在 CEC 效應的主要受體介質,VEGF 結合 VEGFR-2 同時可激活細胞內酪氨酸激酶Src,Src 是 Caveolin-1 活化的關鍵激酶,既Src 介導的Caveolin-1 Tyr14 磷酸化會增加其對 eNOS 的競爭性結合,減少后者 Ser1177 磷酸化并提高 Thr495 磷酸化,抑制 eNOS 對腦血流變化的內皮響應,減少 NO 的生成,從而出現腦灌注不足、CEC 功能障礙和 CBF 失調、轉運功能障礙的惡性循環,在后期的實驗研究中可以進一步探討。
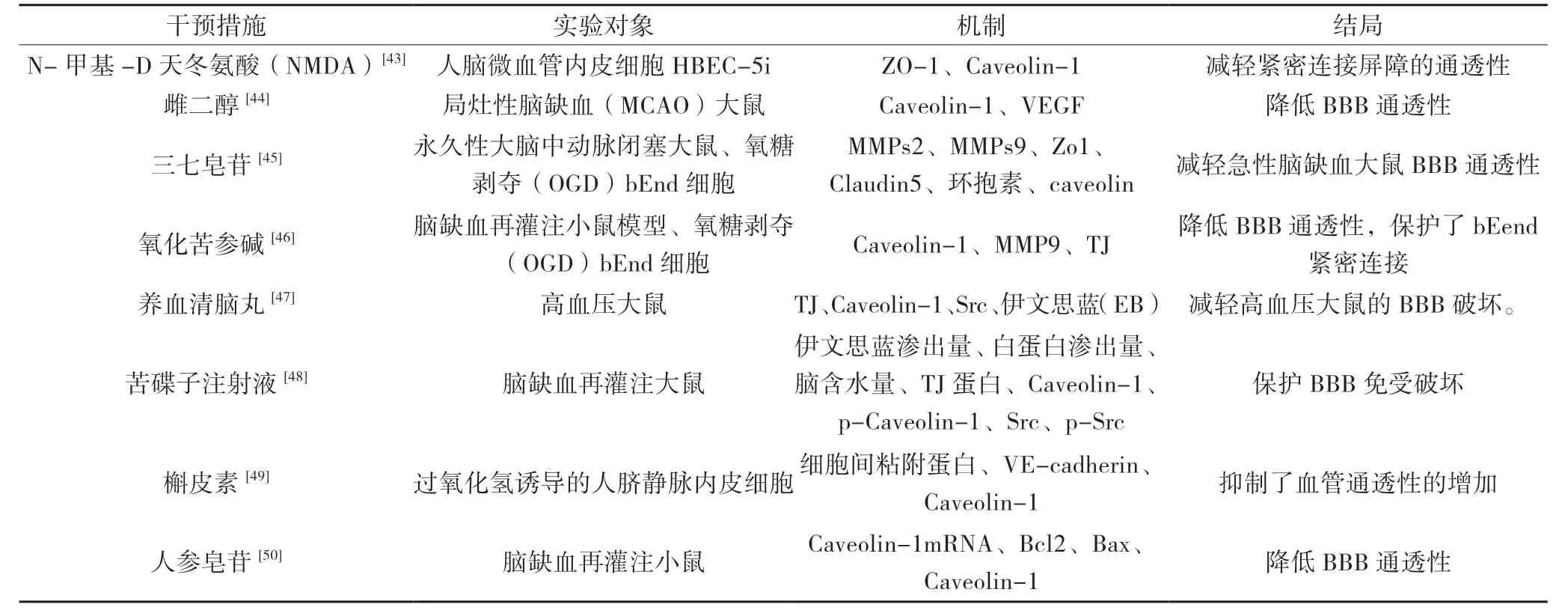
表1 各種藥物調節Caveolin-1 保護血腦屏障通透性
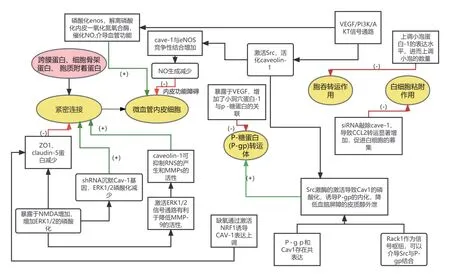
圖3 Cave-1 調控血腦屏障通透性主要機制示意圖

