加氧對碳化渣低溫氯化選擇性影響的熱力學分析
岳 東,溫良英*,陳 榮,王建鑫,,楊仰軍
(1.重慶大學材料科學與工程學院,重慶 400044;2.攀鋼集團攀枝花鋼鐵研究院有限公司,四川 攀枝花 617000)
0 引言
TiCl4作為生產(chǎn)鈦白粉和海綿鈦的重要原料,其各種制備工藝已得到廣泛關(guān)注和研究[1-3]。高溫碳化高鈦高爐渣(即碳化鈦渣,簡稱“碳化渣”)-低溫(500 ℃左右)選擇性氯化工藝相較于熔鹽氯化和沸騰氯化工藝具有氯化溫度低、處理能力強,對原料中鈣鎂氧化物含量無嚴格限制等優(yōu)點,已成為目前最具工業(yè)應用前景的工藝技術(shù)[4-5]。然而,由于仍然存在部分鈣鎂雜質(zhì)氧化物的氯化,生成不易揮發(fā)的高沸點物質(zhì)CaCl2、MgCl2,這兩種氯化物在氯化爐內(nèi)還可形成共熔溫度為617 ℃的固溶體mCaCl2·nMgCl2。雖然氯化溫度只有500 ℃左右,但TiC 氯化反應過程中放出大量的熱量會導致爐內(nèi)局部溫度升高達到或超過固溶體mCaCl2·nMgCl2的熔化溫度,從而形成液相,引起顆粒物料粘結(jié)甚至影響碳化渣流態(tài)化穩(wěn)定性。如何提高碳化渣中鈦的氯化率同時擬制或減少鈣鎂雜質(zhì)氧化物的氯化成為亟待探索解決的重要問題。
彭毅[6]從熱力學角度分析認為,抑制CaO、MgO等雜質(zhì)氧化物氯化的關(guān)鍵在于阻止氧化物的加碳氯化。如果在反應體系中引入適量的氧氣,使生成的碳燃燒生成CO2,改變TiC 氯化的吉布斯自由能和平衡常數(shù),可以有效地抑制鈣鎂等雜質(zhì)氧化物加碳氯化反應,從而達到選擇性氯化提鈦的目的。劉曉華[7]進行了氧氣攜帶氯氣氯化碳化高爐渣初步試驗研究,結(jié)果表明有氧氯化反應相較于無氧氯化反應的氯化殘渣粘結(jié)程度減弱,表明氧氣的引入對于緩解物料粘結(jié)有一定作用等。但目前尚未見關(guān)于引入氧氣對碳化渣低溫氯化提鈦與抑制鈣鎂雜質(zhì)氧化物氯化反應影響作用的研究報道。與此相關(guān)的其它研究發(fā)現(xiàn),Taki[8]等人利用氯氣和氧氣的混合氣體在1 223 K 溫度下進行了從磷礦中選擇性提取鈾的研究,結(jié)果表明,引入氧氣可以降低鋁、磷和硅氯化率,同時鈾的氯化率達到90%以上;M Hiroyuki[9-10]等人研究了從電弧爐粉塵中回收重金屬的工藝,粉塵中主要含鐵、鉛和鋅的氧化物,在高氯高氧分壓下,鐵的穩(wěn)定相為氧化物,而鋅和鉛的穩(wěn)定相為氯化物,表明通過引入含有氯氣和氧氣的混合氣體可以對重金屬進行選擇性氯化過程進行回收;Jungshin K[11]等人進行了低品位鈦礦在高氧化學勢下的選擇性氯化制備高品位TiO2同時去除礦石中的鐵的基礎(chǔ)研究,F(xiàn)e-O-Cl 和Ti-O-Cl 體系的化學勢圖表明,當Cl2和O2分壓位于一個合適的區(qū)域時鐵氧化物將被氯化形成FeClx(l,g)[x=2,3],而鈦氧化物將不被氯化而仍以TiO2(s)形式保留下來。試驗結(jié)果表明在一定條件下鐵以氯化鐵(FeClx[x=2,3])形式被選擇性去除,并得到了98%的TiO2。說明加氧有協(xié)同或擬制體系中不同物質(zhì)氯化反應進程的作用,以實現(xiàn)選擇性氯化提取分離方法的可行性。
筆者采用Factsage 熱力學計算軟件FactPS 和Ftoxid 數(shù)據(jù)庫對加氧氯化碳化鈦渣的反應進行分析,探索不同氧氯比對碳化鈦渣中各物質(zhì)氯化反應的影響及選擇性控制條件,并結(jié)合實際碳化渣組分含量,計算分析合適的氧氣引入量、氧氯氣體占比及其與碳化渣中TiC、CaO、MgO 組分含量變化的調(diào)控關(guān)聯(lián)關(guān)系。
1 熱力學計算方法及參數(shù)設(shè)置
熱力學性質(zhì)和相平衡用Gibbs 自由能最小算法計算,在等溫、等壓的多元體系中,平衡條件為體系的吉布斯自由能G最小,即:
式中,G為Gibbs 自由能,J;i為體系中組元;j為組元i中元素;ni為組元i物質(zhì)的量,mol;nj為元素j物質(zhì)的量,mol;μi為組元i的化學勢,J/mol;μi0為組元i的標準化學勢,J/mol;?i為組元i在溫度T下的原子數(shù),mol;R 為理想氣體常數(shù),J/(K·mol);T為體系溫度,K。
筆者應用熱力學計算軟件Factsage8.1,選擇配套的FactPS 和Ftoxid 數(shù)據(jù)庫,利用Reaction、Equilib 和Phase Diagram 模塊,以攀鋼高爐渣碳化后的碳化渣為研究對象,其主要化學成分及含量如表1所示。以低溫氯化溫度500 ℃為例,計算分析引入氧氣量多少對碳化渣中主要成分如TiC、CaO 和MgO 氯化反應的影響與調(diào)控條件。體系壓力均設(shè)為1.00 atm(0.1 MPa)。

表1 碳化渣的主要成分及含量Table 1 Main components and content of carbonized slag
2 結(jié)果與討論
2.1 加氧氯化反應趨勢的熱力學分析
為了預測碳化渣低溫氯化反應中引入一定含量的氧氣后對體系中各組分氯化反應的影響,利用Reaction 和Phase Diagram 模塊,分別計算了碳化渣低溫氯化反應過程中,體系中可能存在的反應在不同溫度下(100~1 000 ℃)的吉布斯自由能,以及提鈦主反應TiC-Cl2-O2體系在500 ℃條件下的平衡物相與氯氣和氧氣分壓的關(guān)系。
圖1 為各反應式中Cl2和C 分別以1.00 mol和0.50 mol 為基準的吉布斯自由能。由圖1 可見,當氯化溫度在500 ℃(圖中虛線所示)左右,未引入氧氣時,TiC、CaO 和MgO 均可發(fā)生氯化反應(圖1中①、②、③所示),且CaO 加碳氯化反應(圖1 中②C所示)的吉布斯自由能比TiC 直接氯化反應(圖1 中①)的吉布斯自由能更小,表明其氯化趨勢在低溫氯化提鈦爐內(nèi)較為明顯;當引入氧氣后,TiC可發(fā)生加氧氯化反應(圖1 中①1O和①2O所示),TiC 中的C 直接與O 結(jié)合形成CO 或CO2氣體,其反應吉布斯自由能明顯下降,表明氧氣的引入有促進選擇性氯化TiC 反應的趨勢,即碳化渣中的TiC在氧氣存在條件下的氯化趨勢更明顯。
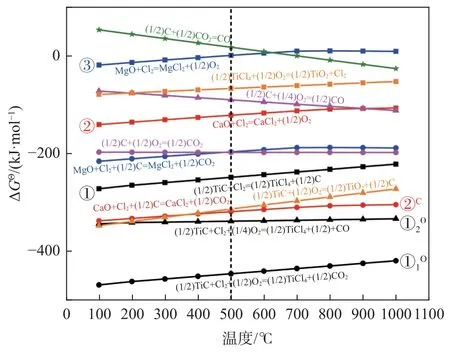
圖1 碳化渣低溫氯化各反應吉布斯自由能隨溫度的變化Fig.1 Change of Gibbs free energy of each reaction of carbonized slag chlorination at low temperature with temperature
以氯化溫度為500 ℃ 為例的提鈦主反應TiCCl2-O2體系,如圖2 陰影區(qū)域所示,在高氯低氧分壓條件下,反應產(chǎn)物可全部為穩(wěn)定的氣體gas,主要物質(zhì)(TiCl4、Cl2、CO 和CO2),這表明在碳化渣氯化過程中引入氧氣可阻止單質(zhì)碳的析出,適當調(diào)控有減緩甚至避免鈣鎂等雜質(zhì)氧化物因有碳協(xié)同的氯化反應發(fā)生。
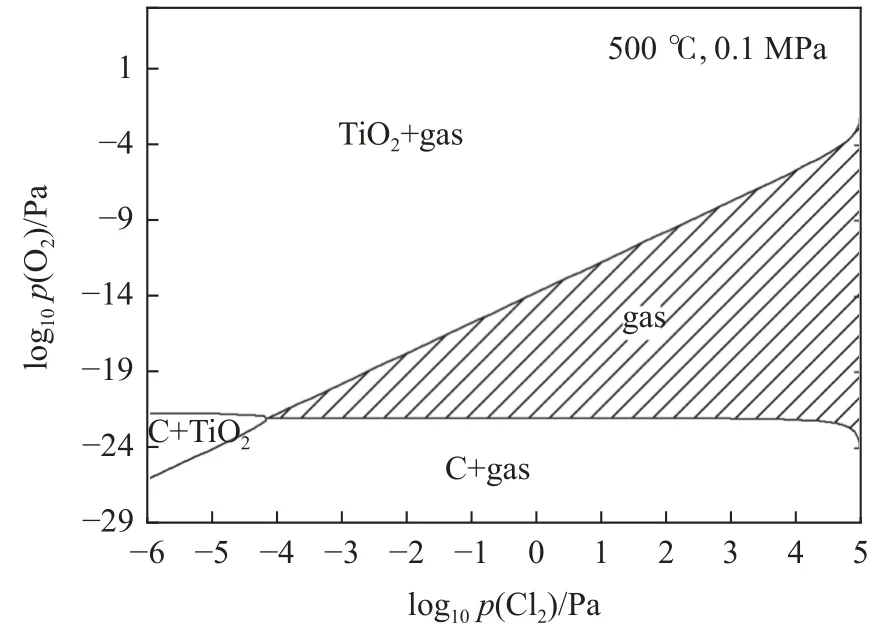
圖2 TiC-Cl2-O2 體系平衡物相隨氯氧氣體分壓變化規(guī)律Fig.2 The variation of equilibrium phase of TiC-Cl2-O2 system with partial pressure of oxychloride
2.2 加氧氯化對TiC、CaO 和MgO 氯化反應影響的熱力學分析
由表1 可得,碳化渣中TiC 與CaO、MgO 的摩爾比分別為1.00∶2.04 和1.00∶0.87。因此,設(shè)定TiC-CaO-MgO-Cl2-O2體系中TiC、CaO、MgO 的摩爾數(shù)分別為1.00、2.04、0.87 mol。采用Equilib 模塊計算了Cl2、O2含量變化對不同反應體系中鈣鎂氧化物氯化反應的影響。
圖3 為TiC-2.04CaO-0.87MgO-nCl2體系下平衡物相含量隨Cl2含量變化規(guī)律(Cl2含量變化以Cl2/TiC 摩爾比計)。由圖3 可見,隨著Cl2含量逐漸增加,體系中TiC 和CaO 均被逐漸氯化,其中含鈦物相轉(zhuǎn)變路徑為TiC→TiCl3→TiCl4;在Cl2含量約為3.50 mol 時TiC 含量減少至零,CaO 含量減少至0.04 mol;而體系中的MgO 在TiC 和CaO 未反應完全之前并未被氯化,其含量始終維持在初始值0.87 mol,表明TiC 和CaO 優(yōu)先于MgO 的氯化。為此,在后續(xù)計算中設(shè)定Cl2/TiC 摩爾比值最大為3.50。
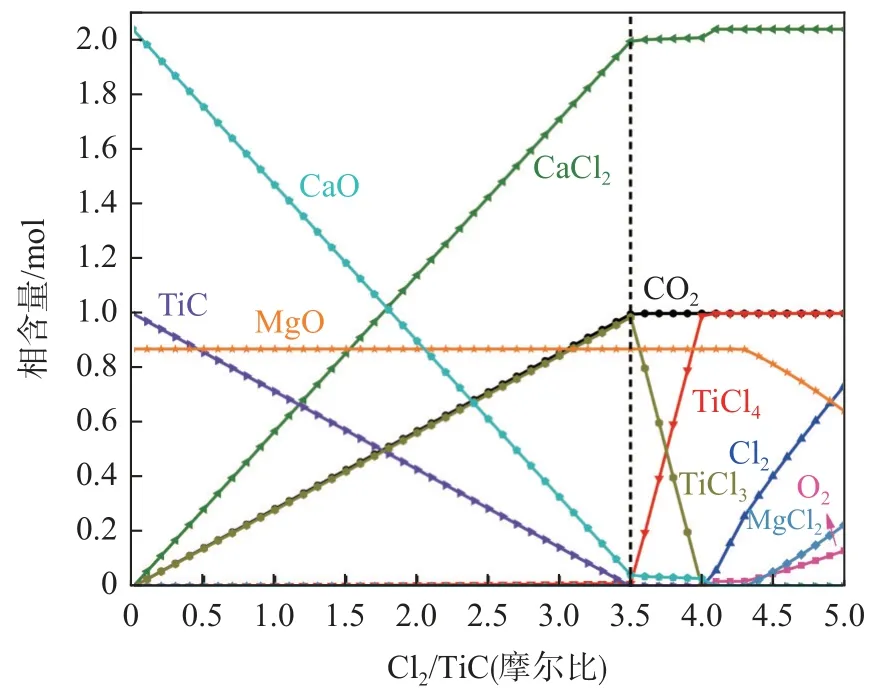
圖3 TiC-2.04CaO-0.87MgO-nCl2 反應體系平衡物相含量隨Cl2/TiC 摩爾比變化規(guī)律Fig.3 The variation of equilibrium phase content of TiC-2.04CaO-0.87MgO-nCl2 reaction system with Cl2/TiC molar ratios
圖4 為TiC-2.04CaO-0.87MgO-2.00 Cl2-mO2體系平衡物相含量隨O2含量變化規(guī)律(O2含量變化以O(shè)2/TiC 摩爾比計)。
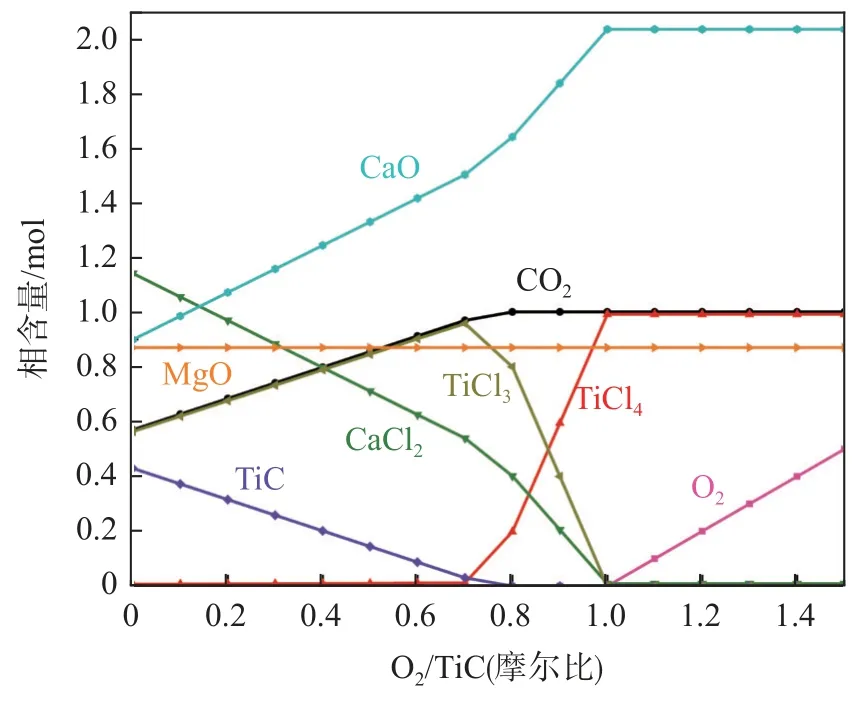
圖4 TiC-2.04CaO-0.87MgO-2.00 Cl2-mO2 體系平衡物相含量隨O2/TiC 摩爾比變化規(guī)律Fig.4 The variation of equilibrium phase content in TiC-2.04CaO-0.87MgO-2.00 Cl2-mO2 system with O2/TiC molar ratios
由圖4 可見,在TiC-2.04CaO-0.87MgO-2.00 Cl2-mO2體系中,無論是否引入氧氣,MgO 均未發(fā)生氯化反應,其含量一直維持0.87 mol 不變,因此,在后續(xù)文中不再闡述MgO 隨氯氣含量和氧氣含量的變化;未引入氧氣時,TiC 和CaO 均部分被氯化,而在體系中引入氧氣后TiC 氯化反應不僅可以得到促進,而且在達到最優(yōu)O2/TiC 摩爾比之前隨著引入氧氣含量逐漸增多,產(chǎn)生的CaCl2含量逐漸減少,表明CaO 的氯化反應在引入氧氣后受到抑制。
表2 為不同Cl2/TiC 摩爾比(以Cl2含量計為1.80~3.50)體系引入氧氣前后TiC 和CaO 氯化率變化規(guī)律,其中,引入氧氣后TiC 和CaO 的氯化率在最優(yōu)O2/TiC 摩爾比(定義為TiC 完全氯化且CaO 有最小氯化率)下得到,TiC、CaO 氯化率計算方法如下:
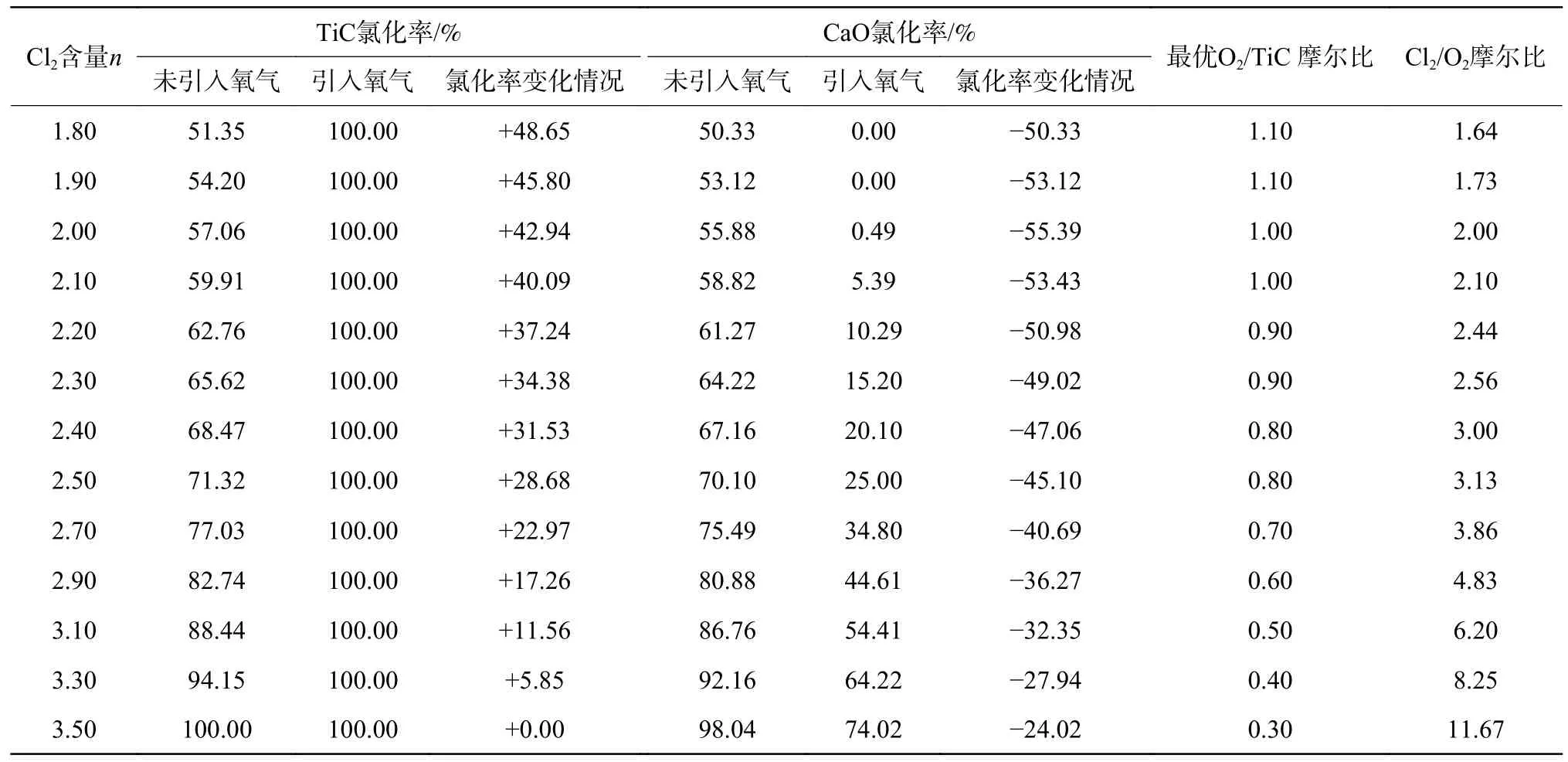
表2 TiC-2.04CaO-0.87MgO-nCl2-mO2 反應體系中各物相氯化率隨O2 含量變化規(guī)律Table 2 The variation of chlorination rates of various phases with O2 contents in the TiC-2.04CaO-0.87MgO-nCl2-mO2 reaction system
式中,M1和M2分別代表TiC 和CaO 的初始摩爾量;ΔM1和ΔM2分別代表TiC 和CaO 被氯化消耗的摩爾量;C1和C2分別代表TiC 和CaO 的氯化率。
由表2 可見,在不同Cl2含量下,未引入氧氣時,隨著Cl2含量增加即Cl2/TiC 摩爾比逐漸增大,TiC氯化率逐漸升高,但同時體系中CaO 的氯化率也升高;而引入合適量的氧氣后,CaO 氯化率減小了24.02%~55.39%。隨著Cl2/TiC 摩爾比從1.80 逐漸增加到3.50,完全氯化TiC 所需的最優(yōu)O2含量也從1.10 減小到0.30,主要是因為在氧氣存在下TiC 中的C 不以C 單質(zhì)形式析出,而是轉(zhuǎn)變成CO或CO2逸出氯化爐內(nèi),隨著體系中Cl2含量增加導致CaO 被氯化產(chǎn)生氧氣增多,達到補充作用,造成O2/TiC 摩爾比減小。因此,對于TiC-2.04CaO-0.87MgO-nCl2-mO2體系(n=1.80~3.50),當引入的氧氣量達到最優(yōu)時,Cl2/O2摩爾比為1.64~11.67,體系中TiC 氯化率可達到100.00%,而CaO 氯化率為0~74.02%。
2.3 加氧氯化分段式反應的氣氛與物料轉(zhuǎn)移的熱力學分析
為提高鈦的氯化提取率和降低氧化鈣等雜質(zhì)的氯化,有必要將碳化渣的低溫氯化進行分段調(diào)節(jié)控制。為確定反應氣體(氯氣和氧氣)組成及物料轉(zhuǎn)移臨界點,以低溫氯化溫度500 ℃為例,首先利用Phase Diagram 模塊計算了TiC-Cl2-O2體系的三元平衡相圖,如圖5 所示,該相圖共有四個不同的相區(qū)(TiC+TiO2+gas、TiC+gas、gas 和TiO2+gas),其中g(shù)as 相區(qū)的存在表明在合適的Cl2和O2比例下,反應產(chǎn)物可全部為氣體(主要氣體物質(zhì)為TiCl4、Cl2、CO 和CO2)。通過分析相圖并結(jié)合考慮存在CaO時TiC-CaO-Cl2-O2體系含鈦物相隨Cl2和O2含量增加時的反應轉(zhuǎn)變,綜合考慮確定了提高TiC 氯化率的同時減少或抑制氧化鈣等雜質(zhì)氧化物氯化的調(diào)控方案。

圖5 TiC-Cl2-O2 體系三元平衡相圖Fig.5 Ternary equilibrium phase diagram of TiC-Cl2-O2 system
由圖5 可知,TiC+TiO2+gas 相區(qū)與TiC+gas 相區(qū)間存在分界線AB,即體系中Cl2/O2摩爾比值為4.00,也即是當Cl2/O2摩爾比值小于4.00 時,在TiC 氯化反應處于AB 線的左側(cè)相區(qū),會有TiO2物相析出,反之,反應進程則在AB 線的右側(cè)相區(qū)內(nèi)進行,在圖中D 點以上區(qū)域沒有TiO2的產(chǎn)生。假設(shè)TiC 總量為1.00 mol,在TiC-Cl2-O2相平衡體系中設(shè)定Cl2/O2摩爾比值為4.00(圖5 中AB 線),此條件下TiC 在被氯化減少過程中體系物相變化路徑為:TiC→TiC+gas→gas→TiO2+gas。AB 線與gas單相區(qū)的上邊界和下邊界分別相交于圖5 中C 點和D 點,C 點處TiC 含量為0.285 mol,D 點處TiC含量為0.169 mol,表明當TiC 量維持在此區(qū)間時,被氯化的TiC 可全部轉(zhuǎn)變成TiCl4,若進一步氯化減少TiC 量則會有TiO2析出,不利于Ti 的進一步提取。
實際反應體系中存在可能被同時氯化的CaO,針對表1 中所示的碳化渣成分,計算Cl2/O2摩爾比為4.00 時的TiC-2.04 CaO-nCl2-0.25nO2體系平衡物相含量隨Cl2和O2含量變化的規(guī)律,如圖6 所示。由圖6 可見,當TiC 含量減少到0.285 mol 時,CaO含量為1.44 mol,TiC 和CaO 的氯化率分別為71.50%和29.41%;而當TiC 含量減少到0.169 mol 時,CaO含量為1.35 mol,TiC 和CaO 的氯化率分別為83.10%和33.82%。
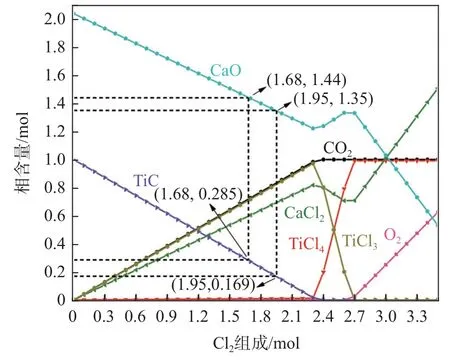
圖6 TiC-2.04CaO-nCl2-0.25nO2 體系平衡物相含量隨Cl2含量變化規(guī)律Fig.6 The variation of equilibrium phase contents with Cl2 content in TiC-2.04CaO-nCl2-0.25nO2 system
綜上,為獲得盡可能高的TiC 氯化收得率提取TiCl4,同時考慮盡可能擬制或降低體系中CaO 的條件下,反應氣體中Cl2/O2摩爾比值最小為4.00,碳化渣中TiC 摩爾質(zhì)量百分數(shù)減小到初始值的28.50%時即可將低溫氯化爐內(nèi)物料轉(zhuǎn)入下一階段的氯化爐內(nèi)。
以表1 碳化渣中TiC 質(zhì)量百分數(shù)13.80%為例計算,氯化反應前后組分含量變化情況如表3 所示,可知在第一階段氯化反應過程中將TiC 質(zhì)量分數(shù)從13.80%降低至4.02%時即可轉(zhuǎn)移爐料進行第二階段氯化反應,此時每100 g 碳化渣中的TiC 氯化反應消耗的Cl2量為0.39 mol(1.68×0.23 mol)。

表3 碳化渣加氧氯化不同階段組分含量變化(初始渣質(zhì)量以100 g 計)Table 3 Changes in component of carbonized slag during different stages of oxychlorination.(The initial slag mass is calculated as 100 g)
在第二階段氯化反應過程中,由于原料是經(jīng)過第一階段氯化后的渣,其中TiC 質(zhì)量分數(shù)較低,氯化反應發(fā)生后產(chǎn)生的新生碳含量也較少,使得CaO和MgO 的加碳氯化程度有限。以第一階段氯化后渣為原料,第二階段氯化TiC 的反應可采用氯氣作為反應氣體并混合著N2以混合氣體形式進入低溫氯化爐內(nèi)。經(jīng)過第一階段氯化反應過后,進行第二階段氯化反應時TiC 和CaO 的初始含量如表3 所示,根據(jù)其初始含量,利用Equilib 模塊計算得到0.07TiC-0.33CaO-nCl2體系平衡產(chǎn)物含量隨Cl2含量變化規(guī)律,如圖7 所示。由圖7 提取得到不同Cl2含量下TiC 的質(zhì)量分數(shù)以及TiC 和CaO 的氯化率,見表3。隨著N2和Cl2混合氣體中Cl2比例逐漸增加,渣中TiC 被進一步氯化使其質(zhì)量百分數(shù)逐漸降低,而由于CaO 也會發(fā)生部分氯化反應導致渣中CaO 的氯化率也進一步增加。當通入的Cl2總含量與殘渣中TiC 總含量的摩爾比值大于1.43(0.10/0.07)時,第二階段氯化反應過后渣中TiC 質(zhì)量百分數(shù)可降低至2.41%以下。
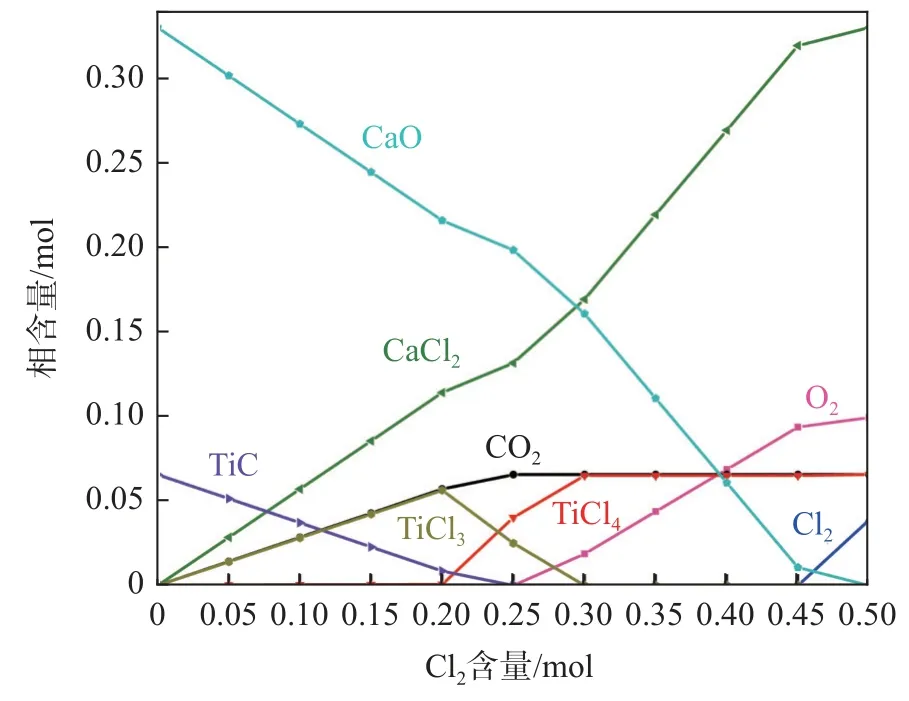
圖7 0.07TiC-0.33CaO-nCl2 反應體系平衡物相含量隨Cl2含量變化規(guī)律Fig.7 The variation of equilibrium phase content of 0.07TiC-0.33CaO-nCl2 reaction system with Cl2 contents
為了更加清晰地顯示在碳化渣低溫氯化反應中是否引入氧氣對總Cl2消耗量及CaO 氯化的影響,同樣以兩段氯化反應的方式并以前文所得到的第一階段中TiC 的氯化限度為標準,根據(jù)圖3 計算了碳化渣第一階段氯化反應未引入氧氣(即直接氯化)時一、二階段氯化反應前后渣中組分及含量變化,結(jié)果如表4 所示。由圖3 中TiC 含量隨Cl2含量變化規(guī)律計算出碳化渣直接氯化第一階段中當TiC 含量減小至初始含量的28.50%時,Cl2/TiC 摩爾比值為2.50。因此,對于表1 中所示的碳化渣實際組分含量推算得到第一階段氯化反應消耗的Cl2含量為0.58 mol(2.50×0.23 mol)。在碳化渣直接氯化的第二階段反應中,TiC 和CaO 的初始含量如表4 所示,根據(jù)其初始含量,利用Equilib 模塊計算得到0.07TiC-0.14CaO-nCl2體系平衡產(chǎn)物含量隨Cl2含量變化規(guī)律,如圖8 所示。由圖8 提取得到混合氣體中不同Cl2含量下TiC 的質(zhì)量分數(shù)以及TiC 和CaO 的氯化率,見表4。當碳化渣中TiC 的氯化率相同時,與表3 中碳化渣加氧氯化反應CaO 的氯化率相比,直接氯化反應時CaO 的氯化率較高。
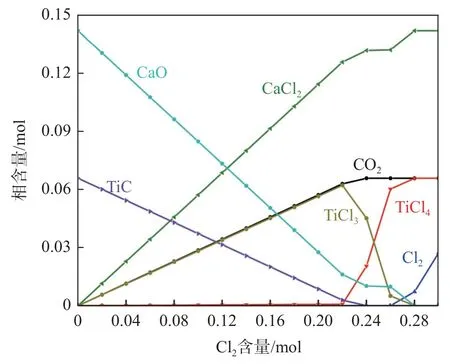
圖8 0.07TiC-0.14CaO-nCl2 反應體系平衡物相含量隨Cl2含量變化規(guī)律Fig.8 The variation of equilibrium phase content of 0.07TiC-0.14CaO-nCl2 reaction system with Cl2 contents
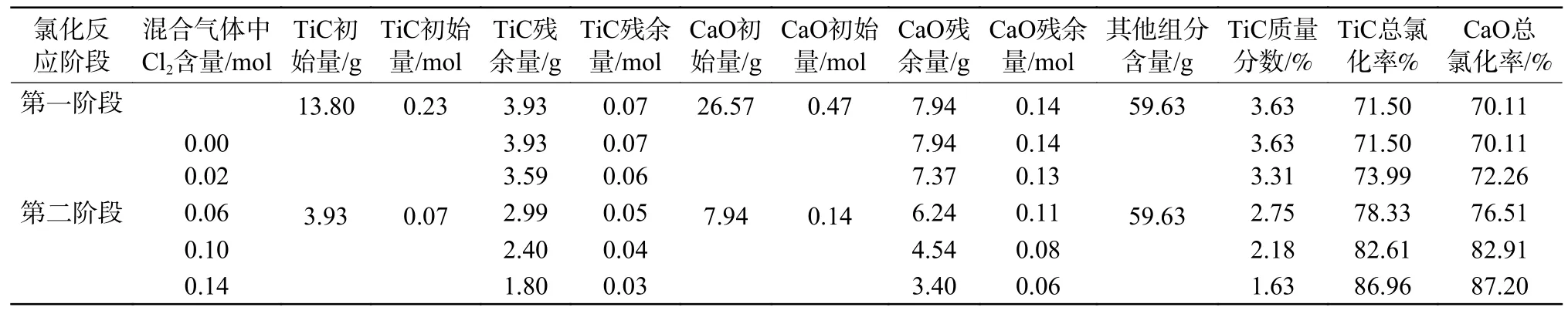
表4 碳化渣直接氯化不同階段組分含量變化(初始渣質(zhì)量以100 g 計)Table 4 Changes in composition and content of slag before and after the first stage chlorination reaction without introducing oxygen.(The initial slag mass is calculated as 100 g)
圖9 和圖10 分別是表1 中TiC 和CaO 質(zhì)量分數(shù)條件下碳化渣加氧氯化和直接氯化時不同反應階段TiC 質(zhì)量分數(shù)以及TiC 和CaO 的氯化率隨氯化氣體中Cl2含量變化的規(guī)律。由圖9 和圖10 對比可知,當?shù)谝浑A段氯化反應中碳化渣的氯化率相同時(71.50%),加氧氯化所需的Cl2量(0.39 mol)小于直接氯化所需的Cl2量(0.58 mol),且渣中CaO 的氯化率也減小40.72%。當氯化反應完成且渣中TiC 質(zhì)量分數(shù)降低至2.50%時,對直接氯化反應而言,第二階段氯化反應所需的Cl2量為0.074 mol,兩個氯化階段Cl2的總消耗量為0.654 mol;而對加氧氯化反應而言,第二階段氯化反應所需的Cl2量為0.096 mol,兩個氯化階段Cl2的總消耗量為0.486 mol。當渣中TiC 質(zhì)量分數(shù)均降低至2.50%時,加氧氯化比直接氯化Cl2總消耗量減小25.69%((0.654-0.486)/0.654),而渣中CaO 總氯化率減小37.74%。

圖9 碳化渣加氧氯化不同反應階段TiC 質(zhì)量分數(shù)、TiC 氯化率和CaO 氯化率隨Cl2 含量變化規(guī)律Fig.9 The variation of TiC mass fraction,TiC chlorination rate,and CaO chlorination rate with Cl2 contents during different reaction stages of carbonized slag oxychlorination

圖10 碳化渣直接氯化不同反應階段TiC 質(zhì)量分數(shù)、TiC氯化率和CaO 氯化率隨Cl2 含量變化規(guī)律Fig.10 The variation of TiC mass fraction,TiC chlorination rate,and CaO chlorination rate with Cl2 contents during different reaction stages of direct chlorination of carbonized slag
綜上可知,在碳化渣低溫氯化反應過程中引入適當?shù)难鯕獠粌H可降低反應時氯氣消耗量,還可降低渣中CaO 的氯化率,與直接氯化相比,對抑制渣中CaO 氯化從而達到減緩低溫氯化爐內(nèi)物料粘結(jié)問題具有顯著優(yōu)勢。
3 結(jié)論
利用Factsage8.1 熱力學軟件分析了引入氧氣對碳化鈦渣中TiC、CaO 和MgO 氯化反應的影響,以及平衡物相及含量隨氯氧比例的變化規(guī)律,通過分析熱力學計算結(jié)果可得:
1)低溫氯化爐內(nèi)引入氧氣可降低碳化渣中TiC 氯化反應標準吉布斯自由能,提高TiC 氯化反應趨勢使其氯化順序位于CaO 和MgO 之前,達到選擇性氯化提鈦目的。
2)在TiC-2.04CaO-0.87MgO-nCl2體系中,當Cl2/TiC 摩爾比低于3.50 時,MgO 不發(fā)生氯化反應。在同一Cl2/TiC 摩爾比條件下,隨著O2含量逐漸升高(即Cl2/O2摩爾比值逐漸減小),TiC 氯化率逐漸升高;雖然此時CaO 的氯化率也升高,但相較于未引入氧氣,CaO 的氯化率減少了24.02%~55.39%。
3)在碳化渣加氧分段氯化反應中,第一段氯化反應過程中最佳氯氧氣體摩爾比為4.00∶1.00,碳化渣中TiC 質(zhì)量分數(shù)從13.80%氯化減少至4.02%時即可結(jié)束第一階段氯化反應;第二階段氯化反應中無需引入氧氣,采用N2+Cl2的混合氣體,其中總Cl2含量與總TiC 含量摩爾比大于1.43 時,可使氯化尾渣中TiC 的質(zhì)量分數(shù)降低至2.50%以下。
4)碳化渣加氧氯化反應與直接氯化反應相比,達到相同目標條件(TiC 氯化率均為71.50%)時第一階段氯化反應中CaO 氯化率減小40.72%;經(jīng)過兩段氯化反應渣中TiC 質(zhì)量分數(shù)降低至2.50%時,加氧氯化比直接氯化Cl2總消耗量減少25.69%,渣中CaO 總氯化率減小37.74%。
致謝
論文作者特此感謝攀鋼集團有限公司、釩鈦資源綜合利用產(chǎn)業(yè)技術(shù)創(chuàng)新戰(zhàn)略聯(lián)盟項目(FTLM2021)“低溫氯化流化床多相反應行為及調(diào)控研究”的支持。

