SOLO 分類理論下“價—類”二維圖在高三一輪氮元素及其化合物復習中的應用策略
金敖然
(廣西南寧市第三中學)
元素及其化合物的復習是高三化學一輪復習中的重要模塊,在高考化學試題中占有相當大的比重,經常出現在STSE 問題、離子方程式的正誤判斷、元素化合物性質、化學實驗基礎、陌生方程式書寫、工藝流程、綜合實驗等試題中.然而,這部分知識比較零散,記憶性內容較多,僅憑機械性的記憶,容易造成各知識點沒有產生聯系而相對孤立,學生學得不扎實,因此不能綜合應用,時間一長所學知識又容易產生混淆甚至遺忘.針對上述問題,學生可以嘗試在SOLO(Structure of t he Observed Learning Outcome,可觀察的學習結果的結構)分類理論基礎上,應用“價—類”二維圖將氮元素及其化合物知識進行優化整合,構建單元復習進階模型,形成以核心概念為主軸,從現象到本質,從記憶知識到理解、綜合應用,從低到高的進階式學習,進而培養學生面對復雜情境,分析問題、解決問題的學科素養和關鍵能力.
1 SOLO 分類理論與“價—類”二維圖
SOL O 分類理論是比格斯在皮亞杰等學者的研究基礎上提出的.SOLO 理論將思維發展水平分為5個遞進的層次.1)前結構水平.思維處于低水平認知,對化學知識認知模糊、易混淆,不能解決化學問題.2)單點結構水平.僅能掌握一個知識或信息,缺乏知識間的聯系,解決的化學問題相對片面,沒有整體觀.3)多點結構水平.能夠結合多個知識、信息解決化學問題,但知識與信息之間沒有進行整合,未能形成知識網絡.4)關聯結構水平.該思維水平能夠將化學知識或信息有機地整合起來,可以解決復雜的問題.5)拓展抽象水平.能夠融合多學科知識解決化學問題,體現出更高的鉆研精神、探究思維及創新能力.SOLO分類理論分類明確、目標鮮明,能引導學生確立學習目標,發展自身的思維結構水平,操作性很強.
“價—類”二維圖是研究物質化學性質和轉化的重要工具.其以元素為核心內容,結合化合價進行物質分類,內涵是物質之間的轉化.以“價—類”二維圖為工具對氮元素及其化合物進行復習,能夠有效整合該模塊知識,形成系統的知識網絡,幫助學生思維建模,解決實際問題,提升復習效果,落實化學學科核心素養和關鍵能力.
2 “氮元素及其化合物”相關內容的分類進階
本文針對氮元素及其化合物的主要內容同時結合物質結構相關知識,以SOLO 分類理論設定進階目標,如表1所示.

表1
3 SOLO 分類理論下“價—類”二維圖在復習中的應用策略
在SOLO 分類理論下,建立氮元素及其化合物的“價—類”二維圖(如圖1),通過化合價認識不同的含氮化合物及其轉化關系,形成知識網絡,滲透“變化觀”.結合物質結構知識、物質分類知識、氧化還原理論,分析并掌握物質的化學性質.能對不同特征的含氮化合物進行分析論證,滲透“證據推理與模型認知”的學科素養.對于復雜的化學問題,要融合反應原理、物質結構、化學實驗以及多學科知識構建思維模型,解決實際問題.
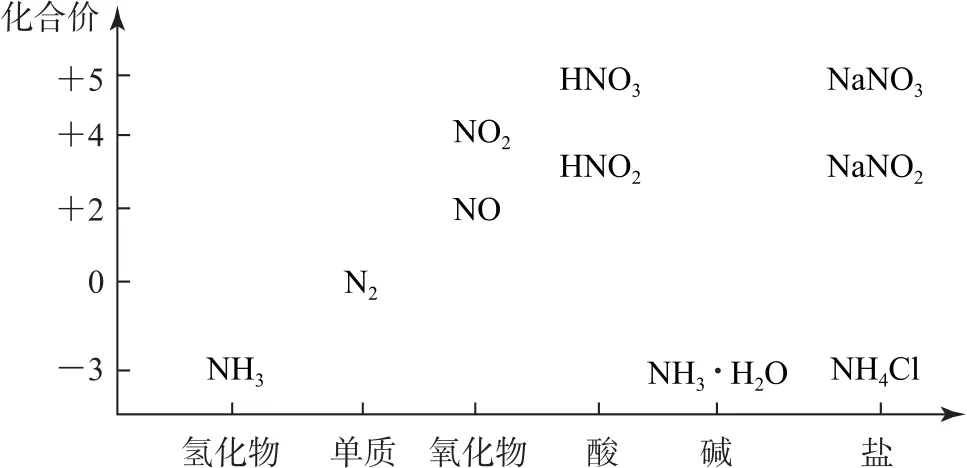
圖1 氮元素及其化合物的“價—類”二維圖
3.1 從物質分類觀建立知識結構實現多點結構水平
物質分類是我們認識物質的前提.通過對氮及其化合物進行分類學習,了解氨水是一種包含三分子(NH3、NH3?H2O、H2O)、三離子的混合物.在純凈物的分類中,以單質(N2)、氧化物(NO、NO2)、氫 化 物(NH3、N2H4)、酸(HNO2、HNO3)、堿(NH3?H2O)、鹽[NH4Cl、NH4NO3、(NH4)2CO3]等對氮及其化合物的性質進行統一的認識.結合化合價知識,以N 元素為+2價的物質(NO)為中心,N 元素化合價降低可以被還原成0價的N2,N2與H2反應,N 元素化合價進一步降低為-3 價(NH3).N 元素化合價也可以升高被氧化成+4 價(NO2),NO2遇H2O 發生歧化反應生成NO 和HNO3(氮元素為+5 價).稀HNO3的還原產物為NO,濃HNO3的還原產物為NO2.這樣把氮元素及其化合物的性質知識串聯起來,構建知識框架,實現從單點結構水平到多點結構水平的發展.
例1(2023年北京卷4)下列事實能用平衡移動原理解釋的是( ).
A.H2O2溶液中加入少量Mn O2固體,促進H2O2分解
B.密閉燒瓶內的NO2和N2O4的混合氣體,受熱后顏色加深
C.鐵釘放入濃HNO3中,待不再變化后,加熱能產生大量紅棕色氣體
D.鋅片與稀H2SO4反應過程中,加入少量Cu SO4固體,促進H2的產生

催化劑影響化學反應速率而不影響平衡移動,選項A 不符合題意.密閉燒瓶內NO2和N2O4的混合氣體存在平衡:2 NO2?N2O4ΔH<0,升溫后平衡逆向移動,混合氣體顏色加深,選項B 符合題意.常溫下Fe遇濃HNO3發生鈍化,無明顯現象,加熱后表面氧化膜溶解,Fe與濃硝酸反應生成紅棕色氣體NO2,與化學平衡無關,選項C不符合題意.鋅片與稀H2SO4反應過程中,加入少量CuSO4固體,鐵置換銅形成無數個微小的原電池,加快反應速率,與化學平衡無關,選項D 不符合題意.答案為B.
3.2 融合物質結構知識認識物質的性質實現關聯結構水平
物質結構決定性質.N2分子結構中氮氮三鍵的鍵能高,故N2穩定.NH3的中心原子采用sp3雜化,分子構型為三角錐形,是極性分子,H2O 是極性溶劑.另外,NH3的中心原子存在一個孤電子對,使NH3成為常見的配體,如可以和 Cu2+生成深藍色的配離子,用于Cu2+的檢驗.
例2(2023年全國新課標卷12)“肼合成酶”以其中的Fe2+配合物為催化中心,可將NH2OH 與NH3轉化為肼(NH2NH2),其反應歷程如圖2所示.下列說法錯誤的是( ).

圖2
A.NH2OH、NH3和H2O 均為極性分子
B.反應涉及N—H、N—O 鍵斷裂和N—N 鍵生成
C.催化中心的Fe2+被氧化為Fe3+,后又被還原為Fe2+
D.將 NH2OH替換為ND2OD,反應可得ND2ND2

NH2OH 的中心原子采用sp3雜化,3 個雜化軌道分別連接2個H 原子和1個羥基,形成三角錐形,NH3也為三角錐形,H2O 為V 形,3種分子都是極性分子,選項A 說法正確.通過觀察反應歷程圖發現,反應涉及N—H、N—O 鍵斷裂和N—N鍵生成,選項B 說法正確.過程中第二步存在鐵失去電子被氧化成Fe3+,第四步中Fe3+得到電子成為Fe2+,選項C說法正確.根據歷程圖知,將NH2OH 替換為ND2OD 可以得到ND2NH2,選項D 說法錯誤.答案為D.
3.3 融合多學科知識建立物質的轉化觀達到拓展抽象水平
以N2→NH3→NO→N2O3→NO2→N2O5→HNO3為主線形成物質變化觀.在復習N2合成NH3的工業流程時,融合化學物質結構、反應原理、化學實驗、化工生產設計、生產成本、環境保護、社會因素等多模塊、多學科知識.探究合成氨反應原理,合成氨工藝最佳條件,以及合成氨化工生產設計的評價與改進等開放性問題,提升學生拓展抽象水平.
例3(2023年6月浙江卷17,節選)氮的化合物種類繁多,應用廣泛.與碳氫化合物類似,N、H 兩元素之間也可以形成氮烷、氮烯.
①下列說法不正確的是_________.
A.能量最低的激發態N 原子的電子排布式:1s22s12p33s1
B.化學鍵中離子鍵成分的百分數:Ca3N2>Mg3N2
C.最簡單的氮烯分子式:N2H2
D.氮烷中N 原子的雜化方式都是sp3
②氮和氫形成的無環氨多烯,設分子中氮原子數為n,雙鍵數為m,其分子式通式為_________.

①能量最低的激發態N 原子應該是2p 能級上的1個電子躍遷到3s能級,其電子排布式:1s22s22p13s1,選項A 說法錯誤.電負性Ca<Mg,Ca3N2中離子鍵成分更高,選項B說法正確.最簡單的氮烯結構簡式為NH==NH,分子式為N2H2,選項C說法正確.氮烷中N 原子的雜化方式都是sp3,選項D正確.②融合數學知識首先分析氮烷的分子式,以NH3為例,每個N 原子連接3個H 原子,氮烷中每增加1個N 原子,減少2個H 原子.故n個N 原子結合3n-2(n-1)個H,即氮烷分子式為NnHn+2,每形成1個雙鍵少2個H,故分子式通式為NnHn+2-2m(m≤,m為正整數).
4 結束語
SOLO 分類理論下,建立“價—類”二維圖,設置進階目標.從化合價和物質的分類角度認識物質,同時融合其他知識模塊、其他學科知識,使氮及其化合物這部分知識系統化、結構化.在此基礎上引導學生獨立思考,促進學生學習方式的改變,整體提升一輪復習的效果.
(完)

