數字化傳感技術在化學實驗中的考查
陳紅英
(山東省鄒城市實驗中學)
實驗過程中發生的變化比較復雜,為精確研究化學反應過程中發生的變化,人們把傳感技術應用在化學實驗中.因此,對傳感器記錄的結果或傳感圖像的分析等成為新的考點.
1 利用傳感器記錄的結果考查化學反應原理
有些試題直接敘述了傳感器記錄的實驗結果,讓考生分析實驗中發生的化學反應,進行相關計算.
例1圖1為某種氧電化學傳感器的原理示意圖.已知在測定O2含量的過程中,電解質溶液的質量保持不變.一定時間內,若通過傳感器的待測氣體為aL(標準狀況),某電極質量增加了bg.下列說法正確的是( ).
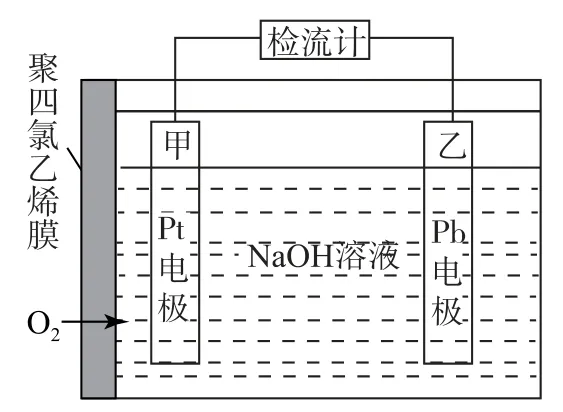
圖1
A.氧電化學傳感器工作時,電流由Pb電極通過外電路流向Pt電極
B.Pb上發生的電極反應式為
C.反應過程中轉移電子的物質的量為0.25bmol
分析根據電池圖像可知,通入氧氣的Pt電極為正極,得到電子發生還原反應,電極方程式為O2+2 H2O+4e-=4 OH-,Pb電極為負極,失去電子發生氧化反應,由于電解質溶液的質量保持不變,說明Pt電極消耗的氧氣與Pb電極上得到的O 原子質量相等,電極方程式 為2Pb+4 OH--4e-=2Pb O +2 H2O.由以上分析可知,Pt電極為正極,Pb電極為負極,電流由Pt電極通過外電路流向Pb電極,選項A、B錯誤.反應過程中Pb電極質量增加,增加的為O 元素的質量,當增加的質量為bg時,n(O)=,故n(Pb O)=n(O)=,根據
可知n(e-)=2n(Pb O)==0.125bmol,選項C錯誤.由電子守恒得,n(O2)=標準狀況下O2的體積為×22.4 L?mol-1=0.7bL,待測氣體中氧氣的體積分數為,選項D正確.答案為D.
2 利用傳感圖像考查化學反應過程的變化
利用傳感技術可以對化學實驗從不同的角度進行有關量的測定,從而得出化學變化中的復雜性.
例2數字化實驗將傳感器數據采集器和計算機相連,利用信息技術對化學實驗進行數據的采集和分析.某學習小組利用數字化實驗對光照過程中新制飽和氯水的變化進行檢測,下列圖像錯誤的是( ).
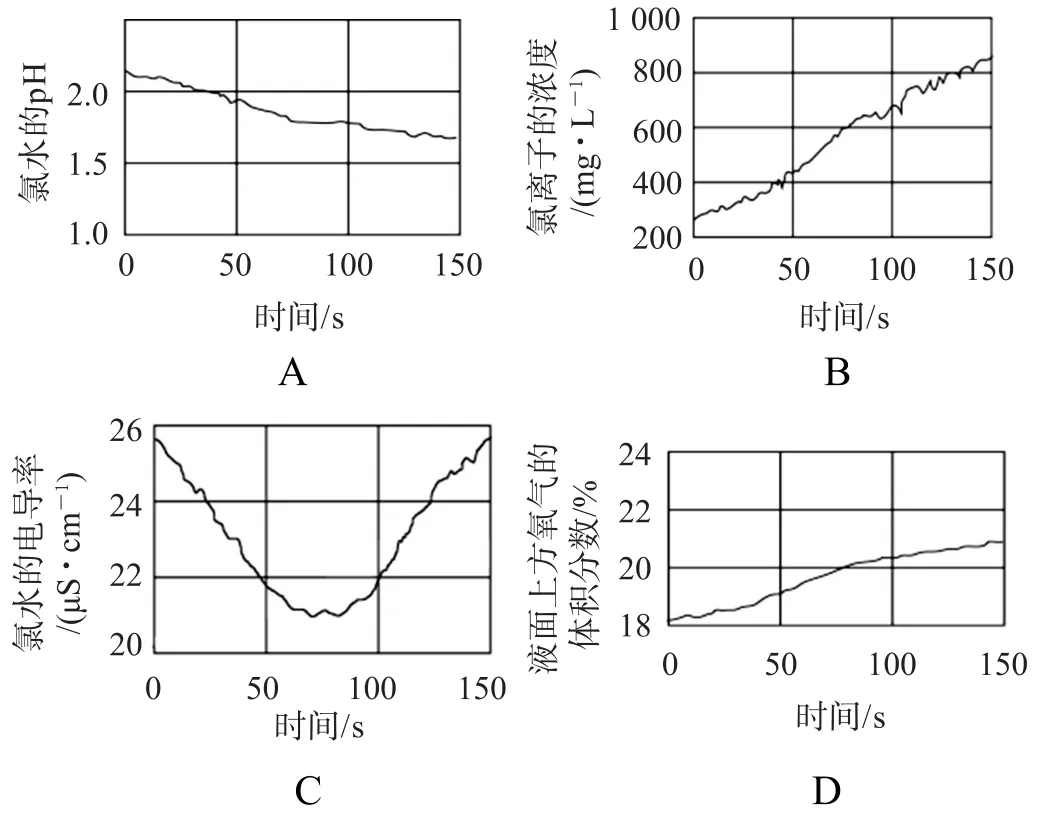
分析Cl2與水發生反應:Cl2+H2O?HCl+HCl O.HCl O 不穩定,光照發生反應:2 HCl O2 HCl+O2↑.可逆反應的化學平衡正向移動,導致溶液中c(H+)增大,因此溶液的p H 逐漸變小,同時c(Cl-)不斷增大,選項A、B 正確.溶液的電導率隨溶液中自由移動離子濃度的增大而增大.氯水久置,使溶液中自由移動的離子濃度增大,經足夠長時間,溶液中離子濃度達到最大值,電導率最大,后不再發生變化,圖示與實驗事實不符,選項C 錯誤.氯水久置,次氯酸分解生成氯化氫和氧氣,氯化氫溶于水得到鹽酸,所以液面上方氧氣體積分數增加,選項D 正確.答案為C.
3 利用離子濃度傳感器研究滴定過程中物質發生的反應
利用離子濃度傳感器記錄滴定過程中各離子濃度的變化,進而可以根據離子濃度的變化判斷滴定過程中發生的化學反應,進行有關量的計算.
例3某實驗小組利用數字化手持技術探究Na2CO3溶液(1.0 mol?L-1)滴定鹽酸(10.00 mL、1.0 mol?L-1)的過程中離子濃度的變化,實驗裝置如圖2所示(夾持裝置略).

圖2
已知:常溫下,Ka1(H2CO3)=1.0×10-6.4mol?L-1,Ka2(H2CO3)=1.0×10-10.3mol?L-1.
滴定完成后,Na2CO3標準溶液過量,數據采集器得到 的、c(H2CO3)隨 加 入Na2CO3標準溶液體積的變化曲線如圖3所示(假設水溶液中CO2以H2CO3形式存在,忽略滴定過程中CO2的逸出).
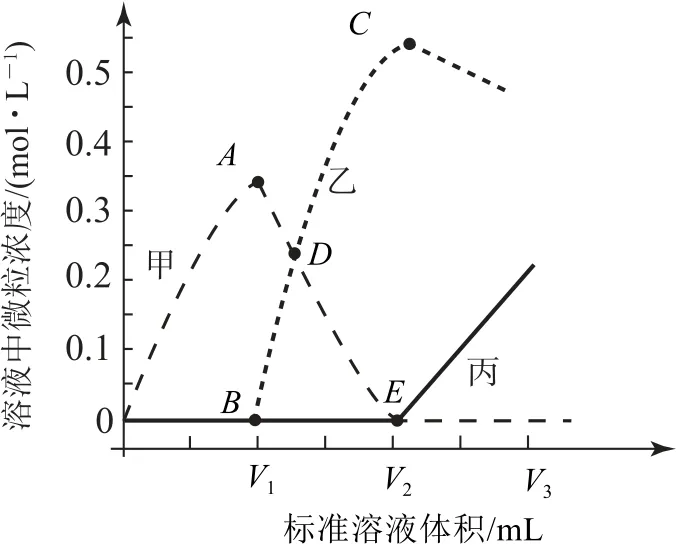
圖3
回答下列問題:
(2)寫出BC段的離子方程式:_______.
(3)E點對應的V2=________.
(4)滴加的Na2CO3標準溶液體積為V3時,混合液中含碳元素的主要微粒為________.
(5)D點對應溶液的p H=________.
分析Na2CO3標準溶液滴定鹽酸分為3個階段.第一個階段(0~V1mL):Na2CO3+2 HCl=2 Na Cl+H2CO3,c(H2CO3)逐漸增大.第二個階段(V1~V2mL):Na2CO3+H2CO3=2Na HCO3,c(H2CO3)逐漸減小,c()逐漸增大.第三個階段(V2~V3mL):Na2CO3過量,c()逐漸增大,由于溶液體積增大,c()逐漸減小.(1)由分析知,曲線甲、乙、丙分別表示c(H2CO3)、c()和c().(2)BC段離子反應方程式為+H2CO3=.(3)E點為碳酸鈉和碳酸恰好完全反應生成碳酸氫鈉,第一個階段發生反應Na2CO3+2 HCl=2 Na Cl+H2CO3,滴定10.00 mL、1.0 mol?L-1鹽酸消耗1.0 mol?L-1Na2CO3溶液5.00 mL,生成5 mmol H2CO3,第二個階段發生反應Na2CO3+H2CO3=2 Na HCO3,生成5 mmol H2CO3,消耗Na2CO3溶液5.00 mL,則V2=5.00 mL+5.00 mL=10.00 mL.(4)滴加的Na2CO3標準溶液體積為V3時,Na2CO3溶液過量,溶液中的溶質為NaCl、Na HCO3、Na2CO3,則混合液中碳元素主要以形式存在.(5)D點時,c()=c(H2CO3),則Ka1(H2CO3)==c(H+)=1.0×10-6.4mol?L-1,對應溶液的p H=6.4.
總之,科學技術越來越多地應用在化學實驗研究中,成為研究化學實驗的重要工具,讓我們深刻理解化學反應的實質.當然在分析這些變化或圖像時,要根據化學反應原理分析,不能偏離基本的化學反應.
(完)

