多粘類芽孢桿菌適冷性新型β-半乳糖苷酶的重組表達和酶學性質
向芷璇,關樂穎,李 敬,閆巧娟,江正強,3,
(1.中國農業大學食品科學與營養工程學院,中國輕工業食品生物工程重點實驗室,北京 100083;2.中國農業大學工學院,北京 100083;3.中原食品實驗室,河南漯河 462300)
β-半乳糖苷酶(EC 3.2.1.23,β-Galactosidase)具有水解和轉糖苷的活性[1],可用于生產低乳糖乳制品,減輕乳糖不耐者食用乳制品后出現的腹脹、腹瀉等不良反應,還可用于制備低聚半乳糖(Galactooligosaccharides,GOS)[2]。GOS 是由一個或多個半乳糖基與葡萄糖或半乳糖連接形成的功能性低聚糖[3],可被腸道中雙歧桿菌(Bifidobacteria)和乳桿菌(Lactobacilli)等利用,具有調節腸道菌群、促進礦物質吸收、增強免疫力等功效[4]。
《食品營養強化劑使用標準GB14880-2012》已批準GOS 可添加至嬰幼兒配方食品和谷類輔助食品中。米曲霉(Aspergillus oryzae)、環狀芽孢桿菌(Bacillus circulans)和乳酸克魯維酵母(Kluyveromyces lactis)來源的商業化β-半乳糖苷酶分別利用300、500 和300 g/L 乳糖于45、60 和40 ℃合成GOS,轉化率分別為19.5%、48.3%和34.9%[5]。嬰兒雙歧桿菌(Bifidobacterium infantis)來源的β-半乳糖苷酶利用300 g/L 乳糖于60 ℃合成GOS 的轉化率為63.3%[6]。巴倫葛茲類芽孢桿菌(Paenibacillus barengoltzii)來源的β-半乳糖苷酶在40 ℃下催化350 g/L 乳糖反應8 h 合成GOS 的轉化率為47.9%[7]。硫磺礦硫化葉菌(Sulfolobus solfataricus)來源的β-半乳糖苷酶為耐熱酶,于75 ℃高效合成GOS,轉化率為60.5%[8]。目前多數β-半乳糖苷酶合成GOS 的最適溫度高于40 ℃,挖掘在較低溫度下合成GOS的β-半乳糖苷酶可有效避免反應過程中非酶褐變并減少能耗[9]。
適冷性β-半乳糖苷酶在0~30 ℃之間保持高催化活性,適于在低溫下制備低乳糖乳制品或合成GOS,同時適冷酶的構象穩定性差,中等溫度即可破壞其二級和三級結構而導致失活[10-11]。如嗜冷乳糖節桿菌(Arthrobacter psychrolactophilus)F2 產生的一種適冷性β-半乳糖苷酶在10 ℃下24 h 水解牛奶中80%乳糖,在45 ℃下5 min 失活[12]。南極節桿菌(Arthrobactersp.)32cB 來源的GH2 家族β-半乳糖苷酶在高于45 ℃下極不穩定,但可在10 ℃下高效制備無乳糖乳制品和合成GOS[13]。適冷酶在食品工業生產中具有較大的應用潛力,可有效降低生產成本,減少能源浪費,保留產品風味和營養價值。因此挖掘適冷性β-半乳糖苷酶具有重要意義[10]。
多粘類芽孢桿菌(Paenibacillus polymyxa)是一種無致病性的植物根際促生菌,可分泌胞外多糖、抗菌化合物和植物激素等,這些代謝產物具有抑制腫瘤細胞和病原菌生長、提高農作物產量等功能[14-15]。迄今已有一些多粘類芽孢桿菌產糖苷水解酶的報道,如β-葡聚糖酶(β-Glucanase)[16]、β-甘露聚糖酶(β-Mannase)[17]和普魯蘭酶(Pullulanase)[18]等,但尚無多粘類芽孢桿菌來源β-半乳糖苷酶的報道。實驗室篩選獲得一株多粘類芽孢桿菌,可胞外分泌β-半乳糖苷酶,通過PDB(Protein Data Bank Proteins)數據庫分析其與拉恩氏菌(Rahnellasp.)R3 來源的適冷性β-半乳糖苷酶同源性較高(57.2%),推測該蛋白可能具有適冷酶的特性,本文將該基因在大腸桿菌中表達,研究酶學性質,分析該酶的溫度穩定性,并用于合成低聚半乳糖。
1 材料與方法
1.1 材料與儀器
多粘類芽孢桿菌L709 由本實驗室自行篩選并于-80 ℃保藏;大腸桿菌DH5α、BL21(DE3)感受態細胞 北京全式金生物技術公司;載體pET-28a(+)Invitrogen 公司;細菌基因組DNA 提取試劑盒 天根生化科技有限公司;TransStart FastPfuDNA Polymerase 北京全式金生物技術公司;限制性內切酶和T4 DNA 連接酶 TaKaRa 公司;瓊脂糖凝膠DNA/PCR 產物中量回收試劑盒 杭州倍沃醫學科技有限公司;Ni-NTA 親和層析柱 GE 公司;葡萄糖測定試劑盒 上海榮盛生物藥業股份有限公司;異丙基-β-D-硫代半乳糖苷(IPTG)美國Sigma-Aldrich公司;鄰硝基苯-β-D-吡喃半乳糖苷(oNP-β-Galactopyranoside,CAS 號:369-07-3)、對硝基苯-β-D-吡喃半乳糖苷(pNP-β-Galactopyranoside,CAS 號:3150-24-1)、對硝基苯-β-吡喃葡萄糖苷(pNP-β-Glucopyranoside,CAS 號:2492-87-7)、對硝基苯-β-吡喃甘露糖苷(pNP-β-Mannopyranosidae,CAS 號:252-633-9)、對硝基苯-β-吡喃木糖苷(pNP-β-Xylopyranosidae,CAS 號:2001-96-9)、對硝基苯-α-吡喃半乳糖苷(pNP-α-Galactopyranoside,CAS 號:7493-95-0)、對硝基苯-α-吡喃葡萄糖苷(pNP-α-Glucopyranoside,CAS 號:3767-28-0)分析純,上海麥克林生化科技有限公司;其他試劑若無特殊說明均為分析純。
T100TMThermal Cycler 梯度PCR 儀 Bio-Rad公司;JY92-IIDN 型超聲波細胞粉碎機 寧波新芝生物科技股份有限公司;TU-1901 紫外-可見分光光度計 北京普析通用儀器設備有限公司;?KTA 蛋白純化系統 美國GE Healthcare 公司;高效液相色譜(High Performance Liquid Chromatography,HPLC)系統 Agilent Technologies 公司。
1.2 實驗方法
1.2.1β-半乳糖苷酶基因的克隆和表達載體的構建 多粘類芽孢桿菌L709 接種于LB 液體培養基中,30 ℃培養16 h,離心收集菌體,使用細菌基因組DNA 提取試劑盒提取多粘類芽孢桿菌基因組DNA。依據基因組序列信息,設計上游引物PpBgal42AF(5’ CGCGATCTC CATATGACGTATAGTAATATC ACCAAATATC 3’)和下游引物PpBgal42A-R(5’CAGATACCGCTCGAGTTAATTATTGCGTTCGG CTTTC 3’),以基因組DNA 為模版擴增β-半乳糖苷酶基因。PCR 反應體系:5×TransStart FastPfuBuffer 10 μL,2.5 mmol/L dNTPs 4 μL,引物PpBgal42AF/R各1 μL,基因組DNA 1 μL,TransStart FastPfuDNA Polymerase 1 μL,補ddH2O 至50 μL。PCR 條件為:95 ℃預變性3 min;95 ℃變性20 s,55 ℃退火20 s,72 ℃延伸60 s,循環33 次;72 ℃延伸5 min。PCR 產物經瓊脂糖凝膠電泳分析后切膠回收目的條帶,用Nde I 和Xho I 酶切目的片段和載體pET-28a(+),由T4 DNA 連接酶連接構建重組表達質粒pET-28a-PpBgal42A,將重組表達質粒轉入大腸桿菌DH5α,在LB 平板培養基中篩選出含有目的基因的陽性轉化子,并提取質粒和測序。
1.2.2β-半乳糖苷酶的序列分析β-半乳糖苷酶的基因測序結果提交至NCBI 數據庫,利用NCBI ORF finder(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)查找開放閱讀框(Open Reading Frame,ORF);利用BLAST 工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)進行序列同源性比對;通過NCBI CD-Search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)分析序列的保守結構域;將蛋白序列提交至SignalP 5.0(http://www.cbs.dtu.dk/services/SignallP/)預測信號肽序列;利用在線軟件ExPASy ProtParam(http://web.expasy.org/protparam/)預測基因所編碼蛋白質的分子量和等電點等;使用DNAMAN 進行多序列比對分析并繪圖。
1.2.3β-半乳糖苷酶(PpBgal42A)的重組表達和純化 重組表達質粒pET-28a-PpBgal42A 轉入大腸桿菌表達宿主BL21(DE3)中,挑取單菌落至20 mL 含50 μg/mL 卡那霉素的LB 液體培養基中37 ℃培養12 h 作為種子液,按1%(v/v)接種量轉接至300 mL上述培養基中。當菌體密度OD600處于0.6~0.8 時加入終濃度為1 mmol/L 的IPTG,在16 ℃、200 r/min的條件下誘導培養16 h。4 ℃下10000×g 離心5 min收集菌體,將菌體重懸在緩沖液A(20 mmol/L Na2HPO4-NaH2PO4,500 mmol/L NaCl,20 mmol/L咪唑,pH8.0)中,超聲破壁后4 ℃、10000×g 離心10 min 得到粗酶液。預先用10 個柱體積的緩沖液A 平衡Ni-NTA 親和柱,粗酶液以0.5 mL/min 流速上樣,用緩沖液A 洗脫未結合蛋白,再用緩沖液B(20 mmol/L Na2HPO4-NaH2PO4,500 mmol/L NaCl,100 mmol/L 咪唑,pH8.0)以1.0 mL/min 流速洗脫目的蛋白。在Na2HPO4-NaH2PO4緩沖液(20 mmol/L,pH8.0)中透析(透析袋MD77,8000~14000 Da),用SDS-PAGE 法分析蛋白純度[19]。
1.2.4 PpBgal42A 酶活力和蛋白濃度的測定 以鄰硝基苯-β-D-吡喃半乳糖苷(oNP-β-Galactopyranoside,oNPG)為底物測定β-半乳糖苷酶的酶活力[20]:75 μL 15 mmol/LoNPG 和150 μL 50 mmol/L Na2HPO4-NaH2PO4緩沖液(pH7.5)混合。35 ℃保溫3 min 后加入25 μL 適當稀釋的酶液,35 ℃反應10 min 后加入750 μL 2 mol/L Na2CO3溶液終止反應,用紫外-可見分光光度計在410 nm 下測定鄰硝基苯酚的量。一個酶活力單位定義為:在上述反應條件下,每分鐘催化oNPG 水解釋放1 μmol 鄰硝基苯酚所需的酶量。參照Lowry 法[21]測定蛋白濃度,以牛血清蛋白(Bovine Serum Albumin,BSA)作為標準蛋白。
1.2.5 PpBgal42A 酶學性質的測定 最適pH 和pH穩定性測定:按照1.2.4 中酶活力測定方法,以酶活力最大值為100%,分別計算不同pH 值下的相對酶活力。所用緩沖液體系和pH 緩沖范圍如下:檸檬酸-檸檬酸三鈉緩沖液(Citrate,pH3.0~6.0),乙酸-乙酸鈉緩沖液(Acetate,pH4.0~5.5),2-嗎啉乙磺酸緩沖液(MES,pH5.0~6.5),Na2HPO4-NaH2PO4緩沖液(PBS,pH6.0~8.0),三羥甲基氨基甲烷-鹽酸緩沖液(Tris-HCl,pH7.0~9.0),甘氨酸-氫氧化鈉緩沖液(Glycine-NaOH,pH8.5~10.5),3-環己胺-1-丙磺酸緩沖液(CAPS,pH10.0~11.0)。在上述不同pH 緩沖液中測定pH 穩定性,35 ℃保溫30 min 后迅速置于冰水浴中冷卻30 min,按照上述酶活力測定方法測定殘余酶活力,以未經處理的酶液為對照,分別計算不同pH 條件下的相對酶活力。
最適溫度和溫度穩定性的測定:用最適pH 緩沖液配制15 mmol/LoNPG,按照1.2.4 中酶活力測定方法在不同溫度(20~70 ℃)下測定酶活力,以酶活力最大值為100%,分別計算不同溫度下的相對酶活力。溫度穩定性在最適pH 和不同溫度(20~70 ℃)下測定,保溫30 min 后迅速置于冰水浴中冷卻30 min,在最適條件下測定殘余酶活力。在4、10、20 ℃下處理30、60、120、180 min 后測定殘余酶活力,進一步探究低溫下PpBgal42A 的穩定性,以未經處理的酶液為對照,計算不同溫度處理后殘余酶活力的相對值。
半衰期的測定:用最適pH 緩沖液稀釋酶液,在30、35、40、45、50 ℃下進行保溫反應,分別在5、15、30、60、90、120、150 和180 min 取樣并迅速置于冰水浴中冷卻30 min,在最適條件下測定殘余酶活力。酶液在不同溫度下酶活力降低至50%時所需的時間即為該溫度條件下的半衰期[22]。
1.2.6 PpBgal42A 的底物特異性 用50 mmol/L Na2HPO4-NaH2PO4緩沖液(pH7.5)配制15 mmol/L 鄰硝基苯-β-D-吡喃半乳糖苷(β-oNPGal)、對硝基苯-β-D-吡喃半乳糖苷(β-pNPGal)、對硝基苯-β-吡喃葡萄糖苷(β-pNPGlu)、對硝基苯-β-吡喃甘露糖苷(βpNPMan)、對硝基苯-β-吡喃木糖苷(β-pNPXyl)、對硝基苯-α-吡喃半乳糖苷(α-pNPGal)、對硝基苯-α-吡喃葡萄糖苷(α-pNPGlu)和10 mg/mL 乳糖,pNP 合成底物酶活力測定按照1.2.4 中酶活力測定方法進行,乳糖底物酶活力測定參照葡萄糖檢測試劑盒(GOD-POD 比色法)說明書:將適當稀釋的酶液與乳糖混合,35 ℃保溫10 min 后用葡萄糖測定試劑盒測定葡萄糖濃度,通過檢測溶液中釋放出的葡萄糖濃度來計算酶活力。oNPG 為底物時酶活力為100%,分別計算β-半乳糖苷酶對不同底物的比活力和相對酶活力。一個酶活力單位定義為:在上述反應條件下,每分鐘生成1 μmol 硝基苯(oNP 或pNP)或葡萄糖所需的酶量。
1.2.7 PpBgal42A 水解乳糖 用50 mmol/L Na2HPO4-NaH2PO4緩沖液(pH8.0)配制50 g/L 乳糖溶液,添加10 U/mL 的PpBgal42A,混合均勻后于30 ℃反應0.25、0.5、1、2、4、6、8、12 和24 h 后取樣煮沸5 min 滅酶,適當稀釋樣品后進行定性定量分析。
薄層層析法(Thin Layer Chromatography,TLC)定性分析水解產物[7]:樣品于TLC 分析板上展層兩次,用顯色劑完全浸濕吹干后在180 ℃顯色。展層劑為正丁醇:乙醇:水=5:3:2,顯色劑為硫酸、甲醇溶液(5%,v/v),標準品為半乳糖、葡萄糖和乳糖的混合溶液(各組分終濃度為1 mg/mL)。
高效液相色譜(HPLC)定量分析水解產物[7]:色譜柱為BP-800Pb++(Benson Polymeric,Reno,NE,USA),流動相為超純水,進樣量10 μL,流速0.6 mL/min,柱溫80 ℃,檢測器為示差折光檢測器,標準品為半乳糖、葡萄糖和乳糖的混合溶液(各組分終濃度為1 mg/mL)。計算公式如下:
1.2.8 PpBgal42A 合成GOS 利用PpBgal42A 的轉糖苷能力合成GOS,合成條件優化主要包括初始乳糖濃度(250、300、350、400、450 g/L)、反應溫度(25、30、35、40、45 ℃)、反應pH(7.0、7.5、8.0、8.5、9.0)、加酶量(2、3、4、5、6 U/mL)和反應時間(0.25、0.5、1、2、4、6、8、12、24 h)五個因素,單因素優化實驗固定其他參數為:350 g/L、35 ℃、pH7.5、5 U/mL、4 h。用TLC 和HPLC 定性、定量分析待測樣品中GOS 的濃度和轉化率,確定最優合成條件。TLC 和HPLC 的檢測條件同1.2.7 所示。計算公式如下[23]:
式中:A1表示初始乳糖濃度,g/L;A2表示取樣時乳糖濃度,g/L;A3表示取樣時葡萄糖濃度,g/L;A4表示取樣時半乳糖濃度,g/L。
1.3 數據處理
采用GraphPad Prism 進行數據整理和圖片處理,每組數據均有設3 次平行。
2 結果與分析
2.1 β-半乳糖苷酶基因的克隆和序列分析
以多粘類芽孢桿菌L709 基因組為模版,利用PCR 擴增出一條長度為2088 bp 的基因片段PpBgal 42A,該基因片段編碼695 個氨基酸。SignalP 5.0 預測PpBgal42A 不含信號肽,ExPASy 分析表明該蛋白的理論分子量和等電點分別為79 kDa 和5.58。NCBI CD-Search 分析表明PpBgal42A 含有GH42家族保守結構域。BLAST 蛋白序列比對表明(圖1),該基因編碼的蛋白與酸熱脂環酸芽孢桿菌(Alicyclobacillus acidocaldarius)來源的β-半乳糖苷酶(GenBank: C8WV58.1)同源性最高,為59.9%;其次,與產氣莢膜梭菌(Clostridium perfringens)(Gen-Bank: Q0TUR6.1)、拉恩氏菌(Rahnellasp.)R3(PDB:5E9A_A)、地衣芽孢桿菌(Bacillus licheniformis)DSM 13(GenBank: Q65CX4.2)和枯草芽孢桿菌(Bacillus subtilis)(GenBank: O07012.2)來源的β-半乳糖苷酶的同源性分別為58.2%、57.2%、49.3%和49.2%。此外,兩個保守的谷氨酸殘基(E162 和E320)可能作為廣義酸/堿和親核試劑,在酶分子與底物的結合和催化中起關鍵作用。

2.2 β-半乳糖苷酶(PpBgal42A)的重組表達和純化
PpBgal42A 成功在大腸桿菌BL21(DE3)中可溶表達,用?KTA 蛋白純化系統將目標蛋白和雜蛋白分離,得到電泳級純酶,純化結果見表1。SDSPAGE 表明在80 kDa 處顯示單一條帶,與預測分子量79 kDa 相近(圖2)。酶活力回收率為60.1%,比活力由31.3 U/mg 提高到163.7 U/mg,純化倍數為5.2。

表1 重組β-半乳糖苷酶(PpBgal42A)純化過程Table 1 Purification of the recombinant β-galactosidase(PpBgal42A)

圖2 重組β-半乳糖苷酶(PpBgal42A)SDS-PAGE 結果Fig.2 SDS-PAGE of the purified PpBgal42A
2.3 PpBgal42A 的酶學性質
PpBgal42A 的基本酶學性質如圖3。PpBgal42A最適pH 為7.5,在pH7.0~9.5 范圍內保持80%以上相對酶活力。PpBgal42A 在35 ℃時酶活力最高,20 ℃時相對酶活力為36%。該酶在35 ℃以下能保留90%以上相對酶活力,高于40 ℃時酶活力急劇下降。PpBgal42A 在30、35、40 和45 ℃下的半衰期分別為7145、1777、157 和15 min(50 ℃下5 min 失活)。進一步分析PpBgal42A 的溫度穩定性(圖3E,表2),其在20 ℃以下保溫180 min 后無酶活力損失,45 ℃處理15 min 后相對酶活力僅為50%,50 ℃下快速失活。
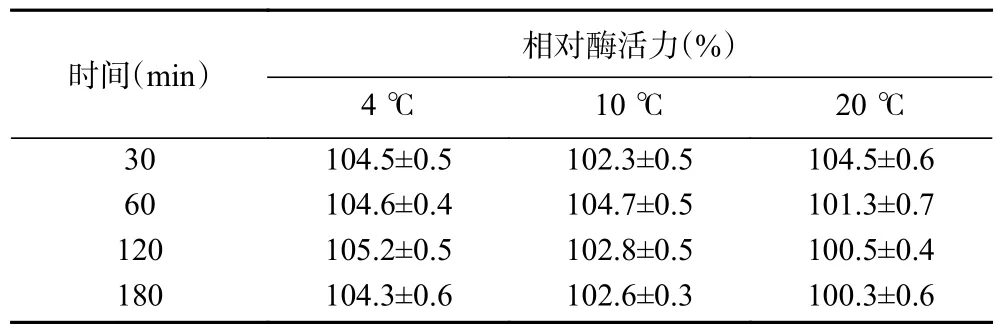
表2 低溫下PpBgal42A 的穩定性Table 2 Stability of PpBgal42A at low temperatures

圖3 PpBgal42A 的最適pH(A)、pH 穩定性(B)、最適溫度(C)、溫度穩定性(D)和半衰期(E)Fig.3 Optimal pH (A),pH stability (B),optimal temperature (C),thermostability (D) and thermal denaturing half-lives (E) of PpBgal42A
2.4 PpBgal42A 的底物特異性
PpBgal42A 的底物特異性見表3。對β鍵連接的合成底物β-oNPGal 的催化活性最高(100%),其次為β-pNPGal,比活力為102.5 U/mg。以乳糖為底物時,PpBgal42A 僅表現出7.0%的相對酶活力。該酶對β-pNPGlu、β-pNPMan、β-pNPXyl、α-pNPGal和α-pNPGlu 均沒有表現出水解活性,表明其對β鍵連接的半乳糖苷化合物的高度專一性。

表3 PpBgal42A 底物特異性Table 3 Substrate specificity of PpBgal42A
2.5 PpBgal42A 的水解特性
以50 g/L 乳糖溶液考察PpBgal42A 的水解特性(圖4)。該酶能水解乳糖生成葡萄糖和半乳糖,HPLC 定量分析表明,在pH8.0 和30 ℃的條件下反應24 h,PpBgal42A 可水解68.3%的乳糖。
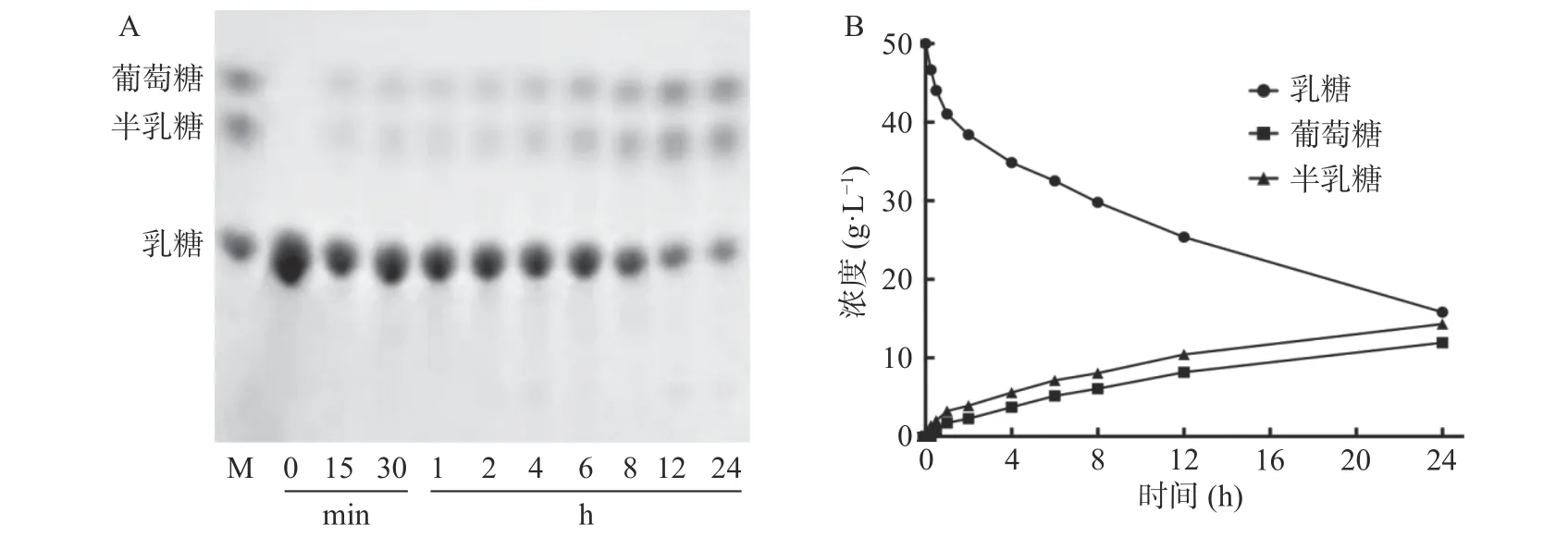
圖4 TLC(A)和HPLC(B)分析PpBgal42A 的水解特性Fig.4 TLC (A) and HPLC (B) analysis of hydrolysis properties of PpBgal42A
2.6 PpBgal42A 的轉糖苷特性
底物濃度、溫度、pH 和加酶量對PpBgal42A 發揮轉糖苷能力合成GOS 的影響如圖5。GOS 的轉化率隨著底物濃度的增加而增加,當底物濃度高于350 g/L 時,轉化率逐漸降低;30 ℃時PpBgal42A 合成GOS 的轉化率最高,當反應溫度高于30 ℃時,GOS 的轉化率降低;當pH 由中性變為堿性時,GOS 轉化率先增加后降低,在pH8.0 時最高;隨著加酶量的增加,GOS 轉化率先增加后趨于平穩,加酶量為5 U/mL 時轉化率較高。經反應條件優化后,HPLC 檢測結果表明加入5 U/mL 的PpBgal42A,以350 g/L 乳糖為底物,在pH8.0 和30 ℃的條件下反應6 h,合成GOS 的轉化率為31.6%。

圖5 PpBgal42A 合成GOS 的條件優化Fig.5 Optimization of GOS synthesis by PpBgal42A
3 討論
β-半乳糖苷酶在乳品工業中應用廣泛[24-25]。本文從多粘類芽孢桿菌中克隆了一個β-半乳糖苷酶(PpBgal42A)基因,并在大腸桿菌中表達,純化后研究其酶學性質。PpBgal42A 含有GH42 家族保守結構域,與酸熱脂環酸芽孢桿菌來源的β-半乳糖苷酶具有最高的同源性(59.9%,圖1),表明PpBgal42A是一個新型的GH42 家族β-半乳糖苷酶。重組β-半乳糖苷酶PpBgal42A 經Ni-NTA 親和層析純化得到純酶,比酶活為163.7 U/mg(表1),高于乳酸桿菌(Lactobacillussp.B164)(122.90 U/mg)[26]、芽孢桿菌(Bacillussp.)KW1(86.99 U/mg)[27]和乙酰微小桿菌(Exiguobacterium acetylicum)(82.6 U/mg)[28]等來源的GH42 家族β-半乳糖苷酶。
PpBgal42A 最適pH 為7.5(圖3A),與海棲熱袍菌(Thermotoga maritima)[29]、乙酰微小桿菌[28]等來源的GH42 家族β-半乳糖苷酶的最適pH 相近。該酶在pH7.0~9.5 具有較好的穩定性(圖3B),與交替單胞菌(Alteromonassp.ML52)(pH7.0~8.5)[30]和南極節桿菌32cB(pH7.0~8.5)[13]來源的β-半乳糖苷酶的pH 穩定范圍相近。PpBgal42A 在35 ℃時表現出最高酶活力(圖3C),與拉恩氏菌R3 來源的β-半乳糖苷酶的最適溫度相同[10]。該酶在30 ℃以下高度穩定,溫度上升至40 ℃時酶活力急劇下降(圖3D),30 ℃以下保溫3 h 后仍十分穩定,35 ℃處理29 h 后可保留50%酶活力,45 ℃處理15 min 后僅剩50%酶活力,50 ℃以上迅速失活(圖3E,表2),與南極節桿菌32cB[13]和拉恩氏菌R3[10]來源的適冷性β-半乳糖苷酶的熱穩定性相似,易熱失活。PpBgal42A 對溫度變化敏感,具有在低溫下保持穩定,在中高溫時易變性失活的適冷性特征[10-11],是一個新型適冷酶。目前用于生產低乳糖乳制品的商業β-半乳糖苷酶,如Lactozym Pure?(Novozymes)和Maxilact?(DSM Food Specialties)在37 ℃具有較高活性,但當溫度降低時活性迅速下降[30]。
PpBgal42A 對人工合成底物β-oNPGal 和β-pNPGal 表現出較高的水解活性,但對天然底物乳糖的相對酶活力僅為β-oNPGal 的7.0%(表3)。大多數GH42 家族β-半乳糖苷酶對乳糖的水解能力較差,如土壤來源的β-半乳糖苷酶zd410(對乳糖的相對酶活力為β-oNPGal 的10.5%)[31]和乙酰微小桿菌來源的β-半乳糖苷酶β-galEa(無乳糖水解活性)[28]。GH42家族β-半乳糖苷酶的活性易受乳糖水解產物的強烈抑制,因此水解乳糖的能力較弱[32],已報道的對乳糖有較強水解能力的GH42 家族β-半乳糖苷酶主要來源于拉恩氏菌R3[10]和冷桿菌(Cryobacteriumsp.LW097)[32]。
β-半乳糖苷酶在合成GOS 的同時也會將GOS水解成單糖。單因素實驗表明在pH8.0 和30 ℃條件下,以350 g/L 乳糖為底物,加入5 U/mL 的PpBgal 42A 反應6 h 合成GOS 的轉化率最高,為31.6%(圖5F)。許多GH42 家族β-半乳糖苷酶合成GOS的轉化率低,甚至無法作用于乳糖發揮轉糖苷能力,如乙酰微小桿菌[28]和枯草芽孢桿菌來源[33]的β-半乳糖苷酶,而地衣芽孢桿菌DSM 13 來源的β-半乳糖苷酶在60 ℃下合成GOS 的轉化率僅為12%[34]。本研究中重組酶PpBgal42A 在較低溫度下合成GOS的轉化率高,在乳制品加工中具有很大的應用潛力。
4 結論
從多粘類芽孢桿菌中克隆一個新型GH42 家族β-半乳糖苷酶基因并在大腸桿菌中表達。重組β-半乳糖苷酶PpBgal42A 是一個新型適冷酶,具有較高的比活力(163.7 U/mg),其最適pH 和最適溫度分別為pH7.5 和35 ℃。該酶在低溫下穩定,高于45 ℃時易失活。PpBgal42A 在最適條件下利用350 g/L乳糖合成GOS 的轉化率為31.6%。本研究為β-半乳糖苷酶在低溫乳品中的應用提供基礎。

