163例急性早幼粒細胞白血病患者隨訪結果分析
董整榮,陶千山,沈元元,董 毅
(安徽醫科大學第二附屬醫院 血液科,安徽 合肥 230601)
急性早幼粒細胞白血病(Acute promyelocytic leukemia, APL)是急性髓系白血病的特殊亞型,其特征是t(15;17)(q22;q12)易位,導致早幼粒細胞白血病(PML)基因和維A酸受體(RARα)基因(PML-RARα)的融合。APL總體發病率較低,占成人AML病例5%~8%[1],臨床上以嚴重的出凝血障礙為突出特點,起病兇險,早期死亡率高。在過去的30年里,APL已經從一種高度致命的疾病轉變為一種高度可治愈的疾病,APL的完全緩解率升至90%以上,5年無進展生存期(Progression free survival, PFS)和總生存期(Overall survival,OS)均在80%以上。但治愈所有APL患者的道路上仍存在挑戰[2], 5%~10% 患者因早期死亡 (Early death, ED) 或復發而治療失敗,有報道ED率甚至高達18%[3]。雖然有許多文獻討論APL預后因素,因為病例數較少,結論不一,仍存在較大爭議[4],因此仍需要更好地了解涉及APL的臨床和生物學因素,進一步減少ED,整體提高患者的生存期,現將我院163例APL患者13年隨訪結果進行分析總結,探討影響APL生存的預后因素。
1 資料與方法
1.1病例選擇 單中心回顧性研究,對2010年1月至2022年12月安徽醫科大學第二附屬醫院收治新診斷163例APL患者進行數據分析,包括人口統計學、臨床血液學特征、治療、毒性、并發癥和預后。APL的診斷以臨床表現、形態學、免疫表型、細胞遺傳學和分子生物學為基礎。不同意治療、既往曾因任何惡性腫瘤接受過化療或放療的患者被排除在本研究之外。納入患者均根據診斷時的總白細胞(WBC)和血小板(PLT)分為[5]:WBC>10×109/L為高危、中危為PLT≤40×109/L,WBC≤10×109/L,低危為PLT>40×109/L且WBC≤10×109/L。記錄所有患者的基線凝血參數、肝腎功能、電解質和QTc間期。所有參與研究的患者或監護人均獲得知情同意并通過倫理委員會審核。
1.2治療方案 治療方案參照中國APL診療指南2018年版[5]。中低危患者選擇無化療方案:維A酸(alltrans retinoic acid, ATRA) 聯合亞砷酸(arsenic trioxide, ATO),高危患者達到CR后,給予3~4個療程的緩解后化療,包括柔紅霉素、去甲氧柔紅霉素、高杉尖杉酯堿單用或聯合阿糖胞苷。在診斷和治療期間對患者進行支持治療。出血發生時給予血小板、新鮮冰凍血漿或冷沉淀,維持纖維蛋白原>1 g/L。在出現分化綜合征的跡象時,患者每12小時給予10 mg地塞米松,直到體征和癥狀消失,建議暫時停藥和調整劑量,以管理與藥物相關的血液學和非血液學毒性[6-7]。
1.3隨訪 通過電話或查看門診或住院病歷來完成隨訪,末次隨訪時間2023年1月。PFS是指從診斷到疾病進展或死亡的時間,OS的定義是從診斷到最后一次隨訪或死于任何原因的時間。
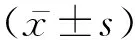
2 結 果
2.1患者臨床特征 本研究納入有完整資料的163例初治APL患者,血紅蛋白77.7(32.0~143.0) g/L,WBC計數14.55(0.23~122.00)×109/L,血小板計數29.42(1.0~134.0)×109/L,纖維蛋白1.47(0.20~5.68) mg/dl,PT為13.87(9.60~0.80) s,APTT為28.27(16.50~57.60) s,大于60歲患者占14例(8.6%),148例(90.8%)患者達到了完全緩解,附加染色體核型 ( Additional chromosomal abnormalities, ACA) 患者23例,其中復雜核型8例,其他常見ACA有+8、der(15)、-7、-6、del(6)、i(17q)、+9、del(16)、add(9)(p23)、add(17)(q21)、+15等。Fms樣酪氨酸激酶3基因(Fms-like tyrosine kinase 3 gene, FLT3-ITD)是最常見的突變,其他特征見表1。
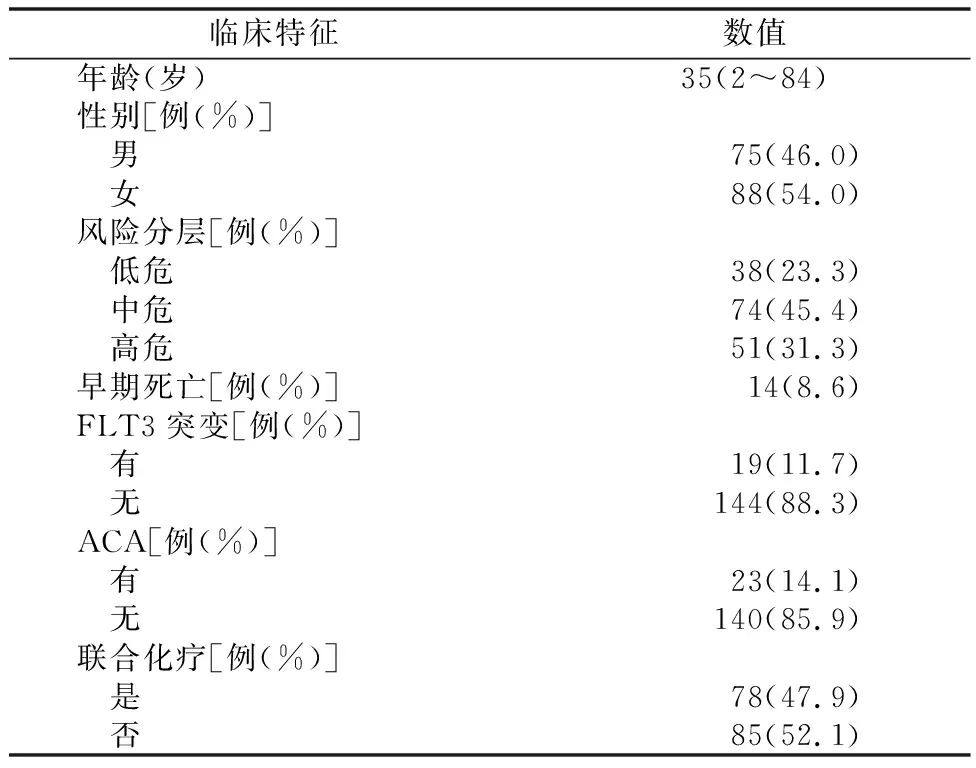
表1 患者臨床特征
2.2ED患者的臨床特征 未達到CR患者15例,其中ED患者13例,因此ED是影響患者療效的主要因素。將所有患者根據是否發生早期死亡分成兩組,ED患者年齡高于非ED組(P<0.01);WBC計數顯著高于非ED組(P=0.004) ;高危組ED比例顯著增加(P=0.001),見表2。

表2 早期死亡患者的臨床特征
2.3患者生存分析 隨訪截至2023年1月,中位隨訪時間為42.5(0.1~156)月,5年的PFS為73.3%,OS率79.5%,中位PFS及OS均未達到,見圖1~2。
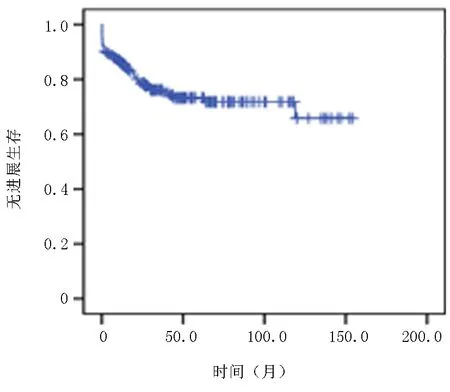
圖1 患者無進展生存
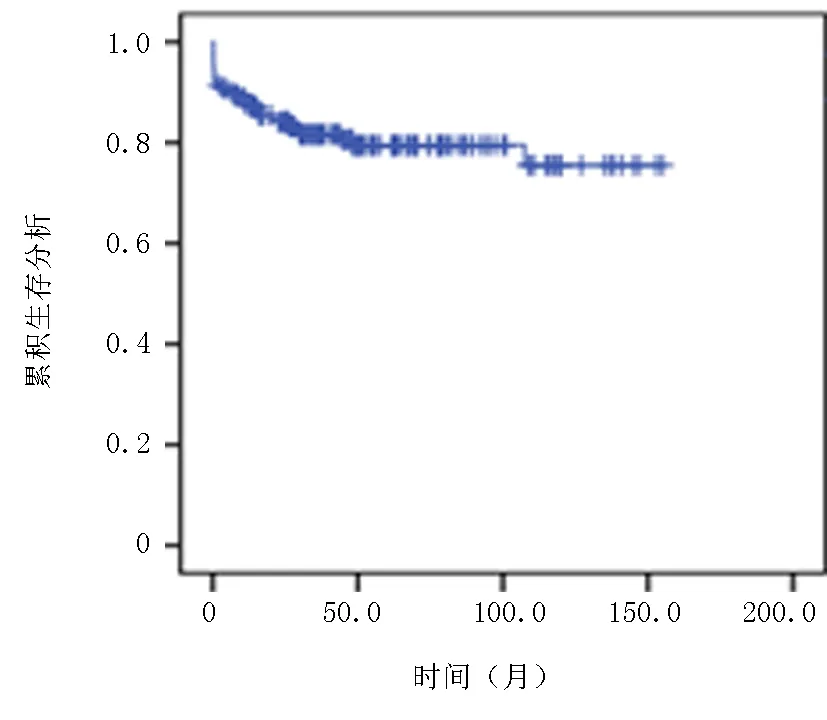
圖2 患者總生存
2.4影響APL患者PFS和OS的單因素分析 對APL患者PFS及OS進行單因素分析,ACA、FLT3突變、危險分層、性別不影響患者生存。年齡對PFS(P<0.01)和OS(P<0.01)產生影響,治療方案影響患者OS(P=0.021),見表3。
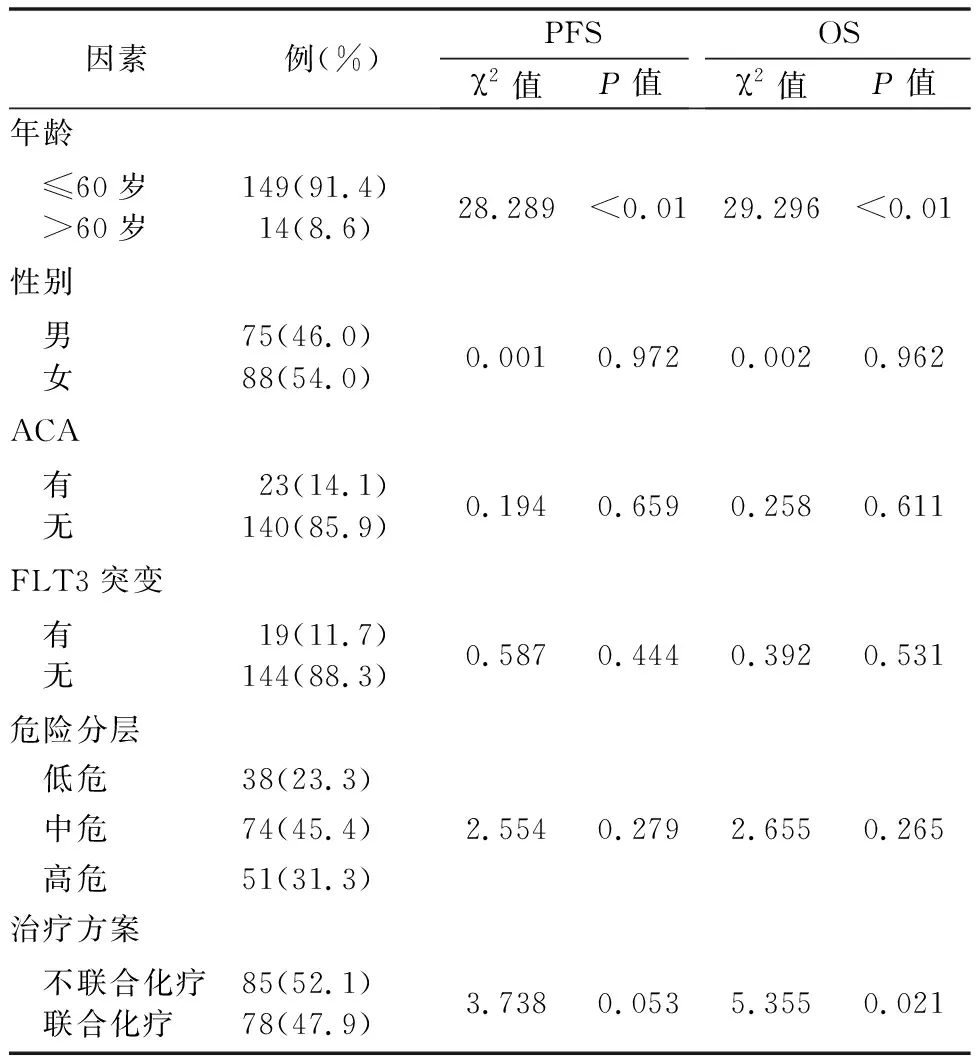
表3 影響APL患者 PFS及OS單因素分析
2.5影響APL患者PFS和OS的多變量分析 將單因素分析有統計學意義的變量納入Cox回歸模型進行多因素分析,僅年齡是影響PFS(P<0.01)和OS(P<0.01)獨立預后因素,而治療方案對PFS(P=0.213)和OS(P=0.097)無影響。
3 討 論
通過13年的隨訪,本研究表明APL患者發病中位年齡35歲,小于14歲患者26例,大于60歲患者14例,同時發病率呈逐年增長,是嚴重威脅中青年健康的惡性疾病之一[8]。在過去20年中,由于ATRA和ATO等藥物的應用、診斷工具、分子監測、支持性治療的改進,APL的生存取得了顯著的進步,成了AML中最可能治愈的亞型[9],本研究5年PFS為73.3%,5年OS為79.5%,中位PFS及OS均未達到,較部分文獻報道略低[4],可能與失訪較多有關。同時也發現影響ALP患者生存的因素越來越多,因為其發病率較低,各中心報道尚不統一[10-14]。
APL是一種高度可治愈的疾病,但ED挑戰仍然存在,而且在ATRA加ATO時代,真實世界的數據很少。本研究從2010-2022年,共有163名APL患者,雖然經歷治療方式改變,APL患者的OS和PFS顯著改善,早期死亡率沒有顯著下降。值得注意的是,年齡較大和WBC計數較高可以確定ED率極高,也代表這兩種情況都是治愈所有患者的障礙[15]。也有發現ED患者中PT、APTT和D-二聚體升高,纖維蛋白原水平較低,但僅觀察到了危險分層和出血史與凝血參數的相關性,但僅僅血小板計數和白細胞計數與ED相關,然而,凝血參數沒有觀察到與ED相關性[16]。本研究中ED組纖維蛋白原水平降低,但與非ED組差異無統計學意義,但無論出血癥狀如何,在診斷疑似APL患者時都必須檢查凝血參數,除早期使用ATRA外,還應輸注新鮮冷凍血漿,減少出血導致死亡。治療模式的演變可以降低ED率,改善臨床結果,并使患者免受化療的毒性。APL對蒽環類藥物的敏感性,使這種致命的疾病可以治愈,但死亡率很高。ATRA-ATO提高了生存率,但回顧性研究發現早期死亡仍然是個問題[17]。Nauffal等[18]也報道了ATRA的應用時機和ED之間缺乏關系,這表明患者其他相關因素影響不良的早期結局。考慮到當前ATO+ATRA時代的復發率非常低,現在應該修改生存風險評分,以專注于ED而不是復發的風險。這些高風險和極高風險組包括所有白細胞計數大于5×109/L的患者以及白細胞計數較低但年齡較大的患者,年齡成為預測ED的重要因素這一事實值得深究[19]。眾所周知,年齡是急性白血病發病機制和預后以及凝血系統病理的主要因素,研究衰老對白血病或凝血系統本身的影響是否有助于增加早期死亡風險,這將是一件有趣的事情,可以識別隱藏在先前歸類為低風險中的高風險患者[20]。如果應用積極的針對老年患者支持性手段,可以挽救這些患者,也許目前指導治療的APL的整個風險分層系統應該進行改良,并關注ED的風險,應糾正將年齡作為重要預后因素,臨床工作中如果使用白細胞計數分層,應與年齡相關。如何進一步因此降低ED,是我們需要思考的問題,早診斷早治療,疾病早期盡量減少化療藥物使用,高齡及高危患者應用更加積極的支持性手段和精細的檢測手段。此外,感染是白血病患者最常見的并發癥和死亡危險因素[21],加強防控等措施或許對減少ED有所幫助。
其次,爭議較大的是合并FLT3-ITD突變與ACA對預后的影響。一項回顧性隊列研究,包括60例APL患者,發現FLT3-ITD是5年PFS的獨立不良因素,ACA是5年OS的獨立不良因子,在化療加ATRA治療的APL患者中,FLT3-ITD和ACA與較差的OS和PFS結果相關[22]。有文獻指出FLT3-ITD突變不影響以ATO和ATRA為基礎的方案治療成人APL患者的生存結果[23]。有報道APL患者ACA陽性率31.6%,接受化療加ATRA治療,無和有ACA在CR(分別為92.3%和66.7%,P=0.025)、3年OS(分別為92%和65.0%,P=0.017)和3年PFS(81.4%和44.4%,P=0.024)方面的差異有統計學意義[24]。有研究對僅接受ATO治療的患者進行了匯總分析,以確定ACA和(或)復雜核型的預后重要性,證明了僅僅攜帶復雜核型ACA的患者的生存率較低(P=0.002),但總體ACA患者無影響(P=0.142)[23]。本研究發現ACA陽性率(14.1%)及FLT3-ITD突變率(11.7%)遠低于其他文獻[25],對APL患者的PFS與OS進行單因素與多因素分析時,并未觀察FLT3-ITD突變及ACA對預后產生不利影響,前期也做過報道[26]。目前文獻結果的差異性可能與病例數較少或選擇治療方案的差異性有關,仍需要進一步驗證。
再者,治療方式的改變對預后的影響。中國APL診療指南推薦中低危患者一般采用ATRA-ATO的無化療方式,高危患者加用鞏固化療[5],與ATRA-ATO加化療相比,ATRA-ATO在高危APL中的療效仍然未知。一項隨機的多中心非劣效性III期研究,以比較ATRA-ATO和ATRA-ATO加化療在新診斷的所有風險APL中的療效,患者被分配接受ATRA-ATO誘導、鞏固和維持,或ATRA-ATO加化療誘導,然后接受3個周期的鞏固治療,并用ATRA-ATO維持治療。在非化療組中,使用羥基脲來控制白細胞增多,兩組完全緩解率均為97%。在所有風險分層患者中,非化療組和化療組的2年無病生存率分別為98%和97%(P=0.62),高危患者分別為94%和87%(P=0.52),研究表明,ATRA-ATO在治療所有風險APL患者方面具有與ATRA-ATO加化療相同的療效[27]。另外有研究評估ATRA-ATO的無化療應用于高危APL,結果發現2年的DFS和OS分別為94%和100%,所有患者在鞏固期結束時均達到了完全的分子緩解[28]。有報道阿糖胞苷聯合伊達比星加ATRA的標準化療方案并未改善高危APL患者的治療結局,就治療相關并發癥和死亡率或治療結局而言,蒽環類藥物加ATRA加阿糖胞苷不如ATO加ATRA[29]。本研究中聯合化療患者78例(47.9%),其中高危患者29例,低中危患者49例,因為其他因素21例高危患者沒有遵循指南聯合化療,但多因素Cox回歸分析APL患者是否加用化療不影響PFS及OS,與文獻報道一致[27-28]。因此在低風險患者中,APL經ATRA和ATO治療后,大部分患者可以治愈,在高危患者中,盡量減少化療已被證明是可行的。
綜上所述,年齡和風險分層是導致APL患者早期死亡的影響因素,高齡是APL患者不良PFS和OS的獨立影響因素,患者危險度分層應考慮加入年齡因素,而FLT3-ITD突變、ACA及是否加用化療對APL患者的ED、ORR以及長期生存沒有產生影響,高危APL患者減少化療是可行的。

