鐵缺乏與肺動脈高壓相關性的研究進展
王 鑫, 張 展, 劉 鐸, 謝 萍
(1.甘肅中醫藥大學第一臨床醫學院,甘肅 蘭州 730000;2.甘肅省人民醫院 心內一科,甘肅 蘭州 730000)
肺動脈高壓(pulmonary arterial hypertension,PAH)被視為由各種原因引起的以肺血管壓力升高為主的血管疾病,住院率及病死率高[1]。PAH涉及多種機制,即免疫炎性反應、缺氧誘發因素等[2]。PAH的自然病史是肺血管阻力增加和右心室衰竭,如不治療會導致死亡[1]。關于PAH治療主要從前列環素途徑、內皮素途徑和一氧化氮途徑出發。研究發現[3],多數PAH患者血清鐵處于低水平。小樣本鐵替代治療PAH方面的臨床研究或動物實驗表明,鐵替代治療能提高活動耐力和生存率。本文收集近年來關于鐵缺乏(iron deficiency,ID)與PAH相關性的研究文獻,闡述PAH與ID的發病機制和療效評估的最新研究進展,且強調鐵劑的選擇和利弊,為PAH的臨床治療提供理論支持。
1 PAH與ID的概述
成年人中,PAH患病率約為10.6/100萬,且發病率隨年齡增長而增加[1]。PAH的診斷是仰臥平靜呼吸時,右心導管平均肺動脈壓力>20 mmHg和肺血管阻力>2 WU[4]。這一定義與之前右心導管肺動脈壓力≥25 mmHg的閾值不同,因為與≤20 mmHg相比,平均肺動脈壓21~24 mmHg死亡率和住院風險更高[1]。PAH是肺高壓的亞型,根據潛在原因,進一步可分為特發性PAH(idiopathic PAH,IPAH)、可遺傳PAH、藥物或毒素誘導的PAH、與某些疾病相關的PAH(結締組織病、獲得性免疫缺陷綜合征感染、門脈高壓癥、先天性心臟病、血吸蟲病)、對鈣通道阻滯劑的長期應答的PAH、肺靜脈閉塞性PAH和新生兒持續性PAH[1]。ID是人體鐵含量降低的病理狀態。PAH患者的ID定義為血清鐵蛋白<100 μg/L 或血清鐵蛋白100~299 μg/L和轉鐵蛋白飽和度(transferrin saturation,TSAT)<20%[5]。ID在PAH人群中約占40%[2]。據報道[5],無論是否存在貧血,PAH患者ID總會引起6min步行距離下降,以及氧氣運輸和處理能力的受損。
2 PAH與ID的發病機制
PAH常見的病理學特征是肺動脈內皮細胞功能障礙、肺動脈平滑肌細胞(pulmonary artery smooth muscle cells,PASMCs)增殖和遷移,以及成纖維細胞活性失調。肺動脈內皮細胞功能障礙導致黏附能力、增殖和抗凋亡表型增加,促進了微血栓形成和血管壁增生。平滑肌細胞遷移導致其他非肌化遠端毛細血管肌化,進一步加劇管腔變窄[6]。見圖1。
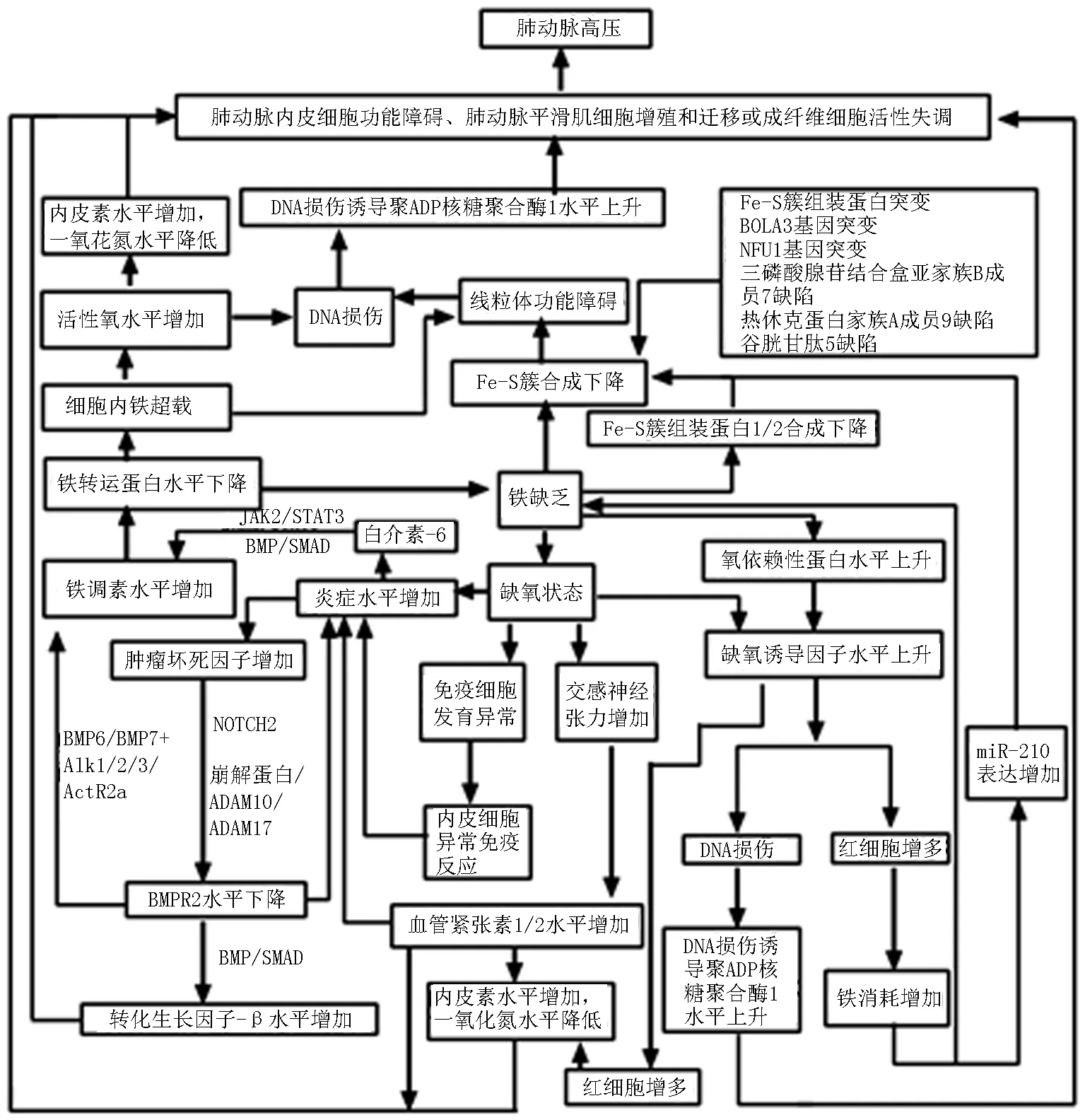
圖1 PAH發生機制
2.1炎癥及氧化應激 最近的研究[6]報告了肺血管重塑與血管周圍炎癥呈正相關。PAH肺血管炎癥可誘導炎癥因子白介素-6(interleukin,IL-6)升高,激活肝細胞內和膜結合的IL-6受體,通過JAK2/STAT3途徑刺激鐵調素表達[2]。在沒有IL-6信號傳導的情況下,IL-1β也會增加肝細胞鐵調素的表達[2]。在分子水平上,鐵調素與鐵轉運蛋白(ferroportin,FPN)的結合引起FPN受體泛素化、內化和降解,而FPN介導細胞鐵的釋放和腸道鐵的吸收,FPN破壞引起鐵的轉運及代謝異常而在細胞內和腸道內積累,繼而造成機體缺鐵[7-8]。IL-6和細胞內高濃度鐵,促進線粒體功能障礙和活性氧(reactive oxygen species, ROS)產生,最終引起脂質過氧化、DNA損傷和蛋白質變性等,這與PAH發生密切相關[7]。PAH嚙齒動物模型中可見[9],ROS導致內皮細胞功能障礙,并伴有內皮素的過表達和一氧化氮合成酶途徑的抑制。研究[10]表明,鐵治療可逆轉ROS的不利作用。此外,炎癥誘導的腫瘤壞死因子通過肺動脈平滑肌細胞(pulmonary artery smooth muscle cells,PASMCs)中的崩解蛋白和金屬蛋白酶ADAM10和ADAM17促進骨形態發生蛋白Ⅱ型受體(bone morphogenetic protein type-Ⅱ receptor,BMPR2)的裂解,且增加NOTCH2信號傳導阻斷BMPR2表達[10]。BMPR2受體是轉化生長因子-β(transforming growth factor-β,TGF-β)超家族中的5-羥色胺/蘇氨酸激酶受體,BMPR2功能障礙可通過激活TGF-β通路和增加炎性細胞因子產生促進血管重塑。此過程通過Smad信號傳導發生[6, 11]。BMP/Smad信號傳導是鐵穩態系統調節的核心[2, 10]。當BMP與BMP受體復合物結合時,受體發生磷酸化并激活Smad,磷酸化的R-Smad與Smad4結合并轉運到細胞核,激活鐵調素編碼基因的轉錄[11]。此外,在BMPR2功能喪失的情況下,II型BMP受體(即ActR2a)可能會代替BMPR2,BMP6和BMP7與Alk1/2/3/ActR2a結合后很可能上調鐵調素表達[2]。PULSAR II期試驗證實[6],通過平衡BMPR2成功降低了肺血管阻力并改善了6min步行試驗(6 minute walk test,6MWT)、N末端腦鈉肽前體(N-terminal pro-B-type natriuretic peptide,NT-proBNP)和WHO功能分級。
2.2缺氧 缺鐵的模擬缺氧狀態使缺氧誘導因子2α(hypoxia inducible factor2α,HIF2α)穩定存在。在缺氧條件下缺氧誘導因子(hypoxia inducible factor-1,HIF)調節缺氧基因表達,刺激腎臟分泌的促紅細胞生成素(erythropoietin,EPO)誘導紅細胞生成,從而增加肺內皮細胞中內皮素表達,促進收縮肺血管系統和肺血管細胞增殖[11-12]。同時,血紅蛋白生成消耗鐵進一步造成機體缺鐵狀態[11]。HIF-α的活化還可誘導DNA損傷。DNA損傷誘導聚二磷酸腺苷(adenosine diphosphate,ADP)核糖聚合酶(poly ADP-ribose polymerase-1,PARP-1)活化,該聚合酶負責DNA修復。然而,PARP-1過度激活導致細胞功能障礙和炎癥反應的激活,引起PASMCs增殖[13]。HIF主要通過氧依賴性蛋白體降解進行調節,而這種蛋白體的降解是鐵依賴性的[12]。研究表明[2],缺氧可通過釋放細胞因子引起炎癥。在最近的動物研究[9, 12]中,通過缺鐵誘導實驗動物PASMCs內缺氧及血管周圍炎性細胞浸潤,巨噬細胞遷移抑制因子,IL-6、IL-10、腫瘤壞死因子α和TGF-β等可使血管收縮、血管生成和組織修復受損,產生不同的肺血管表型。此外,缺氧狀態下,交感神經張力增加使血管緊張素Ⅰ和Ⅱ水平升高,可導致血管收縮和機體炎癥水平升高,也可繼發引起內皮素水平升高和一氧化氮水平下降等。長期如此,可進一步使PASMCs肥大和增殖[6]。眾所周知,缺氧可能影響免疫細胞的發育、功能和死亡,并觸發內皮細胞異常免疫反應[14]。研究表明[15],單獨使用SU5416抑制VEGFR2可誘導T細胞缺陷的大鼠產生重度的PAH,并伴肺內皮細胞凋亡,而免疫重組后裸鼠的肺血管周圍炎癥、內皮細胞凋亡以及PAH均減弱。調節性T細胞的功能是限制內皮損傷和炎癥,而鐵能調節T細胞極化和樹突狀細胞功能[10]。
2.3鐵硫簇 PAH發生與鐵硫(Fe-S)簇有關,ID通過簡單的底物剝奪影響Fe-S簇。Fe-S簇是呼吸鏈中復合物Ⅰ、Ⅱ和Ⅲ中的重要輔助因子,如未正確組裝的Fe-S簇,呼吸鏈就會功能失調[16]。此外,Fe-S簇組裝蛋白1/2是Fe-S簇生物反應所必需的支架蛋白,也是microRNA-210(miR-210)的直接抑制靶標,分別位于細胞質基質和線粒體[2, 17]。當缺氧誘導腎臟產生EPO,促進血紅蛋白合成并消耗鐵超過一定閾值時,miR-210會降低Fe-S簇組裝蛋白1/2的表達,Fe-S簇合成減少[2, 17]。這個過程削弱了Fe-S簇依賴性線粒體呼吸,導致特定的線粒體的代謝改變,促進肺動脈內皮細胞中的糖酵解,這種機制稱為Warburg效應[17-18]。研究發現[7],許多蛋白質參與了Fe-S簇的組裝和運輸,如三磷酸腺苷結合盒亞家族B成員7是線粒體Fe-S簇轉向細胞質的主要轉運蛋白。熱休克蛋白家族A成員9是將新形成的2Fe-2S簇轉移到谷胱甘肽5所必需的線粒體伴侶。反過來,谷胱甘肽5是2Fe-2S簇的直接供體,以靶向載脂蛋白。這些蛋白質的缺陷導致Fe-S簇功能受損,在慢性狀態下,鐵攝取增加和鐵利用率降低導致線粒體代謝異常和重編程,促進PAH的發生發展[17]。此外,一些基因突變也將PAH與鐵穩態異常聯系起來。如純合子線粒體的Fe-S簇組裝蛋白突變導致運動相關的肺血管功能障礙[2]。BOLA3(編碼Fe-S簇成熟必需蛋白質)突變導致PAH相關的多發性線粒體功能障礙綜合征[2]。此外,NFU1編碼的蛋白可將Fe-S簇遞送到線粒體呼吸復合物Ⅰ和Ⅱ,其突變也與PAH相關[2]。
2.4基因 miRNA對PAH發生發展的重要調節作用已被證明,最近有研究[19]提出miRNAs參與鐵的調控。在IPAH患者中,一些miRNAs(miR-483-5p、miR-27a-3p、miR-27b-3p、miR-26b-5p、miR-199a-5p和miR-23b-3p)可能會失調[20-22]。有證據表明[23],miR-485-3p可在轉錄后下調FPN,但這種機制的生理作用尚不確定。這些失調miRNAs在其他生物學環境,也可轉錄控制鐵獲取、鐵輸出和鐵儲存等相關基因的表達[20-22],如BCL2、MSMO1、SLC7A11、TSPAN5和TXNRD1[20]。SLC7A11表達減少會影響谷胱甘肽合成或細胞內鐵代謝的不穩定,導致細胞鐵死亡[24-25]。XNRD1的下調可能通過NRF2信號使細胞更易受到鐵死亡的影響[26]。另外,TSPAN5表達增加可能與細胞鐵攝取增加引起的NOTCH信號通路激活有關,而MSMO1表達下調可能與血紅素代謝有關[27-28]。此外,BCL2下調可誘導細胞凋亡[29]。研究表明[6],鐵代謝相關基因和基因差異表達增加與氧化應激增加相關,但仍需進一步研究了解具體的作用途徑和作用方式。
3 PAH合并ID的治療
促進前列環素途徑和一氧化氮途徑,抑制內皮素途徑是治療PAH患者的基本途徑。目前的指南[4]推薦對PAH患者進行靶向藥物聯合治療。Boucly等[30]研究證明,相較于單用或二聯,初始三聯治療(包括腸外前列環素)對高風險PAH患者益處更大。然而,復雜的藥物管理、高昂的藥物費用、靶向藥物的可及性和各種不良反應使三聯組合策略難以實施[31]。此外,當PAH患者合并ID時,單純予靶向藥物可能并不能有效改善患者預后。因為靶向藥物僅通過擴張血管,以達到緩解癥狀的目的。缺鐵可通過多種機制引起PAH,因此,鐵劑可作為一種的新的策略用于治療PAH患者。當患者合并其他因素時,如心力衰竭[32]、特發性PAH[33]和女性絕經期[6]等,補鐵可能對于患者的益處更大。
3.1PAH患者鐵劑的選擇
3.1.1口服補鐵 口服鐵劑是一種廉價、安全和有效的方式。目前,市場上常用的口服鐵制劑包括麥芽酚鐵、硫酸亞鐵、富馬酸亞鐵和葡萄糖酸亞鐵。原則上,推薦元素鐵劑量為100~200 mg/d,分2~3次給藥[34]。然而,研究發現[35],在缺鐵和非貧血的女性中,高劑量元素鐵會提高鐵調素的水平,限制鐵劑吸收,且會出現惡心、黑便、腸胃氣脹、便秘、上腹部不適、金屬味和嘔吐等胃腸道不良反應[5]。劑量調整頻繁、處方改變、依存性降低或治療中止,使原本“廉價”鐵劑的真實成本可能顯著高于產品本身的成本[35]。目前,新的口服制劑主要是將三價鐵與載體結合以優化吸收并減少不良胃腸道作用,如焦磷酸脂質體鐵口服膠囊。最近的數據表明[34],較低頻率的給藥,如隔天給藥,可能會改善腸道耐受性,提高吸收率。因此,建議當PAH患者輕中度缺鐵時選擇中間劑量和隔日服用;當鐵缺乏嚴重時,可考慮選擇高劑量和每日服用,以此增加絕對吸收。
3.1.2靜脈補鐵 目前,指南建議PAH的ID患者靜脈補鐵。研究發現[36],靜脈補鐵組血紅蛋白和血清鐵蛋白水平的增加高于口服補鐵組。然而,靜脈鐵劑也存在局限性,包括價格昂貴,過敏或輸注反應,如蕁麻疹、心悸、面部潮紅和肌痛,以及感染等[32]。在臨床中,可通過降低輸注速率,以及對有藥物敏感史、免疫/炎癥/過敏性疾病史、肥大細胞增多癥等患者不采用靜脈輸注鐵,以避免過敏反應的發生[37]。有研究稱[38],[實際體重×(9.3(或目標血紅蛋白)—實際血紅蛋白)×1.61]×2.4+鐵儲備,可用于指導鐵劑量,但需進一步研究驗證。
右旋糖酐鐵是最早使用的制劑,蔗糖鐵是使用最廣泛的制劑,異麥芽糖鐵(ferric derisomaltose,FDI)和羧基麥芽糖鐵(ferric car-boxymaltose,FCM)是近年中國批準使用的新型鐵劑。與傳統鐵制劑相比,FDI和FCM有一定優勢,包括發生過敏反應幾率低、元素鐵生物利用度更高及半衰期更長等[39]。FCM可單劑量給藥(1000 mg),也可多次給藥(100~200 mg),無需測試劑量[38],FDI最大單次輸注劑量為20 mg/kg[40]。因此,其能有效的減少輸注次數,降低治療成本。研究表明[38],FCM和FDI可誘導低磷酸鹽血癥發生,反復使用可能導致嚴重的骨軟化,其特征為骨痛、假骨折和低創傷骨折。相比FCM,FDI發生低磷血癥及過敏等風險較低[41]。因此,臨床醫生應在給藥前檢測血清磷酸鹽濃度和維生素D狀態,以評估患低磷血癥的風險[38]。低磷酸鹽血癥發生風險為中度及以上時,以FDI作為優選;風險較高時,使用低分子右旋糖酐鐵(無低磷血癥風險)。如除FCM外無其他靜脈內鐵制劑,建議使用FCM的最大劑量的1/2[38]。低磷酸鹽血癥通常在8~10周內恢復,但臨床醫生仍應在2周后重復測量磷酸鹽水平(此時最低值),避免患者出現肌肉功能障礙、精神狀態改變和骨軟化等[34, 38]。目前,缺乏妊娠早期(第1~3月)PAH患者使用FCM和FDI的證據[38]。
3.2鐵替代治療PAH患者的益處
3.2.1降低肺動脈壓 研究表明[30],降低肺動脈壓有助于通過降低血流動力學應激來逆轉重塑和提高長期生存率。在劇烈運動中氧氣提取增加約3倍,繼而混合靜脈血的氧飽和度下降,肺部暴露于缺氧期間繼發肺血管阻力升高[42]。補鐵可能提供1種機制,用于減少缺氧性肺血管阻力。1項隨機雙盲安慰劑對照生理學研究[42],選取32名50~80歲的健康人行靜脈單劑量FCM(15 mg/kg至最大1 g)或安慰劑治療,在8周的觀察過程中輸液耐受性良好。結果表明,運動期間收縮期肺動脈壓力降低了約3 mmHg[(39.4±1.0) mmHg vs (36.9±0.9) mmHg,P<0.01],這種效果持續了8周。這項研究證明了缺鐵與缺氧性肺血管收縮有關,且這種異常可通過靜脈注射鐵來糾正。因此,缺氧性PAH因補鐵而減弱,因鐵耗竭而加重。另一種可能機制是左心室功能的改善,正性肌力狀態的實質性變化引起的肺動脈壓力降低。有研究[12]發現,高海拔地區通過補鐵逆轉了約40%的PAH對缺氧的反應,PAH降低6 mmHg[(37(34~40) mmHg vs 31 (29~33) mmHg,P=0.01]。此外,1項Ⅱ期多中心、隨機、雙盲、安慰劑對照、交叉臨床試驗[43],將60例IPAH患者1∶1隨機分配后,分別予12周鐵劑羧甲基三氧化二鐵注射液和安慰劑治療,結果顯示,試驗組肺血管阻力明顯降低。
3.2.2提升活動耐力 6MWT是評估患者身體能力簡單可行的方法,與生活質量測量和運動耐量(運動持續時間和運動高峰期的攝氧量)有良好的相關性,重要的是6min步行距離與慢性心血管和呼吸系統疾病的預后密切相關[44]。Ghio等[45]通過使用焦磷酸脂質體鐵膠囊,進行為期16周的縱向觀察性發現,6 min步行距離顯著改善[(500(390~500) m vs 530(410~550) m,P=0.043],但未證實補鐵對肺動脈壓力的影響,這可能是由于IPAH合并ID患者僅22例(6例貧血,16例不貧血)樣本量不足,且未將治療組與對照組比較分析。Molssn[46]研究結果表明,口服麥芽酚鐵可提升PAH患者運動耐力[(331±147)m vs (381±131) m,P=0.004],證實了補鐵與NT-proBNP、鐵的狀態、血紅蛋白和右心室尺寸改善相關。
Viethen等[47]將20例PAH的ID患者(伴或不伴貧血)單次輸注FCM≤1000 mg,2個月后,無氧閾[(647.0±70.0) ml/min vs (747.1±93.4) ml/min,P=0.03]和6MWT[(346.5±28.3) m vs (374.0±25.5) m,P=0.007]顯著增加。根據貧血狀態和右心功能對患者進行分層后發現,靜脈鐵對貧血和無貧血患者均有益,但貧血患者益處更明顯。有研究[3, 48]得到相同結果,進一步證實FCM補鐵對PAH合并ID患者活動耐力的改善。這可能是由于運動能力的提高是血紅蛋白和肌紅蛋白改善心臟、骨骼和吸氣肌氧代謝的結果[3]。Ruiter[49]研究表明,運動耐力時間提升和達到無氧閾的時間延長, 但6 MWT未發生變化。因此,不能證明6MWT降低來解釋疾病嚴重程度的差異。
鐵對血紅蛋白的形成至關重要,與活動耐力密切相關。研究表明[50],與正常人相比,缺鐵患者6MWT降低,無論是否存在貧血。Howard[51]首次針對無貧血患者的隨機、雙盲、安慰劑對照研究,為期12周,并對兩種靜脈鐵進行比較,39例歐洲患者接受FCM 1000 mg(體重<67 kg,15 mg/kg)或生理鹽水,17例中國患者接受右旋糖酐鐵(20 mg/kg)或生理鹽水,結果表明,補鐵對運動能力(心肺運動試驗或6 MWT)或心肺血流動力學的任何測量均無影響。本試驗患者均未發生貧血,且多數屬于較輕功能級別(Ⅰ級和Ⅱ級:60%)。此外,該研究還包括遺傳性PAH患者,存在潛在的基因突變,因此其可能不太可能從補鐵中獲得臨床益處。
3.2.3改善鐵水平 Ruiter等[52]另一項研究納入21例缺鐵患者,口服鐵(富馬酸亞鐵200 mg,3次/d)連續4周,結果發現,僅2例在4周后血清鐵水平升高。研究者懷疑鐵攝取受損,可能歸因于胃腸道水腫。矛盾的是,新型口服鐵劑焦磷酸鐵改善腸道吸收后也未改善體內的鐵穩態[45]。此外,麥芽酚鐵有顯著作用,試驗組血清鐵、鐵蛋白和轉鐵飽和度均顯著增加。因此,仍需進一步明確口服鐵在鐵穩態方面的作用。相比口服鐵,靜脈鐵恢復鐵水平的效果顯著, 輸注后4h達到最高鐵濃度,并在4周降至對照組水平。鐵蛋白和鐵調素濃度分別在23h和4h時大幅上升,并在整個8周內保持升高[42]。此外,其他幾項研究[3, 47, 49, 51]也展現了靜脈在補充機體鐵水平方面的優勢。
4 小結
綜上所述,篩查和治療PAH患者ID的好處超過風險。如患者有貧血和缺鐵,可考慮補充鐵,這種益處不僅體現在肺動脈壓力方面,且也在活動耐力方面表現出來。但目前研究僅評估了補鐵對缺氧性PAH的效果,且亞最大運動能力向最大運動能力轉變的補鐵劑量及時間需進一步確定。脂質體鐵和隔日服用可作為口服鐵劑的首選。較新的靜脈注射鐵制劑,如FCM和FDI,發生嚴重反應的風險似乎非常低。另外,部分研究結果存在差異,有無貧血及有無遺傳性因素對補鐵治療PAH療效的影響需進一步研究,且這些研究由于樣本量小,隨訪時間短,無法在臨床上推廣,因此需大規模和可靠的隨機對照研究,以探索補鐵對PAH患者長期的潛在效用。

