錳基鋰離子篩研究進展
黃敏 余亮良

〔摘 要〕錳基鋰離子篩因其對鋰離子具有高選擇性和循環吸附的穩定性成為當前工業上主流的鹵水提鋰工藝之一。基于文獻的閱讀和整理,介紹了錳基鋰離子篩的概念,分析了對錳基吸附劑吸附原理常見的3種解釋,并從摻雜改性和包覆改性兩個方面分析了通過對鋰錳氧化物進行改性調節其固液界面結構的研究現狀,同時為今后的研究方向提出展望。
〔關鍵詞〕液礦提鋰;鋰錳氧化物;吸附劑;改性
中圖分類號:TQ131.1+1;TQ424.2? ? 文獻標志碼:A 文章編號:1004-4345(2023)05-0014-04
Research Progress in Manganese-based Lithium-Ion Sieve
HUANG Min, YU Liangliang
(China Nerin Engineering Co., Ltd., Nanchang, Jiangxi 330038, China)
Abstract? Manganese-based lithium-ion sieve has become one of the mainstream processes of lithium extraction from brine in the industry due to its high selectivity and stable cyclic adsorption of lithium ions. According to literature review and organization, the paper introduces the concept of manganese-based lithium-ion sieve, analyzes the three common explanations on the adsorption principle of manganese-based adsorbents, and describes the research status of modifying lithium manganese oxides to adjust the solid-liquid interface structure. Meanwhile, the paper proposes the prospects for future research direction.
Keywords? lithium extraction from liquid ore; lithium manganese oxide; adsorbent; modification
0 研究背景
鋰作為降低碳排放不可替代的重要戰略資源,被譽為“推動世界前進的金屬”[1]。較高品質的鋰及其相關化合物被廣泛應用于軍工、有機合成、醫藥、化工等領域[2-4]。碳酸鋰作為鋰的一種主要化合物,是新能源領域的基礎材料,近年來需求量更是不斷增加,導致價格快速增長[5]:2017—2018年,電池級碳酸鋰的價格僅為18萬元/t,而據報道,截至2022年11月,碳酸鋰的報價已升至59萬元/t。鑒于鋰資源的重要性和緊缺性,如何實現對鋰資源的高效提取成為了新能源領域的研究熱點。
目前,鋰資源的開發主要分為傳統的礦石提鋰和鹽湖提鋰兩種。其中,傳統的礦石提鋰由于要經過焙燒、壓煮等工藝,會產生較大的能耗,造成大量的溫室氣體排放,不利于“雙碳”目標的實現[6]。我國作為一個鋰資源大國,79%的鋰資源以鹽湖形式存在于青海、新疆與西藏等各省區[7],因此大力發展以鹽湖液態鋰為主要研究對象的鋰提取研究具有重大意義。
我國大部分鹽湖鹵水為高鎂鋰比型鹵水[8-9],由于鎂與鋰的化學性質非常相似,因此利用常規的沉淀法與電化學法等傳統分離工藝難以將其分離。而鋰離子篩吸附法對鋰離子具有高選擇性和穩定的循環吸附性能,基本實現了將鹽湖鹵水中的鋰“吃干榨干”,為鹽湖提鋰技術帶來新突破,目前已成為工業上主流的鹵水提鋰工藝之一[10-11]。本文擬通過介紹錳基吸附劑的吸附原理,對鋰錳氧化物進行改性調節其固液界面結構的研究現狀進行分析,以期探討錳基鋰離子篩技術未來的研究方向。
1? ?錳基鋰離子篩的概念
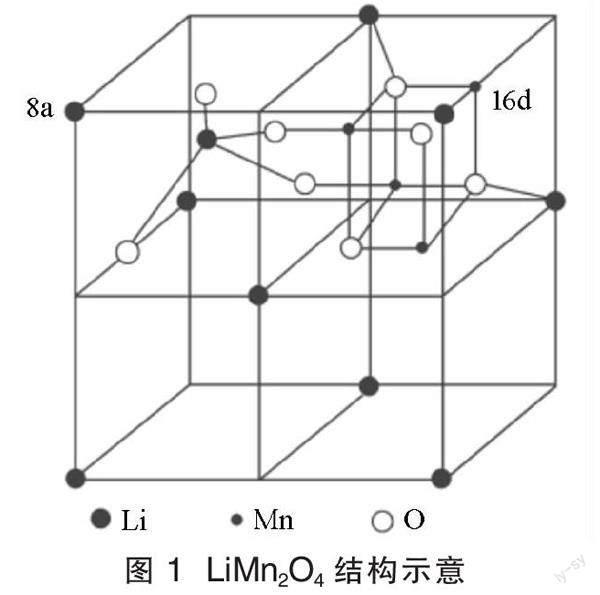
二氧化錳具有多種晶型結構,包括(α、β、γ、δ、λ)-型等[12]。經過研究發現,λ-型二氧化錳對鋰離子具有比較強的特殊吸附作用,可以選擇性地將鋰離子嵌入其結構中,形成比較穩定的具有尖晶石結構的鋰錳氧化物。常見的錳基鋰離子篩前驅體有LiMn2O4、Li1.33Mn1.67O4(Li4Mn5O12)和Li1.6Mn1.6O4(Li2Mn2O5)。其中,LiMn2O4為典型代表,圍繞其開展的研究最多。LiMn2O4微觀結構如圖1所示。
由圖1可以看出,LiMn2O4中氧原子呈現四面體型分布,錳呈現八面體型分布,鋰離子存在于四面體間隙位置中[13]。用酸對尖晶石結構的鋰錳氧化物進行處理,使其脫除結構中的鋰形成空位,得到錳基的鋰離子篩。研究發現,錳基鋰離子篩的吸附容量與前驅體中的鋰錳比有關,當鋰錳氧化物具有較高的鋰錳比的時候所形成的鋰離子篩具有較高的吸附容量。這也是LiMn2O4作為鋰離子篩前驅體、洗脫(鋰脫出)后能從含鋰溶液中提取鋰的基礎。
2? ?錳基吸附劑界面吸附機理
鋰離子篩是將 Li+嵌入化合物中以形成復合氧化物,并使用洗脫液將 Li+洗脫出來。在該過程中復合氧化物的晶體結構并不會發生改變,最終我們可以得到與 Li+相匹配的具有規則孔隙結構的材料。這種孔隙結構對原始引入的 Li+具有高選擇性,也可以說是具有一種“記憶效應”,這是由于該結構嵌入 Li+離子后可以形成最佳的晶體結構[14]。
錳基吸附劑界面處的吸附機理,即鋰離子在錳基尖晶石結構中的嵌入/脫除過程,經過研究發現此過程比較復雜,近年來對其原理解釋主要是分為3種,即界面處的氧化還原機理、固液界面處的離子交換機理以及復合作用機理。
2.1? 氧化還原機理
在進行鋰錳氧化物的鋰脫除研究時,J. C. Hunter等[15]發現鋰離子從結構脫除的過程中錳的價態會發生變化,在只含有Mn3+和Mn4+的前驅體中的轉型溶液中出現了Mn2+。針對此現象其提出了界面處的氧化還原機理:
其中,結構中的Mn3+和Mn4+經過轉型后,形成含有Mn4+的結構和游離的Mn2+,同時在保持尖晶石結構的基礎上將鋰離子從結構中脫除形成空位,形成鋰離子篩。Ooi K等[16]研究鋰離子進入λ-型二氧化錳中的嵌入反應時發現有氧氣產生,因此提出如下的氧化還原反應機理:
其反應過程分為兩步進行:
2.2? 離子交換機理
Shen等[17]認為鋰離子篩在捕獲鋰離子的時候,離子篩中的錳元素并未發生化合價的變化,即鋰離子從LiMn2O4中嵌入/脫出過程的反應原理是基于離子交換原理:
除此之外,Koyanaka H.等[18]定量研究了鋰離子吸附量和λ-型二氧化錳中氫離子含量之間的關系,發現二者在一定程度上相等,證明λ-型二氧化錳對鋰離子的選擇性吸附過程的理論基礎是基于離子交換反應。同時發現,隨著吸附溶液的pH逐漸降低,錳基吸附劑的吸附容量也逐漸升高,此現象證明了此過程受到離子交換反應機理的控制。
根據離子交換機理,材料中的 Li+可以完全被 H+取代,晶體中的 Mn(III)和 Mn(IV)位點在離子交換過程中保持不變且具有可逆性。由于在此過程中尖晶石結構未發生破壞,因此對 Li+顯現出高選擇吸附性。
2.3? 復合機理
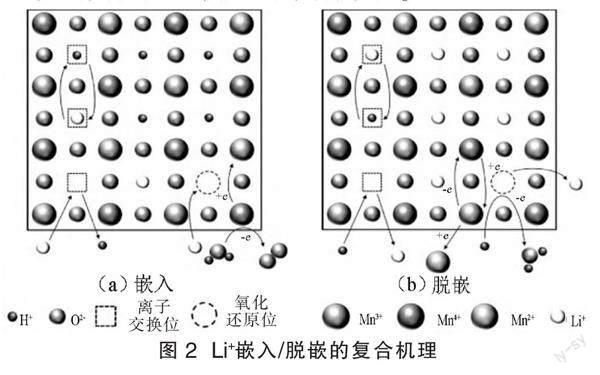
雖然很多學者發現并證明鋰離子在錳離子篩中的嵌入/脫嵌過程是基于離子交換原理,但此機理并不能完備地解釋在吸附解析過程中錳的溶損問題,以及吸附能力隨著吸附循環的進行逐漸降低的問題。因此很多學者認為錳基吸附劑的吸附過程是氧化還原機理和離子交換機理共同作用的復合機理,如圖2所示。
Ooi K等[19]研究了Li+在不同結構的錳基鋰離子篩中的吸附過程,其將鋰離子在離子篩中的吸附位點分為3種,即氧化還原反應位點, Li+特定離子交換位點和非特定的離子交換位點。離子篩制備過程的條件不同,導致其結構各異,3種吸附位點的占比不同,但是整個選擇性吸附過程是由兩種吸附機理共同控制的。Feng等[20]對離子篩中兩種位點具體分布情況的影響因素進行了具體分析,通過實驗發現,離子篩中Mn3+的尖晶石前驅體通過處理主要提供基于氧化還原機理的吸附位點,前驅體中的Mn4+主要提供基于離子交換機理的吸附位點。從而可以定量地分析兩種機理在復合機理中貢獻作用的大小,并以實驗數據作為驗證。
復合機理可以較好地解釋水溶液中 Li+的吸附脫附過程,但驗證過程比較復雜,未來還需要進行進一步的實驗驗證才能證明其有效性。
3? ?離子篩的固液界面改性
3.1? 摻雜改性
錳基吸附劑對鋰離子具有較高的選擇性和吸附容量,但是在尖晶石型鋰錳氧化物中往往存在Mn3+,其在酸性介質中會發生歧化反應生成Mn4+和Mn2+,Mn4+會留在尖晶石結構中形成λ-MnO2,而Mn2+溶于溶液導致尖晶石結構遭到破壞[21-22]。研究表明,通過對鋰錳氧化物摻雜可以改變離子篩的表面和內部結構,穩定其尖晶石結構,提高材料的吸附性能,提高材料的循環性能。目前主要的摻雜方式分為:陽離子摻雜、陰離子摻雜以及復合摻雜。
3.1.1? 陽離子摻雜
通過向離子篩中添加部分更加穩定的金屬陽離子,如Al、Mg、Co、Ni、Fe,一方面摻雜半徑更小的陽離子可以使鋰離子篩的體積收縮,結構更穩定;另一方面加入的陽離子可以取代部分Mn,從而在一定程度上抑制Jahn-Teller效應,降低Mn3+由于歧化反應造成的溶損。R. Thirunakaran等[23]通過水熱法合成的LiCrxMn2-xO4,通過表征發現其具有較好的性質,摻雜之后的材料更加穩定。CHEN等[24]也通過水熱法將鋁摻雜至LiMn2O4中,由于鋁的半徑小于錳,摻雜之后晶格收縮,形成更加穩定的Al-O鍵,使得結構更加穩定。摻雜后的材料在多次循環使用后仍然可以保證比較高的吸附容量。TIAN等[25]選擇性地使用軟化學方法將鎂摻雜在LiMn2O4中,合成LiMg0.56Mn1.5O4,在適當的吸附條件下,其對鋰的吸附容量達到37.4 mg/g,多次循環后的飽和吸附容量仍然保持在初始值的95%左右。CAO等[26]通過水熱法和固相法將Cr3+微量地摻雜在鋰離子篩的前驅體中,使結構中的錳離子平均化合價提高,減少歧化反應的發生,從而提高結構的穩定性,提高吸附容量。LI等[27]合成Li1.6Mn1.6-xFexO4,將鐵離子摻雜在晶格之中,鋰的吸附容量可以達到35.3 mg/g,同時錳的溶損低至1.66%,吸附性能優良。除此以外,Na+,K+,Zn2+等陽離子也被應用于鋰離子篩的摻雜實驗中,例如FENG等[28]合成的LiZn0.5Mn1.5O4,QIAN[29]合成的 (Li1-xKx)1.6Mn1.6O4,通過摻雜均在一定程度上提高了吸附容量,降低了溶損,但是并不能從根本上解決錳離子的雜質去除問題,同時引入了新的元素,為后期進行分離提純鋰鹽工作也帶來困難。
3.1.2? 陰離子摻雜
研究人員通過各種方法對鋰離子篩進行陰離子摻雜,以期實現對尖晶石結構中氧原子的替代。新結構的表達式為:LiMn2O4-xMx(M=F-、I-、S2-等)。為了保證材料原本的尖晶石結構不發生變化,用于摻雜的主要陰離子為F-、I-、S2-,其中氟離子由于半徑較小可以比較容易地進入晶格中,同時由于硫與氧的化學性質相近,常使用這兩種元素進行摻雜。陳召勇等[30]通過濕法球磨以及固相反應綜合操作,在材料中成功摻雜F-,形成Li1.1Mn2O3.95F0.05,并通過表征發現摻雜后的材料比較完好地保持了原本尖晶石結構,具有良好的穩定性,同時晶胞參數的增大方便鋰離子的進出。QIAN等[31]通過350 ℃條件下,添加NH4F和 (NH4)2F到LiMnO2中,成功合成兩種新型摻雜鋰離子篩,分別為LMO-F和LMO-S,兩種新型鋰離子篩的吸附容量為33.41 mg/g、27.95 mg/g,均大于摻雜前的結構。在保持材料尖晶石結構的前提下對材料進行摻雜,可供選擇的陰離子種類比較少,而在提高吸附容量的同時,又會在一定程度上加劇Jahn-Teller效應,影響結構的穩定性,限制其在工業領域的發展。
3.1.3? 復合摻雜
現階段對尖晶石LiMn2O4的摻雜改性主要是單方面改性,即單獨的陽離子或單獨的陰離子摻雜改性。單獨的摻雜過程會產生包括體系中多余陽離子的引入不利于分離,陰離子加入尖晶石結構不穩定等問題。在同一個尖晶石鋰錳氧化物鋰離子篩中的部分錳離子被其他陽離子取代,同時部分氧離子被其他陰離子取代,形成復合型摻雜的新型錳基鋰離子篩,表示為LiMxMn2-xO4-xNy(M=Li+、Al3+等,N=F-、S2-等)。當復合摻雜時,由于協同作用的影響,會在一定程度上降低單一元素摻雜帶來的問題,使復合材料的性能更加優良。但是,目前對于復合摻雜過程的研究比較少。海春喜等[32]對錳系鋰離子篩進行鋁和氟兩種元素摻雜,有效降低了鋰錳氧化物鋰離子篩的錳溶損率的問題。禹筱元等[33]研究了鉻和氟的協同摻雜,制備了LiMn2-xCrxO4-3xF3x前驅體,經酸洗脫后的離子篩鋰離子脫嵌可逆性和循環性較摻雜前均有所提高。
3.2? 包覆改性
除從根本上對離子篩粉末進行摻雜改性外,可以在前驅體合成過程中對前驅體進行包覆改性,可以在降低離子篩酸洗過程中錳的溶損外,通過改變固液接觸面,實現材料吸附容量的提升。楊喜云等[34]研究了一種Li2ZrO3@H1.6ZrxMn1.6-xO4復合錳系鋰離子篩,并證實所述的鋰離子篩對鋰吸附容量高,結構穩定,循環性能好,使用壽命長,是鹽湖鹵水或海水高效提鋰的吸附劑。王豪等[35]根據水熱法合成的前驅體Li1.6Mn1.6O4,并通過液相沉積的方法在其表面包覆ZrO2,錳的溶損降低至2.65%,吸附容量提升至29.4 mg/g,相較于未包覆的材料有了較大的提升。同時,OHASHI等[36]采用浸漬法合成的鋰離子吸附劑,并將鋁和鎳的氧化物包覆在表面,與之前的相比,包覆后的材料出現了較低的錳溶損和較高的吸附容量。
4? ?結論與展望
隨著鋰離子電池的快速發展,市場對于鋰的需求量逐年提升,從鹽湖鹵水和海水中提取鋰離子的工藝技術具有很大的市場前景。目前的改性方法主要是通過摻雜改性和包覆改性。兩種方法都可以在一定程度上提高鋰離子篩的吸附容量和降低錳的溶損,但是不能從根本上解決溶損問題,同時現階段的吸附結果主要是基于實驗室較低數量級吸附次數的實驗,無法滿足工業化的要求。進一步研究材料的多種陰陽離子摻雜工藝以及金屬氧化物的包覆工藝,通過改變固液界面的接觸狀態,在保持較低的錳溶損條件下,實現對水體中鋰的更高吸附容量是未來的主要研究方向。
參考文獻
[1] 吳靜,任秀蓮,魏琦峰.鹽湖鹵水中鋰的分離提取研究進展[J].無機鹽工業,2020,52(12):1-6.
[2] 韓佳歡,乜貞, 伍倩, 等.中國鋰資源供需現狀分析[J].無機鹽工業,? 2021, 53(12): 61-66.
[3] 李磊, 許燕, 鋰離子動力電池發展現狀及趨勢分析[J].中國錳業, 2020, 38(5): 9-13.
[4] KAVANAGH L,KEOHANE J,GARCIA CABELLOS G,et al. Global Lithium Sources—industrial Use and Future in the Electric Vehicle Industry: A Review[J].Resources, 2018, 7(3):57-86.
[5] 張敏, 李婷. 碳酸鋰逼近60萬元/噸 上市公司加速布局專家稱謹防價格回調風險[N]. 證券日報, 2022-11-14(B02).
[6] 鐘輝,周燕芳,殷輝安. 鹵水鋰資源開發技術進展 [J]. 礦產綜合利用,2003 (1) : 23-28.
[7] 葛濤, 徐亮, 孟金偉, 等. 鹽湖鹵水提鋰工藝技術研究進展 [J]. 有色金屬工程, 2021, 11(2): 55-62.
[8] 王琪, 趙有璟, 劉洋, 等. 高鎂鋰比鹽湖鎂鋰分離與鋰提取技術研究進展 [J]. 化工學報, 2021, 72(6): 2905-2921.
[9] SUN Y, WANG Q, WANG Y, et al. Recent advances in magnesium/lithium separation and lithium extraction technologies from salt lake brine[J]. Separation and Purification Technology, 2021,256:117807.
[10] 張德安, 宋禮慧, 趙淑芳, 等. 鹽湖鹵水鋰資源的開發進展 [J]. 鹽業與化工, 2015, 44(7): 1-2.
[11] XU X, CHEN Y, WAN P, et al.? Extraction of lithium with functionalized lithium ion-sieves[J].Progress in Materials Science, 2016, 84: 276-313.
[12] 李麗, 劉芳, 吳鋒, 等. 提鋰用錳氧化物離子篩的研究進展[J]. 無機材料學報, 2012, 27(10): 1109-1116.
[13] 趙元元, 陳海峰, 劉云云, 等. 錳系鋰離子篩的制備與改性的研究進展[J]. 無機鹽工業, 2022, 54(2): 21-29.
[14] TAKEUCHI H, NAGIRA S, YAMAMOTO H, et al. Solid dispersion particles of amorphous indomethacin with fine porous silica particles by using spray-drying method[J].International Journal of Pharmaceutics, 2005, 293(1): 155-164.
[15] HUNTER J.C. Preparation of new crystal form of manganese dioxide: λ-MnO2[J]. Solid State Chemistry, 1981, 39(2):142-147.
[16] OOI K, MIYAI Y, KATOH S, et al. Topotactic Li+ insertion to λ-MnO2 in the aqueous phase. Langmuir, 1989, 5(1): 150-157.
[17] SHEN X M, CLEARFIELD A. Phase transitions and ion exchange behavior of electrolytically prepared manganese dioxide[J]. Solid State Chem., 1986, 64(3): 270-282.
[18] KOYANAKA H, MATSUBAYA O, KOYANAKA Y, et al. Quanti-tative correlation between Li absorption and H content in manganese oxide spinel λ-MnO2[J]. Electroanalytical Chemistry, 2003, 559:77-81.
[19] OOI K, MIYAI Y, SAKAKIHARA J. Mechanism of Li+ insertion in spinel-type manganese oxide-redox and ion-exchange reactions. Langmuir[J].1991, 7(6): 1167-1171.
[20] FENG Q, MIYAI Y, KANOH H, et al. Li+ extraction/insertion with spinel-type lithium manganese oxides-characterization of redoxtype and ion-exchange-type sites[J]. Langmuir, 1992, 8(7): 1861-1867.
[21] 石西昌, 尹世豪, 唐天罡, 等. 錳鈦系復合鋰離子篩的制備及其吸附性能研究[J]. 材料導報, 2014, 28(8):13-16.
[22] SHI X, ZHOU D, ZHANG Z, et al. Synthesis and properties of Li1.6Mn1.6O4 and its adsorption application [J]. Hydrometallurgy, 2011, 110(1-4): 99-106.
[23] Thirunakaran R,Ki-Tae Kim, Yong-Mook Kang, et al. Adipic acid assisted, solgel route for synthesis of LiCrxMn2-xO4 cathode material [J].? Power Soures, 2004, 137(1):100-104.
[24] CHEN M M, WU R Y, JU S G, et al. Improved performance of Al-doped LiMn2O4 ion-sieves for Li+ adsorption [J]. Microporous and Mesoporous Materials, 2018, 261:29-34.
[25] TIAN L, MA W, HAN M. Adsorption behavior of Li+ onto nano-lithium ion sieve from hybrid magnesium/lithium manganese oxide[J]. Chemical Engineering Journal, 2010, 156(1):134-140.
[26] CAO G F, YANG X Y, YIN Z L, et al. Synthesis, adsorption properties and stability of Cr-doped lithium ion sieve in salt lake brine [J]. Bulletin of the Chemical Society of Japan, 2019, 92 (7):1205-1210.
[27] LI J S, YANG X Y, FU Y Y, et al. Recovery of Fe, Mn, Ni and Co in sulfuric acid leaching liquor of spent lithium ion batteries for synthesis of lithium ion-sieve and NixCoyMn1-x-y(OH)2 [J]. Hydrometallurgy, 2019, 190:105190.
[28] FENG Q, KANOH H, MIYAI Y, et al.Li+ extraction/insertion reactions with LiZn0.5Mn1.5O4 spinel in the aqueous phase [J].Chemistry of Materials, 1995 (2):379-384.
[29] QIAN F R, ZHAO B, GUO M, et al. Surface trace doping of Na enhancing structure stability and adsorption properties of Li1.6Mn1.6O4 for Li+ recovery [J]. Separation and Purification Technology, 2020, 256:117583.
[30] 陳召勇, 劉興泉.高容量的 Li1.1Mn2O3.95F0.05鋰離子二次電池正極材料[J]. 化學學報, 2001, 59(9):1380-1383.
[31] QIAN F R, ZHAO B, GUO M, et al. Trace doping by fluoride and sulfur to enhance adsorption capacity of manganese oxides for lithium recovery [J]. Materials & Design, 2020, 194: 108-867.
[32] 海春喜, 張果泰,? 周園, 等.一種摻雜改性的鋰離子篩及其制備方法:CN114100562A[P].2022-03-01.
[33] 禹筱元, 余仕禧, 周武藝, 等.復合摻雜改性 LiMn2-xCrxO4-3xF3x 正極材料的制備及性能[J].硅酸鹽學報, 2010, 38(6):1053-1058.
[34] 楊喜云, 王園園, 伍玲龍, 等.一種鋯酸鋰包覆兼鋯摻雜的復合錳系鋰離子篩及其制作和應用:CN115501851B[P].2021-06-23.
[35] 王豪, 楊喜云, 尹周瀾, 等. 包覆 ZrO2 鋰離子篩的制備及其在鹽湖鹵水中的吸附性能[J].無機化學學報, 2017, 33(10):1775-1781.
[36] OHASHI F, TAI Y. Lithium adsorption from natural brine using surface-modified manganese oxide a dsorbents[J].Materials Letters, 2019, 251:214-217.
收稿日期:2022-11-28
作者簡介:黃敏(1986—),女,工程師,主要從事有色冶金工程設計工作。

