刺槐素對非小細胞肺癌A549細胞的抑制作用及其機制
閆慶韜, 萬斯傲, 劉意, 陸健,2, 吳占敖
(1. 江蘇大學生命科學學院, 江蘇 鎮江 212013; 2. 江蘇大學醫學院, 江蘇 鎮江 212013; 3. 南京大學醫學院附屬金陵醫院口腔科, 江蘇 南京 210093)
我國肺癌發病率和死亡率均位于惡性腫瘤首位[1]。由于多數肺癌患者確診時已屬晚期,且肺癌治療有限、容易復發和易產生耐藥性等,其臨床治療成功率很低[2-3]。根據組織學分類,肺癌可分為小細胞肺癌和非小細胞肺癌(non-small cell lung carcinoma,NSCLC),其中NSCLC約占所有肺癌病例85%[4]。NSCLC治療方法通常為手術、化療和放療等,其中化療是改善癌癥患者生活質量和提高生存率的有效治療手段,但對部分患者無顯著治療效果,部分晚期NSCLC患者僅能存活9~12個月[5]。
已有文獻表明,膳食藥物可有效降低癌癥風險[6],通過飲食中的生物活性化合物抑制或預防癌癥也是臨床癌癥治療中的重要方法[7]。刺槐素(acacetin)又名金合歡素,化學名5,7-二羥基-4′-甲氧基黃酮,屬黃酮類化合物,廣泛存在于野菊花、藿香和刺槐等天然植物中[8]。研究表明,刺槐素具有抗腫瘤活性,可通過阻斷細胞周期進展和誘導細胞凋亡進而抑制肝癌HepG2細胞[9]和NSCLC A549細胞[10]增殖,但具體作用機制尚未十分清晰。
血管內皮生長因子(vascular endothelial growth factor,VEGF)家族包括VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E和胎盤生長因子(PLGF)6個成員[11]。其中,VEGF-A常代指為VEGF,在有血管生成的NSCLC組織中呈高表達[12],對維持肺癌發展起重要作用[13],是肺癌治療的潛在分子靶點[14]。研究表明,NSCLC中VEGF表達水平可影響腫瘤平均血管密度[15],從而影響腫瘤血管生成。在六價鉻致人肺支氣管上皮細胞(Beas-2B)惡性轉化的過程中,VEGF可通過影響遷移和侵襲相關蛋白如E-鈣黏蛋白(E-cadherin)和基質金屬蛋白酶-9(matrix metalloproteinase-9,MMP-9)等表達,從而調控細胞遷移、侵襲以及血管生成[16]。在鼻咽癌中,VEGF可通過自分泌調節MMP-9和E-cadherin等蛋白表達,影響細胞遷移、侵襲和血管生成[17]。E-cadherin是上皮間質轉化標志蛋白,其在腫瘤細胞中表達降低,進而增強腫瘤細胞侵襲和轉移[18]。MMP-9是參與腫瘤細胞轉移的蛋白水解酶[19],其表達增加可破壞基底膜和細胞外基質,從而介導腫瘤的侵襲和轉移[20-22]。因此,本研究擬以肺癌A549細胞為研究對象,探究刺槐素對其遷移、侵襲及血管生成能力的影響。
1 材料與方法
1.1 細胞、主要試劑及儀器
人肺癌A549細胞及人臍靜脈內皮細胞(human umbilical vein endothelial cell,HUVEC)由江蘇大學醫學院2506實驗室饋贈。刺槐素(純度>97%)購于美國Sigma公司;RPMI-1640培養基、Opti-MEM、胎牛血清、胰酶購于美國Gibco公司;Lipofectamine 2000轉染試劑、基質膠購于美國Life Science公司;BCA蛋白濃度測定試劑盒、SDS-PAGE凝膠制備試劑盒、4%低聚甲醛和結晶紫染色液購于上海碧云天生物公司;VEGF-A165兔抗人單克隆抗體購于美國Santa Cruz公司;E-cadherin、MMP-9兔抗人單克隆抗體購于美國Immunoway公司;GAPDH兔抗人單克隆抗體、山羊抗兔IgG二抗購于美國Cell公司;VEGF-A重組質粒由上海吉凱基因化學技術有限公司構建;siRNA由廣州銳博生物技術有限公司合成;羅丹明標記鬼筆環肽熒光染料、DAPI核熒光染料購于北京索萊寶公司;Transwell小室(8.0 μm)購于美國Corning公司;血管生成載玻片購于德國Ibidi公司。
細胞培養箱、化學發光凝膠成像分析系統(美國Thermo公司);CKX41倒置顯微鏡(日本Olympus公司);酶標儀(美國Bio-rad公司);Cytation5細胞成像多功能酶標儀(美國Biotek公司)。
1.2 刺槐素對A549細胞遷移、侵襲及血管生成的影響
1.2.1 細胞培養與刺槐素處理 A549細胞及HUVEC用RPMI-1640完全培養基(含10%胎牛血清、1%鏈霉素與青霉素)于37 ℃、5% CO2細胞培養箱內培養;細胞生長至融合率達70%時進行傳代培養。
將適量刺槐素溶于二甲基亞砜中,配制成1 mg/mL母液,并用0.22 μm濾器過濾后備用。實驗時用完全培養基稀釋母液至所需濃度(二甲基亞砜終濃度<0.2%)。
1.2.2 MTT法檢測細胞活力 將A549細胞分為0、1、2.5、5、10、20、30、40、50 μmol/L刺槐素組。將處于對數生長期的A549細胞以4×104/mL細胞密度接種于96孔板,每孔加入100 μL細胞懸液;待細胞貼壁后,按照分組加入相應濃度刺槐素,0 μmol/L組為對照組,每組設置5個復孔;孵育24 h;棄培養基,每孔加入100 μL溶有MTT(5 mg/mL)的培養基,37 ℃孵育4 h;棄培養基,每孔加入150 μL二甲基亞砜充分溶解振勻,檢測490 nm波長處光密度(D)值。細胞活力(%)=D加藥組/D對照組×100%,根據公式計算細胞活力。采用軟件GraphPad Prism 8.0.1計算刺槐素的半數抑制濃度(half maximal inhibitory concentration,IC50)。
1.2.3 蛋白免疫印跡法檢測細胞VEGF、E-cadherin及MMP-9蛋白表達水平 將A549細胞分為0、10、20、40 μmol/L刺槐素組,分別加入對應濃度刺槐素處理24 h;提取各組細胞總蛋白,根據BCA蛋白濃度檢測試劑盒測定蛋白濃度。配制10% SDS-PAGE凝膠,80 V電泳30 min,120 V電泳50 min;300 mA轉膜90 min,將蛋白轉移至PVDF膜;5%脫脂奶粉室溫封閉2 h;加入對應VEGF-A、E-cadherin、MMP-9、GAPDH抗體(內參),稀釋比均為1 ∶1 000,4 ℃孵育過夜;TBST洗膜3次;加入二抗羊抗兔抗體,稀釋比為1 ∶20 000,室溫孵育2 h;TBST洗膜3次;加入ECL曝光液顯影并拍攝,Image J軟件分析目的蛋白相對表達水平。
1.2.4 劃痕愈合實驗檢測細胞遷移能力 將處于對數生長期的A549細胞接種于6孔板中,同“1.2.3”處理后培養至細胞融合率達80%~90%;用200 μL槍頭劃痕,PBS漂洗2次;加入新鮮培養基,倒置顯微鏡下觀察,每孔隨機選取6個視野拍照(0 h);繼續培養24 h,于相同視野拍照(24 h)。Image J軟件分析計算劃痕面積。劃痕愈合率(%)=(0 h劃痕面積-24 h劃痕面積)/0 h劃痕面積×100%,根據公式計算劃痕愈合率。
1.2.5 Transwell實驗檢測細胞遷移及侵襲能力 取60 μL基質膠 ∶1%濃度血清的培養基比例為1 ∶5~1 ∶8的混合液,鋪勻Transwell小室底部,37 ℃凝固4 h用于細胞侵襲實驗。
消化、收集“1.2.3”各組細胞,計數并用含1%血清培養基調整細胞密度;以每孔3×103個細胞(遷移實驗)或5×103個細胞(侵襲實驗)密度接種于小室中(200 μL/孔);在下室(24孔板)中加入600 μL含20%血清的培養基,每組設3個平行對照,培養24 h;棄上室內培養基,用棉簽輕柔除去上室內未遷移細胞,遷移至膜底部的細胞用4%低聚甲醛固定30 min;結晶紫染色30 min;顯微鏡下隨機觀察6個視野并拍照記錄,Image J軟件計數。
1.2.6 免疫熒光實驗檢測細胞骨架重排能力 消化、收集“1.2.3”各組細胞,以每孔5×103個細胞接種于24孔板中(500 μL/孔),每組設3個平行對照,培養至細胞融合率為40%~50%;棄培養基,每孔加入600 μL 4%低聚甲醛,室溫固定20 min;每孔加入600 μL 0.5% Trinton X-100,室溫透化10 min;現配含1%濃度牛血清白蛋白的羅丹明-鬼筆環肽工作液(100 nmol/L),每孔加入200 μL工作液37 ℃避光孵育30 min;現配10 μg/mL DAPI染液,每孔加入200 μL染液復染細胞核,室溫避光孵育5 min;Cytation5細胞成像多功能酶標儀觀察并拍照。
1.2.7 小管生成實驗檢測細胞血管生成能力 收集“1.2.3”各組細胞上清液分別培養HUVEC 24 h;將基質膠4 ℃過夜融化;血管生成載玻片上每孔加10 μL基質膠,37 ℃放置30 min至基質膠凝固;將HUVEC以每孔1×103個細胞密度加入制備好的血管生成載玻片中(50 μL/孔),每組設置兩個平行對照,培養12 h;顯微鏡下觀察并拍照記錄,Image J軟件分析管腔總分支長度和成管節點數。
1.3 VEGF調控A549細胞遷移、侵襲及血管生成
1.3.1 細胞分組及轉染 將A549細胞分為空白對照組、過表達陰性對照組、過表達組、敲減陰性對照組和敲減組;空白對照組細胞僅更換培養基,過表達陰性對照組細胞轉染空載體質粒,過表達組細胞轉染VEGF-A重組質粒,敲減陰性對照組細胞轉染含無義序列siRNA片段,敲減組細胞轉染VEGF siRNA。細胞轉染過程如下:
使用無雙抗的完全培養基傳代培養A549細胞并接種至6孔板,繼續培養至細胞融合率達70%時,PBS漂洗3次,換為1.5 mL RPMI-1640培養基。用250 μL Opti-MEM稀釋2~3 μL Lipofectamine 2000配置成溶液Ⅰ;用250 μL Opti-MEM分別稀釋2.5 μg VEGF-A重組質粒、空載體質粒或分別稀釋250 nmol/L VEGF siRNA、無義序列siRNA配置成溶液Ⅱ;分別將溶液Ⅰ與各組別溶液Ⅱ混勻,室溫靜置20 min;加至對應組別的細胞中輕柔搖勻,培養6 h;換液,轉染24 h;收集細胞進行后續實驗。
1.3.2 蛋白免疫印跡法檢測細胞VEGF、E-cadherin及MMP-9蛋白表達水平 提取“1.3.1”處理后的A549細胞總蛋白,后續實驗操作同“1.2.3”。
1.3.3 劃痕愈合實驗檢測細胞遷移能力 取“1.3.1”處理后的A549細胞,后續實驗操作同“1.2.4”。
1.3.4 Transwell實驗檢測細胞遷移及侵襲能力 消化收集“1.3.1”處理后的A549細胞,后續實驗操作同“1.2.5”。
1.3.5 免疫熒光實驗檢測細胞骨架重排能力 消化收集“1.3.1”處理后的A549細胞,后續實驗操作同“1.2.6”。
1.3.6 小管生成實驗檢測細胞血管生成能力 收集“1.3.1”不同組細胞上清液分別培養HUVEC 24 h;后續實驗操作同“1.2.7”。
1.4 數據統計分析
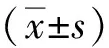
2 結果
2.1 刺槐素抑制A549細胞遷移、侵襲及血管生成
2.1.1 刺槐素抑制A549細胞活力 MTT實驗結果顯示(圖1),與0 μmol/L組相比,10、20、30、40、50 μmol/L刺槐素組A549細胞活力均明顯降低(P均<0.05)。分別與1、2.5、5、10 μmol/L刺槐素組相比,20、30、40、50 μmol/L組A549細胞活力均顯著降低(P均<0.05),即在一定濃度范圍內,隨著刺槐素濃度升高,細胞活力逐漸降低。測定刺槐素對A549細胞的IC50為34.49 μmol/L,由此選擇10、20、40 μmol/L刺槐素濃度進行后續實驗。

a:P<0.05,與0 μmol/L組相比;b:P<0.05,與1 μmol/L組相比;c:P<0.05,與2.5 μmol/L組相比;d:P<0.05,與5 μmol/L組相比;e:P<0.05,與10 μmol/L組相比
2.1.2 刺槐素調控A549細胞中VEGF及遷移與侵襲相關蛋白的表達 蛋白免疫印跡結果顯示(圖2),與0 μmol/L組相比,10、20、40 μmol/L刺槐素組A549細胞中VEGF和MMP-9蛋白表達水平明顯降低(P均<0.01),E-cadherin蛋白表達水平明顯升高(P均<0.01);與10 μmol/L組相比,40 μmol/L組VEGF蛋白表達水平明顯降低(t=10.750,P<0.05),20、40 μmol/L組MMP-9蛋白表達水平明顯降低(t=5.138,15.250,P<0.05或<0.01),20、40 μmol/L組E-cadherin蛋白表達水平明顯升高(t=4.495,6.745,P<0.05或<0.01);與20 μmol/L組相比,40 μmol/L組MMP-9蛋白表達水平明顯降低(t=8.983,P<0.01),E-cadherin無顯著性差異。由此表明,刺槐素可調控A549細胞中VEGF、E-cadherin及MMP-9蛋白表達,呈一定的濃度依賴性。

a:P<0.01,與0 μmol/L組相比;b:P<0.05,c:P<0.01,與10 μmol/L組相比;d:P<0.01,與20 μmol/L組相比
2.1.3 刺槐素抑制A549細胞遷移與侵襲 劃痕實驗結果顯示,與0 μmol/L組相比,10、20、40 μmol/L刺槐素組細胞劃痕愈合率顯著降低(t=7.352,9.719,10.720,P<0.05或<0.01),其中,40 μmol/L組劃痕愈合率明顯低于10 μmol/L組(t=5.730,P<0.01)。見圖3。遷移實驗結果顯示,與0 μmol/L組相比,10、20、40 μmol/L刺槐素組A549細胞遷移細胞數顯著降低(t=5.684,11.700,18.370,P均<0.01);其中,20、40 μmol/L組遷移細胞數明顯少于10 μmol/L組(t=6.892,15.000,P均<0.01),40 μmol/L組遷移細胞數明顯少于20 μmol/L組(t=9.725,P<0.01)。見圖4。

a:P<0.05,b:P<0.01,與0 μmol/L組相比;c:P<0.01,與10 μmol/L組相比

a:P<0.01,與0 μmol/L組相比;b:P<0.01,與10 μmol/L組相比;c:P<0.01,與20 μmol/L組相比
Transwell侵襲實驗結果顯示,與0 μmol/L組相比,10、20、40 μmol/L刺槐素組A549細胞侵襲細胞數顯著降低(t=15.500,22.100,23.890,P均<0.01);20、40 μmol/L組侵襲細胞數明顯少于10 μmol/L組(t=5.096,7.367,P<0.05或<0.01),一定范圍內侵襲細胞數隨刺槐素濃度升高而降低。見圖5。免疫熒光實驗結果顯示,與0 μmol/L組相比,10、20、40 μmol/L刺槐素組中與細胞運動能力直接相關的胞質內絲狀團塊狀骨架肌動蛋白減少,有序性排布減弱。見圖6。由此表明,刺槐素可抑制肺癌A549細胞遷移和侵襲。

a:P<0.01,與0 μmol/L組相比;b:P<0.05,c:P<0.01,與10 μmol/L組相比

圖6 免疫熒光實驗檢測A549細胞經刺槐素處理后F-肌動蛋白分布及重排情況(×200)
2.1.4 經刺槐素培養的A549細胞上清液抑制HUVEC血管生成能力 小管生成實驗結果顯示(圖7),與0 μmol/L組相比,10、20、40 μmol/L刺槐素組HUVEC小管總分支長度明顯縮短及節點數明顯減少(P<0.05或<0.01);20、40 μmol/L組小管總分支長度明顯短于10 μmol/L組(t=5.495,10.820,P<0.05或<0.01),40 μmol/L組小管總分支長度明顯短于20 μmol/L組(t=4.552,P<0.05);40 μmol/L組小管節點數明顯少于10 μmol/L組(t=8.854,P<0.01)。由此表明,經刺槐素培養的A549細胞上清液抑制HUVEC血管生成。

a:P<0.05,b:P<0.01,與0 μmol/L組相比;c:P<0.05,d:P<0.01,與10 μmol/L組相比;e:P<0.05,與20 μmol/L組相比
2.2 VEGF促進A549細胞遷移、侵襲及血管生成
2.2.1 調控VEGF表達影響A549細胞中遷移和侵襲相關蛋白的表達 蛋白免疫印跡結果顯示(圖8),與空白對照及過表達陰性對照組相比,過表達組A549細胞中VEGF、MMP-9蛋白表達水平均明顯升高(P<0.01或<0.001),而E-caherin蛋白表達水平明顯降低(P均<0.001);與空白對照及敲減陰性對照組相比,敲減組A549細胞中VEGF、MMP-9蛋白表達水平均明顯降低(P<0.01或<0.001),而E-caherin蛋白表達水平明顯升高(P<0.01或<0.001)。由此表明,調控A549細胞中VEGF表達可影響遷移與侵襲相關蛋白E-cadherin及MMP-9的表達。

圖8 蛋白質印跡檢測調控VEGF表達水平后A549細胞中遷移侵襲相關蛋白質的表達
2.2.2 VEGF促進A549細胞遷移侵襲 劃痕愈合實驗結果顯示,與空白對照及過表達陰性對照組相比,VEGF過表達組A549細胞劃痕愈合率明顯升高(t=6.724,6.152,P<0.05或<0.01),VEGF敲減組則明顯降低(t=8.757,7.250,P<0.01或<0.05)。見圖9。Transwell遷移實驗結果顯示,與空白對照及過表達陰性對照組相比,VEGF過表達組細胞遷移數明顯增多(t=5.840,8.598,P<0.05或<0.01);與空白對照及敲減陰性對照組相比,VEGF敲減組則明顯減少(t=11.010,18.020,P<0.05或<0.01)。見圖10。

圖9 傷痕愈合實驗檢測調控VEGF表達后A549細胞的水平遷移能力(×40)

圖10 Transwell遷移實驗檢測調控VEGF表達后A549細胞的垂直遷移能力(×100)
Transwell侵襲實驗結果顯示,與空白對照及過表達陰性對照組相比,VEGF過表達組侵襲細胞數明顯增多(t=4.481,8.536,P<0.05或<0.01);與空白對照及敲減陰性對照組相比,VEGF敲減組則明顯減少(t=7.837,17.200,P<0.05或<0.001)。見圖11。

圖11 Transwell侵襲實驗檢測調控VEGF表達后A549細胞的侵襲能力(×100)
免疫熒光實驗結果顯示,與空白對照及過表達陰性對照組相比,VEGF過表達組A549細胞肌動蛋白纖維排列更有序,且胞質熒光強度更強;與空白對照及敲減陰性對照組相比,VEGF敲減組細胞胞質內絲狀團塊狀骨架肌動蛋白減少,且熒光強度減弱。見圖12。

圖12 免疫熒光實驗檢測調控VEGF表達后A549細胞F-肌動蛋白分布及重排情況(×200)
2.2.3 VEGF促進A549細胞血管生成 小管生成實驗結果顯示(圖13),與空白對照及過表達陰性對照組相比,VEGF過表達組HUVEC細胞形成小管的管腔完整,輪廓清晰,總分支長度及節點數明顯升高(P<0.05或<0.01);與空白對照及敲減陰性對照組相比,VEGF敲減組小管形成不明顯,仍有許多散在的細胞團,總分支長度明顯變短及節點數明顯減少(P<0.05或<0.01)。由此表明,VEGF可促進A549細胞血管生成。
3 討論
刺槐素是一種具有抗腫瘤活性作用的天然化合物[23]。本研究首先通過MTT法篩選刺槐素加藥濃度,發現較低濃度(10 μmol/L)的刺槐素即可抑制A549細胞活力,且抑制作用呈一定的濃度依賴性,IC50為34.49 μmol/L,因此選擇低于IC50的20 μmol/L為刺槐素的有效作用濃度,再加入10 μmol/L和40 μmol/L以體現不同刺槐素藥物濃度與生物學效應的關系。劃痕愈合、Transwell以及免疫熒光實驗結果表明,刺槐素可抑制肺癌A549細胞遷移和侵襲,且呈一定的濃度依賴性,初步證實刺槐素在肺癌細胞中的抗腫瘤活性。此外,刺槐素可致A549細胞中VEGF和MMP-9蛋白表達降低,而E-cadherin蛋白表達升高,進一步證實其對A549細胞遷移和侵襲的抑制作用。同時,經刺槐素處理后的A549細胞上清液可抑制HUVEC的小管生成能力,表明刺槐素可能通過抑制A549細胞旁分泌VEGF,從而抑制其血管生成能力。VEGF作為與腫瘤關系最為密切的血管生成因子,可誘導血管生成,為腫瘤侵襲和轉移創造條件[13-15,24],因此推測刺槐素可能通過調控VEGF進而抑制A549細胞遷移、侵襲和血管生成。
在本研究中,通過細胞轉染上調A549細胞中VEGF蛋白表達后,細胞遷移、侵襲和血管生成能力明顯增強;而敲減A549細胞中VEGF蛋白表達后,其結果則相反,由此表明VEGF可調控A549細胞遷移、侵襲和血管生成。此外,VEGF可正向調控A549細胞中MMP-9蛋白表達,負向調控E-cadherin蛋白表達,該結果與VEGF調控A549細胞遷移、侵襲和血管生成能力的現象一致,提示VEGF可能通過上皮間質轉化影響細胞遷移和侵襲,并通過MMP-9分解基質,發揮促血管生成作用。由此可見,A549細胞可通過表達VEGF蛋白以自分泌的方式調控MMP-9及E-cadherin等相關蛋白的表達,或以旁分泌的方式刺激內皮細胞,從而促進細胞外基質降解及上皮間質轉化并誘導血管形成,為A549細胞遷移、侵襲以及血管生成提供有利條件。
綜上所述,本研究表明刺槐素可能通過降低VEGF表達進而抑制肺癌A549細胞遷移、侵襲和血管生成。然而,本研究僅在體外肺癌A549細胞中進行,缺乏體內研究,后續有待通過動物實驗進一步闡明VEGF與A549細胞遷移、侵襲及血管生成的相關性。此外,VEGF調節A549細胞生物學功能的相關信號通路仍需進一步研究。

