電壓門(mén)控鉀通道亞家族G成員1在肺癌中的表達(dá)及生物學(xué)作用
程峰, 彭詩(shī)晴, 曹楊, 陸益民
(1. 江蘇大學(xué)醫(yī)學(xué)院, 江蘇 鎮(zhèn)江 212013; 2. 江蘇大學(xué)附屬昆山醫(yī)院呼吸與危重癥醫(yī)學(xué), 江蘇 蘇州 215300)
肺癌以侵襲度高、病情進(jìn)展快、預(yù)后差為主要特征[1]。根據(jù)2020年全球癌癥研究報(bào)告,肺癌約占所有癌癥病例11.4%,致死率約占所有癌癥病例18.0%[2]。目前,外科手術(shù)、免疫治療和化療是肺癌主要的治療手段,但晚期肺癌患者惡性程度高,遠(yuǎn)處轉(zhuǎn)移風(fēng)險(xiǎn)高,總生存期短,預(yù)后差[3-6]。
鉀離子通道蛋白是一類(lèi)跨膜蛋白,在調(diào)節(jié)神經(jīng)信號(hào)傳導(dǎo),防止神經(jīng)元過(guò)度興奮和上皮電解質(zhì)轉(zhuǎn)運(yùn)等方面起關(guān)鍵作用[7-9]。最新研究表明,由于其結(jié)構(gòu)和功能的多樣性,鉀離子通道蛋白的異常表達(dá)參與多種腫瘤的發(fā)生[10-11],包括胃癌[12]、前列腺癌[13]和宮頸癌[14]等。電壓門(mén)控鉀通道亞家族G成員1(potassium voltage-gated channel subfamily G member 1,KCNG1)為鉀離子通道家族成員之一,定位于染色體20q 13.13,通過(guò)與kv2.1(電壓門(mén)控鉀通道亞家族B成員1,KCNB1)形成功能性四聚體通道調(diào)控該離子通道的生物學(xué)功能[15]。目前關(guān)于KCNG1的研究多集中在房顫[16]和癲癇[17]等,僅Du等[18]證實(shí)KCNG1可作為頭頸部鱗狀細(xì)胞癌的一個(gè)預(yù)后指標(biāo)。本研究擬基于生物信息學(xué)分析,并結(jié)合體外細(xì)胞功能學(xué)實(shí)驗(yàn)初步驗(yàn)證KCNG1在肺癌中的表達(dá)及生物學(xué)功能。
1 材料與方法
1.1 生物信息學(xué)分析
1.1.1KCNG1mRNA差異表達(dá)分析 基于TCGA泛癌數(shù)據(jù)集(https://www.cancer.gov/tcga/)下載肺癌樣本高通量測(cè)序數(shù)據(jù)(HTSeq),包含1 145份非配對(duì)組織樣本(癌旁組織108例,肺癌組織1 037例)和212例配對(duì)組織樣本(癌旁組織106例,肺癌組織106例),采用R軟件(第3.6.3版)進(jìn)行統(tǒng)計(jì)分析,并結(jié)合ggplot2軟件包進(jìn)行可視化,KCNG1mRNA在兩組間表達(dá)差異采用Wilcoxon秩和檢驗(yàn)進(jìn)行比較分析。
1.1.2KCNG1mRNA表達(dá)與肺癌患者臨床病理特征、預(yù)后的關(guān)系及預(yù)測(cè)模型的構(gòu)建 從TCGA泛癌數(shù)據(jù)集下載肺癌樣本高通量測(cè)序數(shù)據(jù),根據(jù)KCNG1mRNA相對(duì)表達(dá)水平中位數(shù)分為KCNG1mRNA高表達(dá)組及低表達(dá)組,采用χ2檢驗(yàn)分析KCNG1mRNA表達(dá)水平與肺癌患者臨床病理特征的相關(guān)性。
采用Kaplan-Meier曲線和log-rank檢驗(yàn)比較KCNG1mRNA高表達(dá)組和KCNG1mRNA低表達(dá)組患者總體生存期;并針對(duì)不同病理特征的肺癌患者,比較KCNG1mRNA高表達(dá)和低表達(dá)者的生存差異。
基于肺癌患者的預(yù)后對(duì)不同的臨床病理特征、KCNG1mRNA表達(dá)水平等進(jìn)行單因素Cox回歸分析并將結(jié)果繪制成森林圖;進(jìn)一步采用多因素Cox回歸分析,并納入P<0.05的因素,采用R軟件中RMS軟件包建立列線圖模型,預(yù)測(cè)肺癌患者1年、3年、5年總生存期。預(yù)測(cè)模型通過(guò)校準(zhǔn)曲線進(jìn)行可視化評(píng)估,良好列線圖預(yù)測(cè)模型的散點(diǎn)落在45°對(duì)角線上[19]。
1.1.3 KCNG1相關(guān)差異表達(dá)基因分析 采用R軟件中DESeq2軟件包對(duì)KCNG1mRNA高表達(dá)組及低表達(dá)組間差異表達(dá)基因進(jìn)行分析鑒定。篩選閾值設(shè)置為|log2[差異倍數(shù)(fold change,FC)]|>1.5,一般默認(rèn)|log2(FC)|>1為差異基因的篩選標(biāo)準(zhǔn)和校正后P值<0.05,采用火山圖可視化篩選后的差異基因,并在熱圖中顯示與KCNG1相關(guān)的差異基因。
1.1.4 GO/KEGG富集分析和GSEA 采用clusterProfiler軟件包(3.14.3版本)對(duì)KCNG1相關(guān)差異表達(dá)基因進(jìn)行GO和KEGG富集分析,GO富集分析KCNG1主要參與的生物學(xué)過(guò)程、細(xì)胞分布和分子功能;KEGG富集分析KCNG1相關(guān)差異表達(dá)基因主要參與的信號(hào)通路,并映射成氣泡圖。GSEA是基于TCGA數(shù)據(jù)庫(kù)中肺癌組織的轉(zhuǎn)錄本數(shù)據(jù),采用clusterProfiler包(3.14.3版本)進(jìn)行富集分析,設(shè)定標(biāo)準(zhǔn):錯(cuò)誤發(fā)現(xiàn)率<0.25及校正后P值<0.05。
1.2 細(xì)胞實(shí)驗(yàn)
1.2.1 細(xì)胞系、主要試劑和儀器 人肺癌A549、H1299細(xì)胞系及人肺泡上皮細(xì)胞購(gòu)自中國(guó)科學(xué)院上海生物科學(xué)研究所;F-12K培養(yǎng)液、胎牛血清、胰蛋白酶購(gòu)自美國(guó)Gibco公司;KCNG1小干擾試劑盒、KCNG1引物和5-乙炔基-2′-脫氧尿苷(EdU)檢測(cè)試劑盒購(gòu)自廣州銳博生物技術(shù)公司;RNA快速提取試劑盒購(gòu)自上海奕杉生物有限公司;逆轉(zhuǎn)錄試劑盒及SYBR Green染料購(gòu)自康為世紀(jì)生物科技有限公司;實(shí)時(shí)熒光定量PCR(qRT-PCR)儀購(gòu)自上海宏石醫(yī)療科技有限公司;PVDF膜購(gòu)自德國(guó)Millipore公司;兔抗人KCNG1(Sino Biological公司);GAPDH一抗、羊抗兔IgG(英國(guó)Abcam公司);增強(qiáng)化學(xué)發(fā)光試劑(ECL,德國(guó)Millipore公司);Transwell小室、Matrigel基質(zhì)膠(美國(guó)Corning公司);血管生成擬態(tài)實(shí)驗(yàn)試劑盒(德國(guó)Ibidi公司);多功能酶標(biāo)儀(瑞士Tecan公司);熒光顯微鏡(日本Olympus公司)。
1.2.2 細(xì)胞轉(zhuǎn)染及分組 將處于對(duì)數(shù)生長(zhǎng)期的肺癌A549和H1299細(xì)胞以每孔3×104個(gè)密度接種于6孔板中,分為KCNG1敲低組1、KCNG1敲低組2以及對(duì)照組。待細(xì)胞融合率接近50%時(shí),將兩個(gè)不同小干擾siRNA序列及陰性對(duì)照組siRNA序列分別轉(zhuǎn)入A549及H1299細(xì)胞中,轉(zhuǎn)染36~48 h;收集各組細(xì)胞用于后續(xù)實(shí)驗(yàn),采用蛋白質(zhì)免疫印跡法驗(yàn)證轉(zhuǎn)染效率。siRNA序列如下:KCNG1敲低組1,TCCTCAACGTGTGCGATGA;KCNG1敲低組2,TCAACGTAGGCGGCATCAA。
1.2.3 qRT-PCR檢測(cè)KCNG1mRNA表達(dá)水平 采用RNA快速提取試劑盒提取細(xì)胞中總RNA,然后逆轉(zhuǎn)錄合成cDNA,最后用SYBR Green PCR Master Mix配置20 μL反應(yīng)體系行qRT-PCR。具體反應(yīng)體系:10 μL 2×Ultra SYBR Mixture、0.4 μL上游引物、0.4 μL下游引物、0.8 μL cDNA、8.4 μL雙蒸水。反應(yīng)條件:95 ℃預(yù)變性10 min,95 ℃變性15 s,60 ℃退火1 min。β-肌動(dòng)蛋白為內(nèi)參。引物序列:KCNG1上游5′-TACTCGCTGCCCTGGACC-3′,KCNG1下游5′-AAGGTCAGGATAGTGCCGAAG-3′;β-肌動(dòng)蛋白上游5′-TCAAGATCATTGCTCCTCCTGAG-3′,β-肌動(dòng)蛋白下游5′-ACATCTGCTGGAAGGTGGACA-3′。通過(guò)2-ΔΔCt方法計(jì)算目的mRNA相對(duì)表達(dá)水平。
1.2.4 蛋白免疫印跡檢測(cè)KCNG1蛋白表達(dá)水平 將處于對(duì)數(shù)生長(zhǎng)期的細(xì)胞接種于6孔板(每孔1×106個(gè)),待每孔細(xì)胞融合率達(dá)90%時(shí),PBS清洗2次;加入蛋白裂解液,并置于冰上裂解15 min;于4 ℃行12 000 r/min離心15 min;取上清液,行BCA蛋白定量;100 ℃變性失活8 min。10% SDS-PAGE 80 V電泳120 min至不同分子量的蛋白完全分離;300 mA轉(zhuǎn)膜90 min,將蛋白轉(zhuǎn)至PVDF膜;10%脫脂牛奶封閉2 h;加入兔抗人KCNG1抗體(1 ∶2 000稀釋)及兔抗人GAPDH抗體(1 ∶3 000稀釋),4 ℃孵育過(guò)夜;TBST洗膜3次,每次6 min;加入二抗羊抗兔IgG(1 ∶4 000稀釋)室溫孵育2 h;TBST洗膜3次;添加ECL于凝膠成像儀曝光,用Image J軟件進(jìn)行灰度值量化分析。
1.2.5 EdU細(xì)胞增殖實(shí)驗(yàn)檢測(cè)細(xì)胞增殖能力 將轉(zhuǎn)染siRNA后的A549、H1299細(xì)胞及其對(duì)照組細(xì)胞分別接種至24孔板中(每孔2×104個(gè)細(xì)胞),孵育24 h;采用EdU細(xì)胞增殖試劑盒對(duì)細(xì)胞進(jìn)行染色。在熒光顯微鏡下隨機(jī)選擇3個(gè)細(xì)胞視野并拍照,計(jì)算平均EdU陽(yáng)性核比率。
1.2.6 Transwell及Matrigel Transwell實(shí)驗(yàn)檢測(cè)細(xì)胞遷移和侵襲能力 Transwell及Matrigel Transwell實(shí)驗(yàn)均采用8 μm孔徑的嵌入小室。分別將轉(zhuǎn)染siRNA后的A549和H1299及其對(duì)照組細(xì)胞以空白培養(yǎng)液重懸,以每孔3.5×104個(gè)細(xì)胞密度接種于上室中(Matrigel Transwell實(shí)驗(yàn)需要在小室上側(cè)預(yù)先包被基質(zhì)膠),下室加入0.6 mL含20%胎牛血清的F-12K培養(yǎng)液,置于細(xì)胞培養(yǎng)箱內(nèi)孵育24 h;用棉簽刮取小室上表面細(xì)胞,而小室下側(cè)細(xì)胞用4%多聚甲醛固定15 min;2.5%結(jié)晶紫染色30 min;倒置顯微鏡觀察,隨機(jī)選擇3個(gè)區(qū)域拍照并進(jìn)行細(xì)胞計(jì)數(shù)。
1.2.7 劃痕愈合實(shí)驗(yàn)檢測(cè)細(xì)胞遷移能力 分別將轉(zhuǎn)染siRNA后的A549和H1299及其對(duì)照組細(xì)胞接種于6孔板中(每孔約4×105個(gè)細(xì)胞),當(dāng)每孔細(xì)胞融合度達(dá)90%左右時(shí),用相同規(guī)格(20 μL)的移液槍槍頭在孔內(nèi)劃直線;PBS清洗2遍;加入空白培養(yǎng)液繼續(xù)培養(yǎng)24 h;顯微鏡下觀察并拍照,通過(guò)計(jì)算0 h及24 h的劃痕面積,比較不同組劃痕愈合情況。
1.2.8 血管生成擬態(tài)實(shí)驗(yàn)檢測(cè)細(xì)胞成管能力 采用血管生成擬態(tài)實(shí)驗(yàn)試劑盒,在下室中加入10 μL Matrigel基質(zhì)膠,分別將轉(zhuǎn)染siRNA后的A549及其對(duì)照組細(xì)胞接種于上室(每室含2×104個(gè)細(xì)胞),于37 ℃含5% CO2的細(xì)胞培養(yǎng)箱中孵育18 h;顯微鏡下觀察并拍照,比較不同組細(xì)胞成管的數(shù)量。
1.3 統(tǒng)計(jì)分析
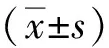
2 結(jié)果
2.1 KCNG1 mRNA在肺癌組織中的相對(duì)表達(dá)水平
基于TCGA數(shù)據(jù)庫(kù)共獲得1 145份未配對(duì)組織樣本(108例癌旁組織,1 037例肺癌組織)和212例配對(duì)樣本(106例癌旁組織,106例肺癌組織),如圖1所示,KCNG1mRNA在肺癌組織中的相對(duì)表達(dá)水平顯著高于癌旁組織(P均<0.001)。

A:非配對(duì)樣本;B:配對(duì)樣本
2.2 KCNG1 mRNA相對(duì)表達(dá)水平與肺癌患者臨床病理特征之間的相關(guān)性
基于TCGA數(shù)據(jù)庫(kù)分析KCNG1mRNA高表達(dá)和低表達(dá)患者之間臨床特征的差異,剔除重復(fù)樣本后,共納入609例肺癌患者,如表1所示。結(jié)果顯示KCNG1mRNA相對(duì)表達(dá)水平與肺癌患者N和M分期、病理學(xué)分級(jí)、性別、年齡及吸煙史臨床特征相關(guān)(P均<0.05)。

表1 KCNG1 mRNA相對(duì)表達(dá)水平與肺癌患者一般臨床特征間的關(guān)系
2.3 KCNG1 mRNA過(guò)表達(dá)與肺癌患者預(yù)后相關(guān)
如圖2所示,與KCNG1mRNA低表達(dá)肺癌患者相比,KCNG1mRNA高表達(dá)肺癌患者總生存期明顯縮短(圖3A,HR=1.23,95%CI:1.01~1.50,P=0.037)。此外在T1期、M1期、病理Ⅳ期、疾病進(jìn)展(PD)和疾病穩(wěn)定(SD)期、部分緩解(PR)和疾病完全緩解(CR)期、女性、吸煙史>40年的肺癌患者中,與KCNG1mRNA低表達(dá)肺癌患者相比,KCNG1mRNA高表達(dá)患者總生存期明顯縮短(P均<0.05),提示KCNG1mRNA高表達(dá)與肺癌患者不良預(yù)后相關(guān)。

圖2 KCNG1 mRNA高表達(dá)與低表達(dá)肺癌患者總體生存期比較

A:肺癌患者不良預(yù)后的單因素Cox回歸分析;B:肺癌患者不良預(yù)后的多因素Cox回歸分析;C:預(yù)測(cè)肺癌患者生存率的列線圖模型;D:列線圖模型的校準(zhǔn)曲線;E:受試者工作特征(ROC)曲線評(píng)價(jià)KCNG1在肺癌中的預(yù)測(cè)價(jià)值
2.4 基于KCNG1 mRNA表達(dá)水平構(gòu)建肺癌患者列線圖模型
單因素Cox回歸分析顯示,T分期、N分期、M分期、初始治療臨床結(jié)局、年齡以及KCNG1mRNA相對(duì)表達(dá)水平與肺癌患者的不良預(yù)后相關(guān)(圖3A,P均<0.05);進(jìn)一步Cox多因素回歸分析結(jié)果顯示,KCNG1mRNA相對(duì)表達(dá)水平是影響肺癌患者預(yù)后的獨(dú)立因素(圖3B,HR=1.427,95%CI:1.079~1.887,P=0.013)。據(jù)此,納入影響肺癌患者預(yù)后的獨(dú)立變量并構(gòu)建預(yù)測(cè)肺癌患者預(yù)后的列線圖模型(圖3C)。對(duì)預(yù)測(cè)模型進(jìn)行校正曲線的驗(yàn)證,結(jié)果顯示校正曲線接近理論的45°對(duì)角線,證實(shí)預(yù)測(cè)模型具有良好的預(yù)測(cè)效能(圖3D);同時(shí)診斷性ROC曲線也提示KCNG1mRNA相對(duì)表達(dá)水平在肺癌患者中具有良好的預(yù)后評(píng)估價(jià)值(圖3E)。
2.5 KCNG1相關(guān)差異表達(dá)基因及共表達(dá)基因的分析
差異基因分析共得到3 906個(gè)KCNG1相關(guān)差異表達(dá)基因,其中包括1 692個(gè)上調(diào)基因和2 214個(gè)下調(diào)基因,如火山圖4A所示。熱圖4B顯示與KCNG1表達(dá)密切相關(guān)的基因,其中包含10個(gè)正相關(guān)基因和10個(gè)負(fù)相關(guān)基因。見(jiàn)圖4。

FPKM:每千個(gè)堿基的轉(zhuǎn)錄每百萬(wàn)次映射讀取的片段數(shù);A:火山圖顯示與KCNG1相關(guān)的差異表達(dá)基因;B:熱圖顯示與KCNG1表達(dá)正相關(guān)的前10個(gè)基因;C:熱圖顯示與KCNG1表達(dá)負(fù)相關(guān)的前10個(gè)基因
2.6 KCNG1生物學(xué)功能分析
GO分析結(jié)果表明,與KCNG1相關(guān)的差異表達(dá)基因主要富集在調(diào)節(jié)激素分泌、離子轉(zhuǎn)運(yùn)、神經(jīng)肽信號(hào)和細(xì)胞間黏附等生物學(xué)過(guò)程中(圖5A);此外,這些差異表達(dá)基因主要富集在突觸后膜、細(xì)胞外基質(zhì)、頂端質(zhì)膜等部分(圖5B);在分子功能上,這些差異表達(dá)基因主要富集在氧化還原酶活性、神經(jīng)遞質(zhì)轉(zhuǎn)運(yùn)體活性、金屬離子跨膜轉(zhuǎn)運(yùn)體活性、絲氨酸型內(nèi)肽酶抑制劑活性等(圖5C);KEGG富集分析提示神經(jīng)活性配體與受體的相互作用、雌激素信號(hào)通路、細(xì)胞色素P450代謝、化學(xué)致癌和PPAR信號(hào)通路與KCNG1相關(guān)差異表達(dá)基因的表達(dá)密切相關(guān)(圖5D)。
2.7 GSEA預(yù)測(cè)相關(guān)信號(hào)通路
GSEA預(yù)測(cè)結(jié)果顯示,與KCNG1協(xié)同高表達(dá)基因主要富集在與腫瘤增殖和凋亡以及免疫反應(yīng)等相關(guān)的通路,包括KRAS、mTORC1、MYC、P53和WNT信號(hào)通路(圖6)。因此,KCNG1可能在腫瘤增殖、血管生成、凋亡及免疫反應(yīng)等過(guò)程中發(fā)揮調(diào)控作用,從而促進(jìn)肺癌的發(fā)生發(fā)展。
2.8 KCNG1 mRNA和蛋白在肺癌細(xì)胞中高表達(dá)
qRT-PCR結(jié)果提示,肺癌A549及H1299細(xì)胞系中KCNG1mRNA相對(duì)表達(dá)水平明顯高于正常肺泡上皮細(xì)胞(P<0.01或<0.001);蛋白免疫印跡結(jié)果顯示,肺癌A549及H1299細(xì)胞系中KCNG1蛋白表達(dá)水平明顯高于正常肺泡上皮細(xì)胞(P<0.01)。見(jiàn)圖7。由此表明,KCNG1mRNA和蛋白在肺癌細(xì)胞中表達(dá)上調(diào)。

**:P<0.01,***:P<0.001,與肺泡上皮細(xì)胞比較;A:qRT-PCR實(shí)驗(yàn)檢測(cè)KCNG1 mRNA相對(duì)表達(dá)量;B:蛋白免疫印跡實(shí)驗(yàn)檢測(cè)KCNG1蛋白相對(duì)表達(dá)量
2.9 KCNG1敲低抑制肺癌細(xì)胞的增殖能力
蛋白免疫印跡結(jié)果顯示,與對(duì)照組相比,KCNG1敲低組1以及KCNG1敲低組2肺癌A549細(xì)胞中KCNG1蛋白表達(dá)水平明顯降低(P<0.01或<0.001),充分驗(yàn)證了siRNA轉(zhuǎn)染效率。EdU染色結(jié)果顯示,與對(duì)照組相比,肺癌A549及H1299細(xì)胞系KCNG1敲低組1和KCNG1敲低組2 EdU陽(yáng)性核比率明顯降低(A549細(xì)胞:t=6.554,5.468,P均<0.01;H1299細(xì)胞:t=7.057,4.585,P<0.01或<0.05),見(jiàn)圖8。由此提示,siRNA干擾KCNG1表達(dá)后,肺癌細(xì)胞增殖能力下降。

*:P<0.05,**:P<0.01,***:P<0.001,與對(duì)照組相比;A:蛋白免疫印跡檢測(cè)KCNG1蛋白相對(duì)表達(dá)水平;B:EdU實(shí)驗(yàn)檢測(cè)A549細(xì)胞增殖能力(×100);C:EdU實(shí)驗(yàn)檢測(cè)H1299細(xì)胞增殖能力(×100)
2.10 KCNG1敲低抑制肺癌細(xì)胞的遷移能力
如圖9所示,與對(duì)照組相比,肺癌A549及H1299細(xì)胞系KCNG1敲低組1和KCNG1敲低組2細(xì)胞劃痕愈合能力明顯下降(A549細(xì)胞:t=5.397,3.697,P<0.01或<0.05;H1299細(xì)胞:t=8.434,5.936,P均<0.01)。Transwell實(shí)驗(yàn)結(jié)果顯示,與對(duì)照組相比,肺癌A549及H1299細(xì)胞系KCNG1敲低組1和KCNG1敲低組2遷移細(xì)胞數(shù)明顯減少(A549細(xì)胞:t=7.387,4.364,P<0.01或<0.05;H1299細(xì)胞:t=9.849,7.603,P<0.01或<0.001)。由此提示,下調(diào)KCNG1表達(dá)水平可抑制肺癌細(xì)胞的遷移能力。

*:P<0.05,**:P<0.01,***:P<0.001,與對(duì)照組相比;A:劃痕愈合實(shí)驗(yàn)檢測(cè)A549細(xì)胞遷移能力(×40);B:劃痕愈合實(shí)驗(yàn)檢測(cè)H1299細(xì)胞遷移能力(×40);C:Transwell實(shí)驗(yàn)檢測(cè)A549細(xì)胞遷移能力(×100);D:Transwell實(shí)驗(yàn)檢測(cè)H1299細(xì)胞遷移能力(×100)
2.11 KCNG1敲低抑制肺癌細(xì)胞的侵襲能力
Matrigel Transwell結(jié)果顯示,與對(duì)照組相比,肺癌A549及H1299細(xì)胞系KCNG1敲低組1和KCNG1敲低組2侵襲細(xì)胞數(shù)目均明顯減少(A549細(xì)胞:t=2.903,3.778,P均<0.05;H1299細(xì)胞:t=5.126,4.982,P均<0.01)。見(jiàn)圖10。由此表明,KCNG1表達(dá)水平下調(diào)抑制肺癌細(xì)胞的侵襲能力。

P<0.05,**:P<0.01,與對(duì)照組相比;A:Matrigel Transwell實(shí)驗(yàn)檢測(cè)A549細(xì)胞侵襲能力;B:Matrigel Transwell實(shí)驗(yàn)檢測(cè)H1299細(xì)胞侵襲能力
2.12 KCNG1敲低抑制肺癌細(xì)胞的擬態(tài)成管能力
如圖11所示,與對(duì)照組相比,KCNG1敲低組1和KCNG1敲低組2肺癌A549細(xì)胞成管數(shù)量明顯減少(t=2.982,3.693,P均<0.05)。由此表明,KCNG1敲低可抑制肺癌細(xì)胞的擬態(tài)成管能力。

*:P<0.05,與對(duì)照組相比
3 討論
目前肺癌仍是全世界癌癥相關(guān)死亡的主要原因[20],由于分子靶向治療的進(jìn)展,目前肺癌治療效果有所提高[21]。生物信息學(xué)分析為基因在腫瘤學(xué)研究過(guò)程中提供了具體的方向[22],本文通過(guò)生物信息學(xué)獲取并分析了1 145例肺癌及癌旁組織的高通量測(cè)序數(shù)據(jù),結(jié)果發(fā)現(xiàn)KCNG1mRNA在肺癌組織中表達(dá)水平顯著增高,且KCNG1mRNA高表達(dá)與肺癌患者的N和M分期等臨床病理特征密切相關(guān)。在此基礎(chǔ)上通過(guò)回歸分析進(jìn)一步證實(shí)KCNG1可作為預(yù)測(cè)肺癌患者預(yù)后的獨(dú)立因素。初步證實(shí)KCNG1在肺癌發(fā)生發(fā)展中具有潛在的生物學(xué)功能。
有研究證實(shí),多種鉀通道蛋白的異常表達(dá)參與肺癌的發(fā)生發(fā)展,Song等[23]發(fā)現(xiàn)kv3.1和kv3.4的異常高表達(dá)參與調(diào)控細(xì)胞的侵襲和轉(zhuǎn)移。Liu等[24]發(fā)現(xiàn)敲低KCNJ2表達(dá)后可通過(guò)miR-7和Ras/MAPK信號(hào)通路減弱非小細(xì)胞肺癌的耐藥性。本研究通過(guò)體外轉(zhuǎn)染siRNA肺癌A549細(xì)胞以及H1299細(xì)胞,干擾KCNG1表達(dá)水平后,顯著抑制其增殖、遷移、侵襲能力。基于已有研究,本研究未在H1299細(xì)胞中檢測(cè)成管能力,只在肺癌A549細(xì)胞中轉(zhuǎn)染siRNA,其成管能力明顯下降。由此表明,KCNG1在肺癌的惡性進(jìn)展中發(fā)揮重要作用。多種促癌分子信號(hào)的異常表達(dá)和活化是肺癌發(fā)生、浸潤(rùn)、轉(zhuǎn)移和耐藥的主要原因[25],其中包括Wnt,mTOR,MAPK以及P53等信號(hào)通路[26-29]。本研究基于TCGA數(shù)據(jù)庫(kù),通過(guò)富集分析發(fā)現(xiàn)KCNG1相關(guān)的差異表達(dá)基因可能參與調(diào)控KRAS通路、MTORC1通路、MYC通路和WNT通路等。其中,KRAS位點(diǎn)突變是腫瘤發(fā)生發(fā)展的最重要的驅(qū)動(dòng)因素之一,有1/3肺癌患者存在KRAS位點(diǎn)突變[30-32]。既往研究報(bào)道,KRAS主要通過(guò)參與調(diào)控MAPK,RAF和MEK等下游信號(hào)分子促進(jìn)肺癌的進(jìn)展[33-35]。因此,KCNG1高表達(dá)可能通過(guò)促進(jìn)KRAS等相關(guān)促癌信號(hào)通路的活化,進(jìn)而促進(jìn)肺癌的惡性進(jìn)展。然而,KCNG1在肺癌中高表達(dá)的主要分子機(jī)制以及其高表達(dá)與下游促癌信號(hào)活化之間的聯(lián)系有待進(jìn)一步探究。
綜上所述,KCNG1在肺癌中顯著高表達(dá)并與患者不良預(yù)后密切相關(guān),干擾其表達(dá)水平可抑制肺癌細(xì)胞的惡性生長(zhǎng),初步提示KCNG1異常高表達(dá)參與肺癌的進(jìn)展,這可能與KCNG1調(diào)控多種促癌信號(hào)通路的活化密切相關(guān)。本研究目前只通過(guò)生物信息學(xué)分析及體外細(xì)胞學(xué)實(shí)驗(yàn)探討了KCNG1對(duì)肺癌進(jìn)展的作用機(jī)制,也僅在A549細(xì)胞中檢測(cè)了成管能力的變化,未能在更多的肺癌細(xì)胞中檢測(cè)增殖、遷移、成管等行為學(xué)的變化,還缺乏動(dòng)物體內(nèi)實(shí)驗(yàn)的驗(yàn)證,后續(xù)有待進(jìn)一步完善。

