內鏡黏膜下剝離術治療39例大腸側向發育型腫瘤的臨床療效分析
黃福林,林佐光,楊 勇
(高州市人民醫院消化內科,廣東 高州 525200)
大 腸 側 向 發 育 型 腫 瘤(Laterally spreading tumor,LST)是結直腸的一種特殊平坦型病變,直徑>10 mm,傾向于沿腸壁側向生長或環腸壁生長,而不是向腸壁深部垂直生長[1]。LST 具有多種不同的病理類型,其惡性程度高達11.5%,如果未得到及時處理,會在幾年之內發展成大腸癌。內鏡下黏膜切除術(Endoscopic mucosal resection,EMR)可 有 效 切除病變,但對于直徑大于2 cm 的LST,EMR 術中多采用分片式切除,易造成病變殘留和復發,增加患者的心理和經濟負擔[2]。陳靜等[3]研究指出,內鏡黏膜下 剝 離 術(Endoscopic submucosal dissection,ESD)治療早期結直腸癌及其癌前病變安全、有效、微創,具有廣闊的臨床應用前景。對于LST,由于ESD 操作難度大、風險高,故臨床上特別是基層醫院尚未得以推廣。本研究旨在探討ESD 治療直徑大于20 mm的LST 的有效性及安全性,現報道如下。
1 資料和方法
1.1 病例資料
選擇39 例行ESD 的LST 患者納入本研究,納入時間2020 年1 月至2022 年12 月,病例均來自高州市人民醫院。對所有患者進行分類,分類標準為內鏡下形態,主要類型有混合結節型、假凹陷型、顆粒均一型、平坦隆起型等;采用0.4% 靛胭脂染色確定病灶的大小、邊界等。所有患者均行擇期手術,術前檢查凝血功能、心肺功能等未發現異常;術前1 周內均未使用抗凝藥物(如氯吡格雷、阿司匹林、替格瑞洛、華法林)。術前全面告知患者有關手術的益處與弊端,患者了解并簽署同意書。本次研究經醫院倫理委員會審批。
1.2 器械和材料
主要器械有日本奧林巴斯電子結腸鏡CF-H290I,奧林巴斯雙焦點電子胃鏡GIF-HQ290,一次性黏膜切開刀(DualKnife)KD-650Q,日本奧林巴斯一次性高頻止血鉗FD-410LR,德國Erbe 愛爾博高頻手術系統VIO300S,南微醫學一次性內窺鏡用注射針(22 G、5 mm、2300 mm),南微醫學可旋轉重復開閉軟組織夾,南微醫學0.2% 靛胭脂黏膜染色劑,1:10 000 腎上腺素生理鹽水,玻璃酸鈉,甘油果糖,復方聚乙二醇電解質散(和爽),二甲硅油散(健亨)等。
1.3 術前準備
在手術前1 d,進食少渣的食物,手術當天清晨以復合PEG 電解質散(深圳萬和醫藥有限公司,國藥準字H20030828,規格:137.15 g/ 包)清潔腸道,每次2 包,隨后再服用消泡劑二甲硅油散(自貢鴻鶴醫藥有限公司,國藥準字H51023869,規格:2.5 g/包),清除腸壁上的氣泡。行腸鏡檢查,以南微醫藥0.2%靛胭脂作為黏膜著色劑,觀察確定病灶的大小、邊緣,通過超聲內窺鏡觀察病灶周圍淋巴結的情況(見圖1)。

圖1 A :普通腸鏡下距肛門約5 cm 直腸見一個大小約3.5 cm×3.0 cm 的混合結節型LST;B :水中LST-ME+NBI 顯示呈Pit Pattern Ⅳ型;C :超聲內鏡見病變主要累及黏膜層,未侵犯固有肌層,周邊未見淋巴結腫大
1.4 手術方法
丙泊酚靜脈注射全身麻醉后,常規行腸鏡檢查尋找病變,以靛胭脂染色確定病變邊界,在病變切緣外2 ~5 mm 處用Dual 刀對切除區域進行標記,然后在病變切緣標記點的外側行多點黏膜下注射,每次注入含有少量靛胭脂的1:10 000 腎上腺素生理鹽水,直到病變充分隆起。用Dual 刀將病變的外側緣黏膜切開,順著病灶的邊緣標記點外側2 mm 環周切開,然后用Dual 刀對黏膜下層進行剝離,使病變與固有肌層分離,交替開展注射操作與剝離操作,如黏液墊消失太快,可使用玻璃酸鈉或甘油果糖黏膜下注射,最后將病變整體剝離下來。術中出血通過止血鉗強力電凝或軟凝方法止血,術后軟凝處理創面裸露的血管,如有必要,可用金屬夾將創面夾閉。切除標本用鹽水清洗表面黏液,展開后用大頭針固定,之后將標本浸泡在4%的福爾馬林中再送病理科進行檢查。術中相關操作見圖2。
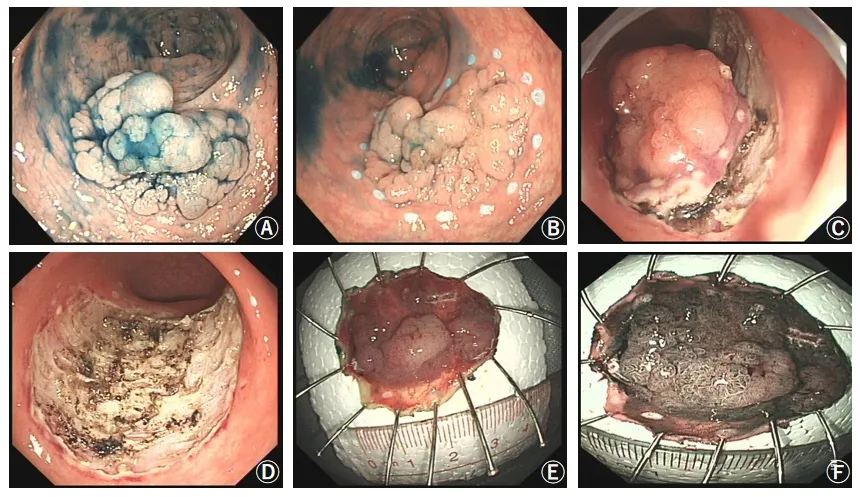
圖2 A:0.4%靛胭脂染色后的LST;B:用Dual 刀行環周標記;C:用Dual 刀剝離;D:剝離后的創面;E:將剝離的標本展開固定;F:剝離的標本經窄帶內鏡(NBI)觀察
1.5 術后處理及隨訪
手術結束后需要禁食24 ~72 h,預防性使用抗生素、止血藥,合理補液,并視患者的情況逐漸恢復正常飲食,同時要注意患者的腹部體征、癥狀和糞便性狀。如果患者術后出現血便或黑色便,提示發生遲發性出血;如果術后腹部平片和CT 檢查顯示膈下有空氣,則提示發生遲發性穿孔。若患者術后出現出血、穿孔、感染等并發癥,應給予禁食和胃腸減壓,合理補液,使用頭孢哌酮舒巴坦等藥物進行抗感染治療。若有必要,可在內鏡的輔助下使用鈦夾夾閉出血點或穿孔部位,或轉至胃腸外科進行手術治療。手術結束后3 ~12 個月通過電話和門診隨訪的方式對患者進行隨訪,定期進行腸鏡復查。
2 結果
2.1 臨床資料
納入研究的39 例LST 患者中,顆粒型26 例,非顆粒型13 例,內鏡下結節混合型所占比例最高,達48.7%(19/39),假凹陷型所占比例最低,僅占7.7%(3/39)。腫瘤直徑20 ~85 mm,平均31.8 mm。病灶分布于直腸者最多,直腸27 例(69.2%)、升結腸6例(15.4%)、乙狀結腸3 例(7.7%)、橫結腸2 例(5.1%)、降結腸1 例(2.6%)。
2.2 ESD 手術情況
39 例患者的手術操作時間為75 ~375 min,中位時間為142min。切除病灶直徑為20 ~85 mm,平均31.8 mm。其中1 例因外院取病理組織后形成多處潰瘍灶,瘢痕粘連后抬舉征陰性,未能完整切除,3個月后到外科行手術切除,術后病理示:(直腸)管狀腺瘤伴低級別上皮內瘤變。整塊切除率為97.4%(38/39)。術后病理分型:單純腺瘤14 例、低級別瘤變9 例、高級別瘤變12 例、癌變4 例。其中1 例乳頭狀腺瘤、腺癌累及蒂部組織,患者未同意外科手術補救,術后3 個月、1 年、2 年復查腸鏡均未見復發;1 例管狀絨毛狀腺瘤,局灶癌變- 高分化腺癌,并累及基底部局灶組織,追加外科手術切除,術后病理示(直腸)腸腫物切除術后,本次送檢病灶全檢未見癌殘留;送檢(淋巴結)及檢取腸周淋巴結均未見轉移癌,分別為(0/8、0/6),兩切緣干凈。1 例(直腸)管狀腺瘤,伴癌變- 高分化腺癌,蒂未見累及。1 例絨毛管狀腺瘤,黏膜腺體重度異型增生、癌變,黏膜內中分化腺癌,周圍切緣及基底切緣均未見癌。此2 例患者術后1 個月、半年、1 年復查腸鏡均未見復發。治愈性切除率為92.3%(36/39)。
2.3 并發癥
術中出血及小穿孔均予電凝止血、鈦夾荷包縫合閉合創面處理。1 例為直腸全周型病變,大小約85 mm×53 mm,術后第2 d 出現腹痛、腹脹、發熱,行CT 檢查發現膈下游離氣體、腹膜炎,經禁食、胃腸減壓、頭孢哌酮舒巴坦抗感染、補液保守治療后1周康復出院,出院后不久出現大便細條難排,3 個月后復查腸鏡示直腸狹窄、無法過鏡(見圖3),后到肛腸外科行直腸狹窄放射狀切開術治療,治療后能通過3 指,癥狀緩解。39 例患者術后感染發生率為2.6%(1/39),穿孔發生率為2.6%(1/39),直腸狹窄發生率為2.6%(1/39),無遲發性出血病例。

圖3 ESD 術后3 個月出現直腸狹窄病例
2.4 隨訪情況
術后隨訪3 ~36 個月,1 例患者出院后不久出現大便細條難排,3 個月后復查腸鏡示直腸狹窄、無法過鏡,后到肛腸外科行直腸狹窄放射狀切開術治療,治療后能通過3 指,癥狀緩解。其他患者復查腸鏡均顯示創面愈合良好,無腫瘤局部復發和遠處轉移病例。
3 討論
LST 是指直徑大于10 mm、腫瘤橫向生長的表面平坦型腫瘤,具有很高的癌變危險,如果未得到及時處理,會在幾年之內發展成大腸癌。因此,為了防止LST 進展到結腸癌,需要對LST 進行早期處理[4]。EMR 是以往治療LST 最常用的術式,但EMR 受限于病變范圍,對于直徑大于20 mm 的病灶需要采用分片手術,由于不能獲得全面的病理樣本,因此常導致術后殘留及復發率高[5]。最近幾年,在LST 的治療中,已逐步采用了ESD,該手術是在內鏡下對病灶的切緣外側進行標記和切開,然后將病灶完整剝離下來,不會受到病灶大小的影響,可以一次完成對病灶的徹底切除,能有效克服EMR 的缺陷,并且其完整切除率很高,術后病灶殘余很少,從而可大大降低患者術后病情的復發率[6]。對于LST,一般不建議進行活檢送病理檢查,一是因為組織活檢無法反映病變的整體情況,二是在活檢后容易對病變組織產生破壞,從而引起黏膜下層和肌肉層之間的粘連。在本組病例中,有1 例患者因為在外院行活檢后發現了多個潰瘍灶,瘢痕粘連后抬舉征為陰性,因此沒有能夠完整切除,在3 個月后到外科進行了手術切除。
LST 的惡性度高達11.5%,其癌變后易進一步向深層侵襲,對本病侵襲深度的判斷是ESD 手術中最為關鍵的一步,精確的判斷是決定手術成功與否的關鍵。常見的檢查方式為:(1)充吸氣變形試驗:先向腸腔內充氣,讓病變充分展開,再吸氣,若病變形狀發生凹陷樣變化,就可以初步判定腫瘤沒有浸潤到黏膜下,若病變形狀不變,就說明腫瘤已浸潤到黏膜下全層或更深,此乃外科手術的指征。(2)抬舉征陽性(lifting sign):向病變黏膜下注入生理鹽水后,若病變黏膜能充分隆起,可以完全與固有肌層分離,則為抬舉征陽性,此時可用EMR、ESD 等手段將病變切除;對于無法隆起或隆起不良的病灶,說明腫瘤組織已經浸潤至固有肌層,不能應用EMR 或ESD 將病灶切除。(3)使用染色放大內鏡技術,醫師可以根據Pit Pattern 分型結果,對結直腸側向發育型腫瘤進行良惡性判斷,這對于大腸癌的早期診斷非常有用,并為大腸癌的治療提供了一個參考依據[7]。(4)使用超聲內鏡對腫瘤的浸潤深度進行檢查和判斷。
ESD 是一種新興的、高效的內鏡微創技術,但由于其操作難度大,并且有很高的手術風險,因此在臨床上尤其是基層醫院并未得到普及。ESD 技術的學習是一個循序漸進的過程,需要嫻熟的內鏡技術功底,并經系統的進修學習考核后才能開展,早期可先開展胃的ESD,在達到一定手術數量后再進行腸道的ESD。對于巨大病變,特別是全周型側向發育型腫瘤,術中出血、肌層損傷穿孔及術后感染的發生率大大增加,且全周切除后易出現直腸狹窄。本組病例中1 例患者術后發生直腸狹窄,同時出現穿孔、急性腹膜炎及直腸狹窄3 種并發癥。袁媛等[8]研究指出,采用玻璃酸鈉、生理鹽水和靛胭脂配制的混合液予黏膜下注射后行ESD 治療效果佳,安全性高。早期開展ESD治療時,可先使用玻璃酸鈉、甘油果糖行黏膜下注射,這樣黏液墊不易消失,可減少注射次數,利于ESD 操作,縮短手術時間,減少手術并發癥的發生。黃思霖[9]報道的使用雙隧道黏膜下剝離術治療直腸環周型側向發育型腫瘤的單中心研究中,有66.7%(4/6)的患者發生了直腸狹窄,這種改進型黏膜下剝離術的直腸狹窄并發癥的發生率較低。
既往研究已證實ESD 可安全有效地治療結直腸病變,實現整塊切除及完全切除的患者可獲得良好的長期預后[10]。本組所有病例均行ESD 治療,整塊切除率為97.4%(38/39),治愈性切除率為92.3%(36/39);術后感染發生率為2.6%(1/39),穿孔發生率2.6%(1/39),直腸狹窄發生率為2.6%(1/39),無遲發性出血病例,術后3 ~36 個月復查腸鏡顯示,創面愈合良好,無復發病例。表明ESD 治療直徑大于20 mm 的LST 是安全、有效、微創的,值得臨床推廣。

