前列腺癌進展相關轉錄因子研究
孫傳玉 趙曉君 葛圣陽 張 揚
(1.復旦大學附屬華山醫院,上海 200040;2.上海市臨床檢驗中心,上海 200126;3.復旦大學生物醫學研究院,上海 200032)
前列腺癌是泌尿外科常見的腫瘤,也是男性常見的惡性腫瘤類型之一[1],其發病率近年來呈上升趨勢[2]。據估計,全球每年新發病前列腺癌病例141.4萬,死亡人數超過37.5萬;2020年,我國前列腺癌發病率約為15.6/10萬人,死亡率為6.9/10萬[3]。雖然前列腺癌的病情進展相對緩慢,且根治性治療對早期和局限性前列腺癌有良好的療效,但很多前列腺癌患者在確診時已處于晚期,只能進行內分泌治療[4]。在經過內分泌治療后,多數患者會進一步發展為去勢抵抗性前列腺癌(castration-resistant prostate cancer,CRPC),CRPC對化療、放療均不敏感,缺乏有效的臨床治療方法,且有轉移傾向,預后不良[5]。前列腺癌的發生和發展是個復雜的過程,涉及體內各種因子的相互作用,轉錄因子在其中扮演著重要角色。轉錄因子是一種與啟動子調控元件結合以激活/抑制下游基因表達的核蛋白,調節轉錄過程中的各個步驟,因此轉錄因子是基因轉錄調控重要的組成部分之一[6]。有研究結果顯示,轉錄因子參與了血管的形成過程和細胞的凋亡調控,通過調控癌基因、抑癌基因和細胞周期相關分子等影響細胞的增殖和腫瘤的生長、侵襲、轉移[7-8]。轉錄調控網絡(transcriptional regulatory network,TRN)是指基因、調控因子及其相互作用的集合,主要用于研究轉錄因子與靶基因之間的調控,其中轉錄因子是TRN的關鍵調控因子[9]。SUN等[10]通過同位素標記相對和絕對定量技術(isobaric tags for relative and absolute quantitation,iTRAQ)結合二維液相色譜-串聯質譜(two-dimensional liquid chromatography with tandem mass spectrometry,2DLC-MS/MS)篩選出46個前列腺癌差異蛋白,其中表達上調20個、表達下調26個。在這些差異蛋白中,線粒體相關蛋白、細胞外基質蛋白等已被證實在前列腺癌發生、發展中發揮重要作用[11]。但這些差異蛋白之間的轉錄調控并不清楚。為此,本研究基于前期研究[10]結果,采用GeneGo MetaCore軟件對差異蛋白構建TRN,篩選顯著富集的轉錄因子,并采用IPA軟件進一步追溯轉錄因子的上游調控網絡,以闡明前列腺癌中轉錄因子與差異表達蛋白之間的整體調控和相互作用,進而了解前列腺癌的分子發病機制,尋找有效治療的潛在靶點,為前列腺癌的早期診斷和有效治療提供新的思路。
1 材料和方法
1.1 研究對象
選取復旦大學附屬華山醫院因總前列腺特異性抗原(prostate-specific antigen,PSA)>10 ng/mL或直腸指檢發現異常結節,接受“10+X”前列腺穿刺活檢的患者40例。根據病理學結果分為良性前列腺增生患者20例[良性增生組,年齡(67.5±8.8)歲]和前列腺癌患者20例[前列腺癌組,年齡(70.5±10.6)歲]。2個組之間年齡差異無統計學意義(P<0.05)。
1.2 方法
采用GeneGo MetaCore軟件中的轉錄調控網絡算法對前期研究[10]篩選出的46個差異表達蛋白進行生物信息學分析,46個差異表達蛋白見表1、表2。根據網絡得分對結果進行排序,獲取前30位富集度最高的網絡中的轉錄因子。通過文獻篩選出與腫瘤密切相關的轉錄因子。利用IPA軟件中的UpstreamRegulator功能獲得轉錄因子的上游調節子。

表1 表達上調的前列腺癌差異表達蛋白[10]
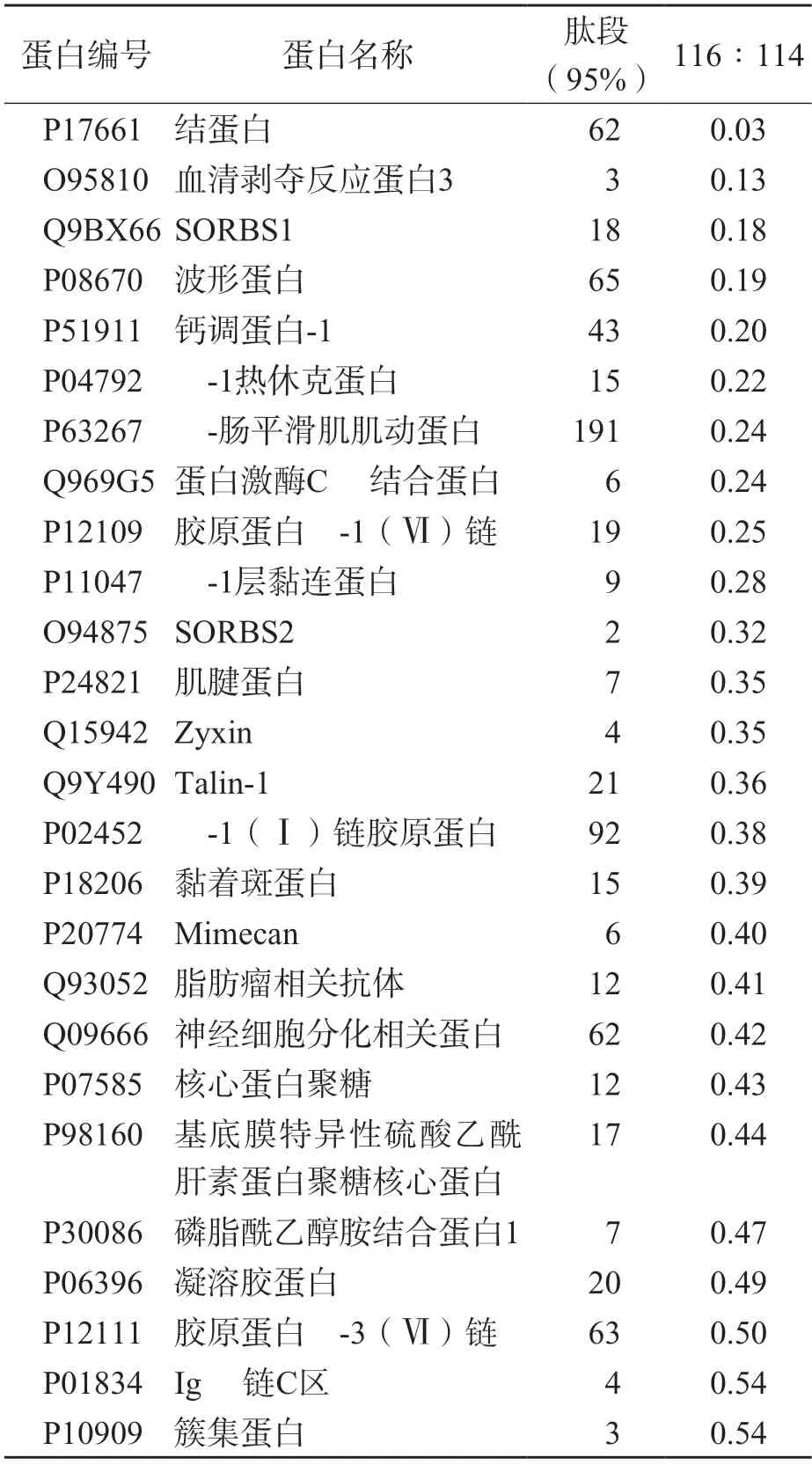
表2 表達下調的前列腺癌差異表達蛋白[10]
2 結果
2.1 差異表達蛋白的TRN分析
采用GeneGo MetaCore軟件中的轉錄調控算法對46個差異表達蛋白進行分析,得出了30個轉錄因子靶模型網絡和20個TRN。按差異表達蛋白的富集度進行排序,居前6位的TRN分別由特化蛋白1(specificity protein 1,SP1)、p53、陰陽1(Yin Yang-1,YY1)、雄激素受體(androgen receptor,AR)、c-Myc和Slug調控,見表3。46個差異表達蛋白中有18個參與SP1的調控,10個參與p53的調控,9個參與YY1的調控,7個參與AR的調控,7個參與c-Myc的調控。在以Slug為核心形成的TRN中,Slug與SP1、p53、AR等轉錄因子相互作用,涉及氧化應激反應、細胞周期調控、凋亡調控等細胞活動,見圖1。

圖1 富集度最高的6個轉錄因子網絡

表3 SP1、p53、YY1、AR、c-Myc和Slug的GO①富集分析
2.2 差異表達的轉錄因子對前列腺癌患者的臨床意義。
采用GEPIA2數據庫(http://gepia2.cancerpku.cn/)分析SP1、p53、YY1、AR、c-Myc和Slug對前列腺癌患者生存情況的影響。Kaplan-Meier生存曲線分析結果顯示,高表達p53的前列腺癌患者無病生存期和總生存期均長于低表達p53的患者(P值分別為0.047、0.019),低表達AR的前列腺癌患者無病生存期長于高表達AR的患者(P=0.023),其他轉錄因子對前列腺癌預后無影響(P>0.05)。見圖2。
2.3 轉錄因子的上游調控網絡
采用IPA軟件構建SP1、p53、YY1、AR、c-Myc的上游調控網絡,結果顯示,表沒食子兒茶素沒食子酸酯(epigallocatechin gallate,EGCG)、蛋白激酶B(protein kinase B,PKB;又稱AKT)1、成纖維細胞生長因子2(fibroblast growth factor 2,FGF2)、β-雌二醇可能是SP1、p53、YY1、AR、c-Myc的上游調控因子。見圖3。
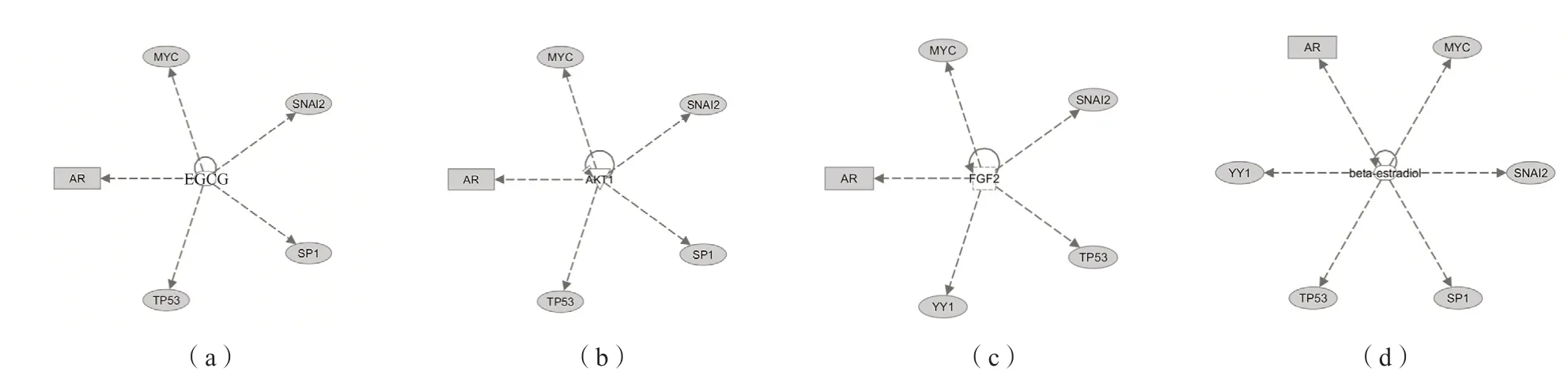
圖3 利用IPA對轉錄因子上游調節子進行追溯
3 討論
致癌基因和涉及多種信號通路的腫瘤抑制因子的功能變化與前列腺癌的轉移和耐藥有關。本研究基于生物信息學分析構建了前列腺癌差異表達蛋白相關的TRN,結果顯示,關鍵轉錄因子SP1、p53、YY1、AR、c-Myc和Slug在前列腺癌的發生、發展中發揮重要的作用,追蹤其上游調控因子,發現EGCG、AKT1、FGF2和β-雌二醇可對轉錄因子進行調控。
有研究發現,轉錄因子SP1不僅通過表皮生長因子受體(epidermal growth factor receptor,EGFR)/磷脂酰肌醇3-激酶(phosphoinositide-3-kinase,PI3K)/AKT、絲裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase,MAPKK;又稱MEK)/細胞外調節蛋白激酶1/2(extracellular regulated protein kinase 1/2,ERK1/2)等通路參與細胞增殖、分化等細胞內過程,還通過上皮型鈣黏蛋白(epithelial cadherin,E-Cad)、Wnt/β-連環蛋白等通路參與上皮-間質轉化(epithelial-mesenchymal transition,EMT)過程[12-13]。同時,由于SP1在前列腺癌中過表達,在非癌癥人體組織中相對低表達的特點,SP1可被作為重要的藥物靶點[14]。本研究結果顯示,共有18個差異表達蛋白參與了SP1的調控,涉及細胞組分轉移、細胞黏附調控、生物特性調控等,這說明SP1在前列腺癌的發生、發展過程中發揮重要作用,SP1是一個關鍵治療靶點和預后預測生物標志。
抑癌基因轉錄因子p53,又稱TP53,在DNA損傷或腫瘤發生時調控細胞周期和誘導細胞凋亡過程中起核心作用,p53的功能確實可能對50%的人類癌癥產生影響,低活性的p53與前列腺癌治療后的耐藥性相關[15]。在前列腺癌中,p53可通過雄激素介導Ras-GTP酶激活蛋白SH域結合蛋白2(GTPase-activating protein SH3-domain-binding protein,G3BP2)轉移到細胞質中發揮作用,G3BP2是雄激素受體的直接靶基因,能夠誘導細胞周期進程和阻斷細胞凋亡,降低p53的信號,從而在前列腺癌的發展和耐藥性產生中起重要作用[16]。p53還可以和ELL相關因子2(ELL-associated factor 2,EAF2)相互作用,失活的EAF2和p53可激活信號轉導及轉錄激活因子3(signal transducer and activator of transcription 3,STAT3),驅動前列腺癌的發生[17]。
轉錄因子YY1在轉錄調控中有雙向作用。在前列腺癌中,YY1是促進腫瘤前基因表達程序的關鍵致癌因子,并與較差的臨床預后相關[18]。YY1可以直接結合并激活血小板型磷酸果糖激酶(phosphofructokinase,platelet,PFKP)的致癌途徑,PFKP是一種編碼糖酵解限速酶的基因,可顯著促進前列腺癌中YY1強化的Warburg效應和惡性生長[19]。YY1還可以抑制前列腺癌細胞中的腫瘤抑制因子——X染色體連鎖腫瘤抑制相關因子-1(X-linked inhibitor of apoptosis-associated factor 1,XAF1)的表達,YY1與XAF1啟動子結合后,可通過組蛋白脫乙酰基酶(histone deacetylase 1,HDAC1)途徑抑制XAF1在前列腺癌細胞中的表達,促使前列腺癌的生長[20]。
AR是一種配體誘導轉錄因子,在維持正常前列腺上皮穩態中起重要作用,其中包括維持上皮分化和抑制細胞增殖,雄激素可通過刺激AR活性來控制轉錄[21]。由于大多數前列腺癌表達AR,即使是晚期前列腺癌也可以采用雄激素剝奪治療,雖然前列腺癌患者最初對雄激素剝奪療法有反應,但這些患者會逐漸發展為CRPC,這個過程通常需要30個月左右[22]。在由激素依賴性前列腺癌轉變為CRPC的過程中,AR也扮演了重要角色,即使在雄激素剝奪治療時,AR信號依舊通過多種機制持續傳遞,包括AR過表達、雄激素分泌增加和誘導產生結構活躍AR拼接變異體[23]。異常的AR信號是前列腺癌的常見特征,AR通路和PI3K/AKT/雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)已被證實通過幾個相互抑制環路進行交叉調節,PI3K/AKT/mTOR通路可能在響應雄激素/AR定向治療時被激活,這種代償性激活可以促使CRPC的生長,而PI3K/AKT/mTOR通路抑制可增強AR信號,導致前列腺癌的進展和產生耐藥性[24]。本研究AR調控網絡中的上、下游蛋白可以為后續研究提供思路。
原癌基因轉錄因子c-Myc在前列腺癌的早期過度表達,會誘導全面的代謝重編程,以支持癌細胞的生存和增殖,是前列腺癌發生、發展的關鍵驅動因子,并與前列腺癌的轉移性進展和不良預后密切相關[25]。c-Myc會與大量在前列腺癌中觀察到的基因改變和信號缺陷交織在一起,如TMPRSS2-ERG基因融合可增加c-Myc蛋白水平,PTEN/Trp53缺失是由c-Myc蛋白表達失調引起的[26]。本研究還發現,c-Myc調控GRP78、HSP60等7個差異表達蛋白,參與涉及抗凋亡、調控Caspase的活性等生物學途徑,說明c-Myc在前列腺癌的TRN中占有重要的地位。
在腫瘤的發生和發展過程中,各種轉錄調控網絡之間存在相互作用。本研究結果顯示,差異表達蛋白富集度最高的轉錄因子網絡是以Slug為核心的調控網絡,在此網絡中,SP1、p53、AR、ESR1與Slug轉錄調控網絡之間存在著相互作用。Slug屬于鋅指轉錄因子Snail家族,是一種轉錄抑制因子,參與了EMT過程中的E-Cad的下調,與前列腺癌的淋巴轉移相關[27]。還有研究發現,慢性缺氧誘導下的Slug通過激活Eph相關受體酪氨酸激酶的配體ephrin-B1的表達促進前列腺癌細胞的侵襲[28]。
作為上游調控因子,腫瘤細胞需要多種遺傳和表觀遺傳改變來激活生長因子受體、信號蛋白、激酶和轉錄因子。在構建的TRN基礎上,本研究進一步追溯了其上游的調控因子,發現EGCG、AKT1、FGF2、β-雌二醇處于前列腺癌異常轉錄因子的上游,與多條信號通路交織,在相關網絡中處于支配地位,在前列腺癌的發生、發展中扮演著重要的角色。EGCG是綠茶中的一種活性化合物,能夠介導前列腺癌細胞內Ca2+升高,引起前列腺癌細胞的巰基氧化和Ca2+泄漏增強,該機制或可觸發EGCG對前列腺癌細胞的細胞毒作用,目前已證實EGCG對癌細胞有細胞毒作用,其劑量對于組織配對的正常細胞幾乎是無害的[29]。AKT1主要調節糖酵解途徑,在前列腺癌細胞的增殖、侵襲、跨內皮遷移等過程中發揮重要作用,AKT1和癌基因MYC的失調能夠顯著改變由非糖營養源及其下游激活的代謝途徑[30]。FGF-2和肝細胞生長因子(hepatocyte growth factor,HGF)可以通過恢復腫瘤內雄激素合成,協助前列腺癌細胞產生對阿比特龍的耐藥性,這可能形成一種逃逸機制,促進了高級別前列腺癌的發展[31]。前列腺癌中FGF2與p53的相互作用相關研究中較少,作為AR和p53的共同上游調控因子,后續可以關注FGF2與p53在前列腺癌中的作用機制。β-雌二醇在前列腺癌發病中起重要作用,其水平的波動會引起雄激素水平的變化,雄激素水平下降會引起前列腺組織萎縮,雄激素水平恢復可能會促進前列腺上皮的再生,通過這種方式,攜帶致癌突變的細胞得以克隆擴增[32]。雖然β-雌二醇與AR的關系已經明確,但β-雌二醇作為上游調控因子,很有可能通過其他轉錄因子旁通路傳遞相關信號。
綜上所述,信號通路上游的調控因子和轉錄因子在癌癥發生、發展中扮演著關鍵角色,具有重要的致瘤作用,且其表達量的異常不容易被免疫系統識別,可逃避免疫檢查點治療,導致不良臨床預后。就設計新型藥物而言,由于缺乏高度可藥物化的載體,存在更多的蛋白質相互作用,需要核定位等,轉錄因子及其上游調控因子相對定位于信號網絡中的蛋白,在靶向治療領域往往更具挑戰性。但是,由于轉錄因子的異常改變在前列腺癌發生和發展早期有重要意義,并且是進一步致癌的驅動因素,針對轉錄因子及其上游調控因子的靶向治療能夠解決腫瘤異質性,并且可能推遲耐藥性突變。因此,轉錄因子及其上游調控因子在臨床的治療和預后評估中具有潛在的臨床應用價值。

