烏司他丁抑制TLR4/NF-κB信號通路對心肺復蘇大鼠心功能的改善作用
陳建春 思永玉 李元 李福全 蔣俊
心臟驟停(cardiac arrests,CA)屬于高發病率疾病[1],盡管心肺復蘇(cardiopulmonary resuscitation,CPR)技術和復蘇后護理在一定程度上提高了患者生存機會,但腦損傷導致患者在恢復自然循環后仍有很高的死亡和殘疾率[2,3]。心肌功能障礙導致的低心排血量加重了器官功能障礙,并降低了心臟驟停幸存者的長期神經預后[4,5]。CA幸存者的后遺癥,包括缺氧腦損傷、心肌功能障礙和全身性缺血/再灌注反應,這被描述為心臟驟停后綜合征(PCA),在PCA的發展過程中,全身性缺血/再灌注反應可引發全身性炎癥級聯反應,這是其典型病理過程,并導致多器官功能障礙性疾病(MODS)的形成。這一過程類似于全身炎性反應綜合征(SIRS),因為促炎因子如腫瘤壞死因子(TNF-α)、白細胞介素-1β(IL-1β)可被視為PCA的損傷生物標志物[6]。核轉錄因子NF-κB亞單位p65的激活導致炎性細胞增加其促炎因子的表達和合成[7, 8],在許多Toll樣受體(TLR)信號通路中,TLR4的激活被認為是有害的,因為它對炎癥信號通路有影響[9]。Gui等[10]證明,TLR4/NF-κB途徑的下調減少了心肌梗死的大小并改善了心臟功能。在本研究中,我們旨在探究烏司他丁對心肺復蘇大鼠的影響機制。
1 材料與方法
1.1 實驗動物 從查士利華醫藥技術(上海)有限公司[動物許可SYXK(滬)2022-0001]獲得18只SPF級雄性Wistar大鼠,體重360~380 g,年齡12周。將動物圈養在恒溫(23±1)℃環境中,光照/黑暗周期為12 h,自由進食和飲水。
1.2 血流動力學監測 大鼠(12周齡)通過腹腔注射戊巴比妥(30 mg/kg)進行麻醉[21, 22]。用PE 200導管(angiocath,becton dickinson)對動物進行氣管插管,并進行機械通氣(Flexivent EC-VF-2,Scireq Scientific Respiratory Equipment Inc)。呼吸機設置:潮氣量0.8 ml/100 g,呼吸頻率90次/min, FiO2為1.0。通過右股動脈插入一個充滿0.9%氯化鈉溶液的PE-50管來測量動脈血壓。為了測量左心室壓力,通過右頸動脈插入另一根充滿0.9%氯化鈉溶液的PE-50管,并推進到左心室,進行超聲心動圖和左心室壓力波形檢測。液體和藥物通過右頸靜脈途徑給藥。基于PC數據采集系統(ADI Instruments, Inc.)記錄血液動力學參數。每小時測量1次血流動力學參數,并在心臟驟停前至自主循環恢復(ROSC)后第4小時進行監測。使用Philips Sonos 5500彩色多普勒超聲心動圖(Philips, Andover, MA, USA)測定左心室(LV)射血分數(EF)。左心室收縮功能用左心室壓力為40 mm Hg時的dp/dt(dp/dt40)來表示。用于檢測血液溫度的熱導管通過左股動脈放置,并通過固定長度法推進到胸主動脈。用熱稀釋法測量心輸出量,然后用Cardio-Max Ⅱ系統(Columbus Instrument, Columbus, OH, USA)進行分析。
1.3 窒息致心臟驟停動物模型及研究設計 通過關閉呼吸機和夾住氣管內導管誘發窒息的心臟停搏。窒息后不久出現心動過緩和低血壓,隨后出現收縮期心律,血壓無法測量。心臟驟停被定義為平均股動脈壓力<10 mm Hg。在9.5 min的窒息引起的心臟驟停后,72 h的存活率為50%[23]。窒息9.5 min后,通過靜脈注射腎上腺素(0.01 mg/100 g),并由同一研究人員對所有動物以200次/min的速度用食指進行胸部按壓以實施心肺復蘇。對胸外按壓進行調整以提供監測中看到的統一速率,并在復蘇過程中提供>20 mm Hg的目標主動脈舒張壓。通常在3 min內達到ROSC,如果6 min內不能獲得ROSC,則排除動物。這是一項隨機的動物研究,以調查UTI治療的效果(每組n=6,總n=18)。UTI治療組在ROSC后以100 mg/kg UTI (tianpu biochemistry and medicine corporation, Sichuan, China)靜脈注射[24]。對照組以等量的普通0.9%氯化鈉溶液輸注。在治療期間,體溫保持在36.5℃。
1.4 存活率 在有創監測4 h后,從所有動物身上拔出導管和氣管插管。動物在拔管后1 h內接受了1 ml 0.9%氯化鈉溶液的腹腔注射,并被送回籠子。每隔12 h對所有大鼠的健康狀況進行仔細監測,記錄生存狀況,通過喪失自主呼吸運動和超過2 min無心跳來確認死亡。對不同組間的存活率進行比較。如果動物達到人道的終點標準,包括體重與基線相比低于20%或持續發作超過10 min,立即實施安樂死。所有的動物都在達到安樂死的標準之前死亡,因為在心臟驟停和復蘇的實驗中,動物通常會突然死亡。
1.5 動物分組 大鼠被隨機分配為3組:(1)sham組(n=6);(2)control組(心肺復蘇組,n=6);(3)UTI組(心肺復蘇聯合烏司他丁治療組,n=6)。根據組別設計,每只大鼠的尾巴上都有不同顏色的標記,籠子上標有組別名稱。sham組大鼠經歷了除心臟驟停和心肺復蘇以外的所有操作程序。UTI組進行心肺復蘇,在恢復自發循環后,接受靜脈注射烏司他丁,control組的大鼠分別相同體積的鹽水。
1.6 神經系統缺損的評估
1.6.1 神經系統檢查:由對實驗設計保密的調查員進行的,使用的是神經系統缺損評分(neurological deficit score, NDS),其范圍80(最佳)~0(腦死亡),包括一般行為缺損的子評分:意識正常、昏迷或無反應,睜眼喚醒和呼吸正常、異常(通氣不足或過度)或沒有呼吸。存活大鼠的NDS在心臟驟停/心肺復蘇(CA/CPR)后24、48和72 h被評估。
1.6.2 腦干功能評估:①嗅覺:對食物氣味的反應;②視覺:頭部對光的運動;③瞳孔光反射;④角膜反射;⑤驚嚇反射;⑥對胡須刺激的反應;⑦對液體或固體的吞咽。
1.6.3 運動評估的子分數:包括力量測試正常、異常(僵硬或無力)和沒有運動。運動行為子得分是根據步態協調來評估的,分為正常、異常或無。如果大鼠能穿過離地面0.5 m高的2 cm寬和1 m長的橫梁,則判斷其在橫梁上的平衡是正常的;如果大鼠嘗試過但沒有繼續,或暫時停留而跌倒,則判斷為異常。如果大鼠放在橫梁上后立即掉下來,則評估結果為無。
1.6.4 感覺評估的子分數:包括對肢體擠壓的反應為輕快的退出、弱或異常的反應(伸展或彎曲的姿勢)和無反應。
1.6.5 其他評估的行為反射分值:①扶正反射(動物仰臥,并能糾正到直立位置);②轉彎小巷(使動物在15 cm×0.5 m的小巷盡頭行走并轉回);③視覺放置(動物被抬起,并能在視覺上確定物體和深度);④負地軸(將動物仰臥在傾斜45°的平面上,動物能自我糾正并在斜面向上移動)。最后一個分項評估了癲癇發作(抽搐或非抽搐)的發生情況。
1.7 轉棒疲勞實驗 轉棒疲勞實驗評估大鼠的運動協調和平衡能力。它包括適應性訓練和測試過程。在CA手術前,每組大鼠都要連續訓練3 d。旋轉棒疲勞計被設置為4 r/min。動物每天訓練3次,每次至少15 min,2次訓練的間隔時間至少15 min。最后的測試在ROSC后5 d進行。將所有存活的大鼠單獨放在旋轉桿上,在260 s內將旋轉速度從4 r/min提高到40 r/min,并記錄大鼠從開始到跌倒的時間。該實驗重復3次,最后以摔倒前的平均時間作為結果。
1.8 血清炎性因子水平 ROSC 48 h后采集眶后血樣(0.8~1.2 ml),通過12 000 g離心10 min分離血清,儲存在-80℃直至分析。使用商用ELISA試劑盒(R&D system)分析IL-1β、TNF-α、IL-6的水平。
1.9 Western blotting ROSC后第5天,解剖雙側前額葉皮層,將左側皮層組織勻漿用于Western blotting。使用裂解緩沖液(Thermo Scientific,Rockford,IL,USA)制備總蛋白裂解物,所述裂解緩沖液含有蛋白酶抑制劑混合物(Sigma-Aldrich)和磷酸酯磷酸酶抑制劑混合物(Roche,Nutley,NJ,USA)。BCA分析試劑盒(Thermo Fisher Scientific,USA)用于測量蛋白質濃度。通過SDS-PAGE分離每個泳道包含20 μg總蛋白的樣品,然后轉移到PVDF膜上。在室溫下用5%脫脂牛奶封閉膜約1 h,并在4℃下與下列初級抗體一起孵育過夜:兔多克隆抗TLR-4抗體(1∶1 000;Abcam,USA);兔多克隆抗p65抗體(1∶1 000,Abcam,USA);兔多克隆抗p-p65抗體(1∶1 000,Abcam,USA);GAPDH (1∶5 000; Abcam,USA)。在與第二抗體孵育后,使用增強化學發光試劑(Pierce,IL,USA)顯現免疫反應條帶,并使用GeneSnap軟件7.08版可視化。使用Image J軟件對蛋白量進行定量,并根據同一樣品中GAPDH的密度進行標準化。
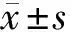
2 結果
2.1 烏司他丁治療提高大鼠存活率,改善心臟驟停后的心功能 sham組的6只大鼠全部存活,control組和UTI組大鼠的存活率分別為50%和66.7%,但差異無統計學意義(P=0.2432)。誘導心臟驟停前(Pre-PR)和ROSC時的血流動力學參數在3組間無顯著差異。與control組比較,UTI組在ROSC后1~4 h內的左心室射血分數上升。搶救后第1小時,UTI組心率較低,然而2組心率在搶救后的整個時期內無差異,以dp/dt40表示的左心室收縮功能在心臟驟停和復蘇后2組差異無統計學意義(P>0.05)。見表1。
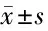
表1 3組左心室射血分數、心率和左心室收縮功能比較 n=6,
2.2 烏司他丁改善心肺復蘇后大鼠神經認知功能、運動協調和平衡 在sham組,NDS評分在所有時間點都接近80分。CA后,對照組的神經功能缺損評分明顯低于sham組,UTI治療顯著減輕了神經功能缺損評分。CA/CPR后,control組存活的大鼠平均速度,大鼠行走總時間,大鼠下落時轉棒速度和總行走距離,而UTI的應用有效地減弱了CA/CPR帶來的神經系統損傷及運動失調(P<0.01)。見表2、3。
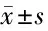
表2 在ROSC后24、48和72小時評估的神經功能缺損評分 n=6,分,
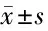
表3 烏司他丁改善運動協調和平衡 n=6,
2.3 烏司他丁降低心臟驟停/心肺復蘇后促炎因子的表達 與sham組比較,心肺復蘇后2 h,血清IL-1β、TNF-α、IL-6的水平顯著增加,差異有統計學意義(P<0.01)。然而,復蘇后應用烏司他丁減少了IL-1β、TNF-α、IL-6的產生,差異有統計學意義(P<0.01)。見表4。
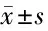
表4 3組大鼠血清IL-1β、TNF-α和IL-6水平比較 n=6,
2.4 烏司他丁抑制TLR4/NF-κB通路活性 Western blotting結果顯示,與sham組比較,control組TLR4蛋白表達及p-p65/p65表達水平顯著上升,差異有統計學意義(P<0.05)。而在施用烏司他丁后,TLR4蛋白及p-p65/p65表達水平顯著下降,差異有統計學意義(P<0.01)。見表5,圖1。

圖1 烏司他丁抑制TLR4/NF-κB通路活性
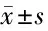
表5 Western blotting檢測ROSC第5天后大鼠大腦皮層TLR4/NF-κB通路相關蛋白表達水平 n=6,
3 討論
CA/CPR誘導全身缺血再灌注(I/R)損傷,激活免疫系統,引起全身炎性反應。在CA/CPR過程中,白細胞、巨噬細胞和組織常駐免疫細胞識別損傷并釋放主要細胞因子,進而誘導白細胞的募集和活化,放大炎性反應[25]。作為中樞神經系統(CNS)的重要常駐免疫細胞,小膠質細胞表達各種細胞因子受體,識別IL-1β和TNF-α等。因此,小膠質細胞在I/R損傷后會過度活化,釋放過量的促炎細胞因子,損害神經功能[26]。炎癥對于CA/CPR后神經功能缺損的發病機制至關重要[27, 28]。IL-6是另一種眾所周知的細胞因子,它在腦缺血后被上調,IL-6的血清水平與腦梗死體積相關,并且是早期神經惡化的有力預測因子[29]。
烏司他丁(ulinastatin)于20世紀80年代首次在人類血液、尿液和其他組織中發現[10],對多種蛋白酶有抑制作用[11],已經顯示出對大腦缺血-再灌注損傷的器官保護作用[12]。烏司他丁通過抑制JNK/NF-kappaB信號通路和PI3K/Akt/Nrf2通路來減輕炎癥和抵抗氧化應激[13,14]。此外,烏司他丁可以通過激活Nrf-2/HO-1信號通路,對緩解腦缺血再灌注損傷提供一定程度的保護,并可能通過內質網應激誘導的細胞凋亡通路改善心肌缺血再灌注損傷[15,16]。此外,作為一種天然的抗炎分子,烏司他丁在內鏡逆行胰腺造影術后胰腺炎的藥物預防和嚴重減壓病的治療,甚至在SARS-CoV-2感染的治療中都有很好的前景[17-19]。在亞洲地區,UTI被用作治療急性炎癥性疾病的基本藥物,包括胰腺炎、敗血癥和休克[20]。
一些研究者分析了烏司他丁在心肌缺血再灌注損傷(MIRI)的保護作用機制,Kawamura等[30]報道,UTI通過抑制IL-8和IL-6的釋放,在與體外循環心內直視手術相關的MIRI中發揮心臟保護作用。Yang等[30]提出,烏司他丁可以通過下調TNF-α的表達和抑制由c-Jun N-末端激酶(JNK)和P38絲裂原活化蛋白激酶(MAPK)信號通路誘導的MIRI來保護心臟功能。本研究發現心肺復蘇組ROSC后血清TNF-α、IL-1β、IL-6水平顯著升高,而烏司他丁治療減弱了促炎因子TNF-α、IL-1β、IL-6的升高,改善了神經功能預后。并且,轉棒疲勞實驗顯示烏司他丁有效改善心臟驟停/心肺復蘇后大鼠神經認知功能、運動協調和平衡。TLR4作為一種模式識別受體,參與I/R損傷誘導的炎性反應[31],TLR4缺陷型小鼠在心肌I/R損傷后經歷了心肌梗死面積的減小,這是由炎性信號通路活性的降低介導的,如多形核嗜中性粒細胞的積聚和氧化應激的激活[32]。NF-κB是一個重要的促炎癥轉錄因子[33],TLR4的激活與促炎癥細胞因子(IL-1β、IL-6和TNF-α)的表達以及幾種細胞類型中NF-κB信號途徑的激活有關[34, 35]。在本研究中,與sham組相比,control組TLR4/NF-κB信號通路活性被激活,而在施用烏司他丁治療后,大鼠大腦皮層TLR4、p-p65/p65水平顯著下降,表明TLR4/NF-κB通路活性被抑制。
我們的研究有一些局限性。首先,這項研究是在沒有任何與心臟驟停相關的潛在疾病的動物中進行的;第二,可處理的實驗動物數量有限。在未來的研究中,我們將在更大樣本量的動物中對該機制進行驗證。

