模式生物斑馬魚在神經退行性疾病中的研究進展
黃孔麗蘇世杰王玉婷劉壯壯曹丹丹汪 沛陳冠林王 奇*
(1.廣州中醫藥大學科技創新中心,廣州 510405;2.廣州中醫藥大學針灸康復臨床醫學院,廣州 510006;3.廣州中醫藥大學第三附屬醫院,廣州 510378)
斑馬魚,因體側有像斑馬一樣縱向的藍色與銀色相間的條紋而得名。 斑馬魚作為一種脊椎動物模型,具有物種穩定、個體差異小、發育周期短、繁殖能力強、神經系統發育迅速等特點。 大約82%的人類疾病基因在斑馬魚中有同源基因[1],基因組信號調控也與人類有很高的相似性,可應用于高通量篩選[2]。 斑馬魚的大腦擁有哺乳動物大腦中的所有主要結構,斑馬魚的主要神經遞質系統,包括去甲腎上腺素能、5-羥色胺能、多巴胺能和組胺能系統,顯示出與哺乳動物系統的許多相似性[3]。 此外,斑馬魚具有與人類相似的血腦屏障功能[4]。 這些都說明了斑馬魚與人類具有高度保守的大腦組織,可用于研究神經退行性疾病,這使得斑馬魚在神經退行性疾病研究中有獨特的優勢,是理想的模式動物(圖1),應用前景廣闊,彌補了嚙齒動物的不足(表1)。
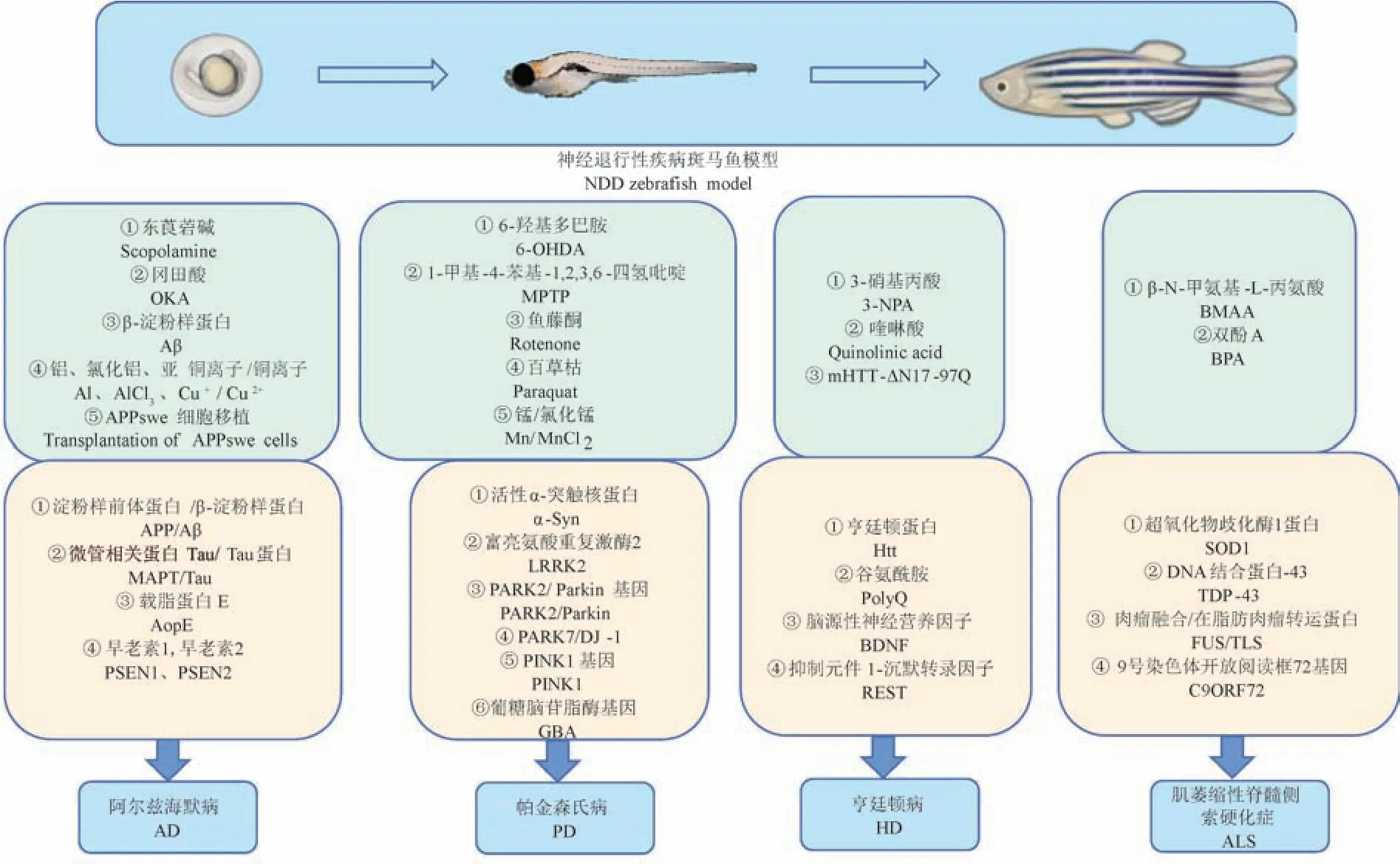
圖1 斑馬魚構建神經退行性疾病模型Figure 1 Neurodegenerative disease models of zebrafish
1 斑馬魚在神經退行性疾病中的研究進展
1.1 阿爾茨海默病(Alzheimer’s disease,AD)
AD 是一種慢性進行性神經退化性疾病,以進行性記憶減退、認知障礙、人格改變為主要臨床特征,是癡呆最常見的類型[5]。 隨著社會老齡化的加劇,AD 的發病率也迅速增長。 大腦神經細胞外不溶性淀粉樣蛋白β 斑塊(amyloid-beta,Aβ)、細胞內Tau 蛋白過度磷酸化所致神經纖維纏結形成(neurofibrillary tangles,NFTs)[6]以及突觸和神經元丟失是AD 的主要病理特征[5]。 AD 的發病機制復雜,至今尚無完全明確,關于其致病假說主要有Aβ毒性學說,微管相關蛋白Tau(microtubule-associated protein Tau,MAPT)異常學假說等[7]。
研究表明,應用于研究AD 的斑馬魚模型包括突 變 型APPswe、 突 變 型PSEN1 或PSEN2、 Tau-P301L-Tg 斑馬魚,東莨菪堿、蛋白磷酸酶2A 抑制劑岡田酸(okadaic acid,OKA)、Aβ1-42、鋁(Al)、氯化鋁(AlCl3)和氯化銅(CuCl2)等物質誘導的AD 模型等。 研究者們基于此類模型探究了部分物質抗AD的藥理作用。
通過斑馬魚細胞移植技術構建可調控突變型APPswe表達的AD 動物模型,探究Aβ 沉積對腦血管系統的損傷及動物行為學的影響,為研究AD 的治療構建一個具有時空可控性的動物模型,這項研究建立的APPswe斑馬魚表現為腦內神經元數量減少[8]。 編碼基因PSEN1 和PSEN2 的突變在早發型家族性AD 患者中被發現,突變型PSEN1 或PSEN2已被證實可增加大腦中長時間的高纖維原性Aβ 形成,從而誘發AD 的發生[9]。 斑馬魚PSEN1 剪接干擾可誘導早發性AD 表型,如認知障礙、Aβ1-42聚集和突觸減少[10]。 人類Tau-P301 L 突變體已被廣泛用于建立轉基因動物模型[11-12],此類模型因仿效了AD 患者Tau 蛋白異常修飾而被廣泛應用[13]。 Tau-P301 L 過表達會導致成年斑馬魚腦內Tau 過度磷酸化[14]。 Alavi Naini 等[15]在Tau-P301 L-Tg 斑馬魚中使用硫酸肝素拮抗劑和草酰硫酸肝素拮抗劑可以減少p-Tau、減輕神經元丟失。 Barbereau 等[14]利用Tau-P301 L-Tg 斑馬魚研究了早期Tau 誘導的神經毒性如何改變腦源性神經營養因子(brain-derived neurotrophic factor,BDNF)信號,結果表明Tau 神經毒性引起BDNF 系統的改變。
東莨菪堿為膽堿能拮抗劑,腹腔注射后可出現膽堿功能障礙和氧化應激,此模型可以造成動物學習記憶障礙。 Capatina 等[16]用東莨菪堿誘導的斑馬魚記憶損傷模型探討百里香精油對膽堿能神經元的作用,證實了百里香精油可以降低AChE 活性和大腦抗氧化能力。 Boiangiu 等[17]等用可替寧和6-羥基-l-尼古丁治療東莨菪堿誘導的AD 斑馬魚模型,發現二者均能減弱東莨菪堿誘導的焦慮樣行為和記憶障礙,并降低斑馬魚大腦中的ROS 水平和AChE 活性。 研究報道,OKA 作為斑馬魚AD 疾病模型的誘導物,可以誘導斑馬魚氧化應激、膠質細胞激活、神經炎癥、膽堿功能障礙、谷氨酸興奮性毒性和線粒體功能障礙[18-19],表現出AD 的大部分癥狀[20]。 Koehler 等[21]利用OKA 建立了斑馬魚AD模型,研究4-芐基-2-甲基-1,2,4-噻二唑烷-3,5-二酮(TDZD-8)對AD 模型GSK3β 的抑制作用,發現注射OKA 后能夠重現與AD 相關的大部分神經病理,降低p-Tau、Pp2A 和GSK-3β 活性/失活比。研究發現,AD 患者腦組織內Aβ 明顯增多,并形成大量的老年斑[5]。 人體內Aβ 最常見的亞型是Aβ1-40和Aβ1-42。 其中Aβ1-42更容易聚集且更強的毒性,從而形成Aβ 沉淀的核心,引發神經毒性作用[5]。 Reinhardt 等[22]選 用Aβ1-42來 誘導 斑 馬魚AD 模型,發現細胞周期蛋白依賴性激酶5(CDK5)抑制劑LDC8 在斑馬魚AD 模型中起到保護神經元的作用。 Sang 等[23]研究發現阿魏酸衍生物TM-10對Aβ1-42誘導的斑馬魚血管損傷具有有效的神經保護作用, 可以抑制人類丁酰膽堿酯酶( butyrylcholinesterase, BuChE )、 單 胺 氧 化 酶(monoamineoxidase,MAO)活性,減少Aβ 聚集。 Al是一種已知會導致大腦神經毒性的金屬,它會促進神經退化,影響記憶和認知能力,誘發AD 的發病[24]。 Gao 等[25]通過建立Al 誘導的斑馬魚AD 模型探討其特異性壞死抑制劑Necrostatin-1 是否能有效緩解斑馬魚AD 模型的學習記憶障礙,結果表明Necrostatin-1 可以逆轉Al 誘導的學習記憶損傷、提高Ach 水平和神經細胞數量。 鐘綺媚等[26]用Al 誘導的斑馬魚AD 模型來研究不同ω-3 多不飽和脂肪酸二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳五烯酸(docosapentaenoic acid,DPA)、二十二碳六烯酸(docosahexaenoic acid,DHA)對斑馬魚AD模型記憶損傷和神經病理學變化影響,結果顯示Al顯著激活斑馬魚幼魚腦內的小膠質細胞;EPA、DPA和DHA 均顯著降低Aβ 蛋白濃度和GFAP 的mRNA表達。 AlCl3是一種用于誘導嚙齒類AD 模型的標準化學品[27]。 Kaur 等[27]用AlCl3處理斑馬魚,發現斑馬魚體內還原型谷胱甘肽和超氧化物歧化酶水平顯著降低,而丙二醛水平升高。 汪雪雁等[28]利用CRISPR/Cas9 技術敲除斑馬魚ucp2 基因,研究ucp2 基因在AlCl3致斑馬魚癡呆中的作用,研究發現魚體內ROS 水平顯著升高;psen1、psen2、tnf-α和il-1βmRNA 轉錄水平顯著上調。 夏樂旋[29]用選用AlCl3誘導AD 斑馬魚模型,研究生慧湯抗AD 的作用機制,結果顯示生慧湯能改善AD 斑馬魚模型的學習記憶能力和認知功能障礙、減少AD 斑馬魚模型腦部異常Aβ 的積累,抑制Aβ 的毒性損傷,促進神經元的修復和再生。 用AlCl3誘導6 月齡斑馬魚,發現補腎益智方[30]能有效改善AD 斑馬魚的學習記憶能力,減少Aβ 生成,減輕ROS。 黃連解毒湯[31]、鉤藤堿[32]以及黃精多糖[33]作用于AlCl3誘導的AD 斑馬魚模型可以通過下調p-P38/P38 的比值,上調Ncadherin 蛋白水平,進而改善AD 模型斑馬魚的學習記憶能力。 Cu+/Cu2+離子是人體必需的,嚴重的神經和代謝紊亂與Cu+/Cu2+穩態的異常相關,如AD。 Rakshit 等[34]使用CuCl2處理斑馬魚模型來評估化合物2c 和3c 在體內的功效,實驗表明,用CuCl2處理的野生型斑馬魚幼魚表現出氧化應激增強。 表2 總結了近幾年使用斑馬魚來構建AD 模型的建立方式、治療藥物及其作用機制。
1.2 帕金森病(Parkinson’s disease,PD)
PD 是一種伴有為震顫、肌強直、進行性運動徐緩及姿勢異常等典型癥狀的神經退行性疾病。 病理特征主要表現為中腦黑質紋狀體多巴胺能(dopaminergic,DA)神經元變性缺失和α-突觸核蛋白(α-synuclein,α-Syn) 組 成 的 路 易 小 體(Lewy bodies,LBs)形成[35]。 PD 的確切病因至今未明。神經毒物和遺傳因素均可能參與PD 中DA 神經元的變性死亡過程。 斑馬魚具有腹側間腦,這與哺乳動物的黑質是同源的[36]。 一些神經毒素如6-羥多巴胺(6-hydroxydopamine,6-OHDA)、1-甲基-4-苯基-1,2,3,6-四氫吡啶(1-methyl-4-phenyl-1,2,3,6 tetrahydropyridine,MPTP)、百草枯(Paraquat)和魚藤酮(Rotenone)是現今常被用于復制PD 的斑馬魚模型,均會不同程度地影響斑馬魚模型的多巴胺神經系統并出現PD 的主要癥狀[37]。
6-OHDA 暴露于斑馬魚會導致DA 神經元的喪失和運動活動的降低[36]。 Abidar 等[38]探究長角豆葉水提物對6-OHDA 誘導的斑馬魚PD 模型的認知影響和抗氧化活性,結果表明,長角豆葉水提物具有抗氧化和抗乙酰膽堿酯酶活性。 Wu 等[39]采用6-OHDA 誘導的斑馬魚PD 模型評價巖藻黃質的神經保護作用,發現巖藻黃質預處理顯著增加了斑馬魚幼蟲的總游動距離,改善了腦組織損傷。 Kesh等[40-41]檢測柚皮素和橙皮苷對6-OHDA 毒性的神經保護作用,發現二者均降低了ROS 水平,改善斑馬魚幼魚的運動能力。 MPTP 是一種能夠引起動物類PD 癥狀和病理的神經毒素,可用作構建PD 模型[42]。 Selvaraj 等[43]利用MPTP 構建了斑馬魚的PD 模型,發現其體內DA 神經元及轉運體顯著減少,并表現出焦慮、運動遲緩、運動范圍受限的癥狀。 Ren 等[44]用MPTP 誘導斑馬魚幼魚做PD 模型評價甘草酸素對斑馬魚PD 的治療效果,結果證明甘草酸素可以緩解細胞凋亡和自噬,抑制炎癥反應。 Zhao 等[45]探討迷迭香酸對MPTP 誘導的斑馬魚胚胎多巴胺能神經毒性的影響,發現迷迭香酸具有神經保護作用。 Duan 等[46]研究苦茶堿在MPTP誘導的斑馬魚PD 模型中的作用,苦茶堿被證明可以恢復DA 神經元的損失和行為表現的損害。 牟蕾等[47]用MPTP 誘導斑馬魚PD 模型,發現MPTP 造模組的斑馬魚DA 神經元出現不同程度的損傷,出現運動遲緩、焦慮、與PD 相關的基因表達異常等。百草枯是一種能引起多巴胺能神經元死亡并影響多巴胺生物合成的農藥[48]。 斑馬魚幼魚暴露于百草枯會引起DA 神經元的氧化損傷,導致行為障礙[49]。 Mohamad Najib 等[50]研究人金屬硫蛋白2肽(human metallothionein 2 peptide,hMT2)在百草枯誘導的斑馬魚腦損傷中的作用,結果發現百草枯處理導致DA 神經元減少,而hMT2 處理后DA 神經元數量增加。 魚藤酮誘導斑馬魚可以產生PD 癥狀,經過魚藤酮處理的斑馬魚,表現出運動能力下降、焦慮、抑郁、記憶力下降等癥狀[51]。 Santo 等[52]用魚藤酮誘導的斑馬魚PD 模型為實驗模型,評價正己烷提取物對PD 的神經保護作用。 Yurtsever等[53]評價利福平在魚藤酮誘導斑馬魚PD 實驗模型中的作用,將成年斑馬魚暴露魚藤酮和利福平3周,研究結果表明利福平有效地減輕神經炎癥。 氰戊菊酯是一種廣譜、高效的殺蟲劑,具有干擾人類神經 功 能 的 潛 力。 Zhu 等[54]利 用 氰 戊 菊 酯(fenvalerate,FEN)來誘導斑馬魚PD 模型,結果產生了典型的PD 癥狀,并伴有泛素和路易體相關基因的增加,產生PD 相關癥狀。 斑馬魚也成為評估金屬離子、納米材料和污染物等對PD 發病機制影響的比較流行的動物模型。 過多接觸錳(Mn)會損害精神,認知和運動功能。 有報道稱成年斑馬魚慢性暴露于氯化錳(MnCl2)21 d 會產生PD 樣癥狀,表現出運動功能的缺陷[55]。 將斑馬魚胚胎暴露于石墨烯家族納米材料中可誘導神經毒性并改變PD 相關基因的表達[56]。 用氧化鋅納米材料破壞斑馬魚的運動活動,可誘導細胞凋亡和神經元損失[57]。 長期接觸來自廣泛污染物的雜環胺,會增加患PD 的潛在風險[58]。
近年來,基于PD 相關基因的斑馬魚Tg 模型也得到了廣泛的應用。 研究表明,PD 的發病與α-Syn、Parkin、DJ-1、PINK-1、LRRK2 等基因突變有關[59],而PD 的相關致病基因在斑馬魚中均有直系同源。 對上述轉基因或基因敲減斑馬魚模型的研究揭示了這些基因在DA 神經元的發育和存活過程中具有保守功能[60]。 α-Syn 的積累和聚集是PD 的一個重要特征,表達人類野生型或A53T 突變體α-Syn 的模型可用于研究α-Syn 聚集動力學,研究控制可溶α-Syn 和聚集α-Syn 清除的機制和潛在的新靶點[61]。 與人類Parkin 相似,斑馬魚中Parkin 活性降低會導致多巴胺能神經元數量顯著減少,Parkin活性增加可以保護轉基因斑馬魚免受蛋白質毒性應激引起的細胞死亡[62]。DJ-1 由Park7 編碼,在保護神經元免受氧化應激方面具有多重作用,斑馬魚敲除Park7 會產生PD 表型[63]。Pink1 是與早發性PD 相關的線粒體相關基因,單獨敲除Pink1 會導致斑馬魚的DA 神經元減少。LRRK2 基因突變與家族性和散發性PD 病例有關,LRRK2-g2019 s 突變是最常見的[64]。 斑馬魚中LRRK2 的破壞會導致嚴重的發育缺陷和神經元丟失[65]。PARLA基因的功能缺失使主要位于嗅球的DA 神經元減少[66]。Vps41 基因敲除會導致溶酶體異常以及小膠質細胞和小腦功能障礙[67]。Nus1 基因的變異可能是PD 發病機制的誘因。 斑馬魚敲除Nus1 基因會表現出運動障礙[68]。 表3 總結了化學誘導和基因編輯方式建立的PD 斑馬魚模型。
1.3 亨廷頓病(Huntington’s disease,HD)
HD 是一種病變累及紋狀體、大腦皮層為主的中樞神經系統退行性變性疾病,呈常染色體顯性遺傳,是由致病蛋白的異常積聚和細胞自身清除異常蛋白能力失調造成的[77]。 HD 的發病機制主要是亨廷 頓 蛋 白(huntingtin, HTT) 上 的 多 谷 氨 酰 胺(PolyQ)束上的CAG 三聯體異常擴增[78]。 有研究發現抑制元件1-沉默轉錄因子(repressor element-1-silencing transcription factor, REST) 是HTT 調 節BDNF 表達的分子靶點,并且HTT mRNA 和蛋白的可溶性突變形式是導致細胞死亡的有毒成分[79]。病理學上,HD 患者主要在紋狀體和大腦皮層內出現大量神經元死亡,大腦皮層萎縮,腦室系統擴大。
化學物質3-硝基丙酸(3-nitropropionic acid,3-NPA)、喹啉酸(quinolinic acid)和mHTT-ΔN17-97Q過表達實驗模型被用來探索HD 確切的致病機制和尋找新的藥物靶點,以開發新的治療方法[78]。
3-NPA 是一種毒素,斑馬魚幼魚暴露于3-NPA會導致形態和心率發生改變,對成年斑馬魚進行3-NPA 腹腔注射,其體重、運動和攻擊行為均有所下降,表現出長期厭惡記憶受損[80]。 Kumar 等[81]用3-NPA 處理成年斑馬魚,發現斑馬魚體重、認知和運動活動顯著降低,并伴有漸進性神經元損傷。 喹啉酸是一種興奮毒素,已被用于誘發嚙齒類動物的腦損傷,以建立HD 模型。 Skaggs 等[82]用喹啉酸損傷成年斑馬魚的端腦來研究神經修復過程。 HTTN 末端17 個氨基酸(N17)結構域在大腦紋狀體區高度表達。 Kumar 等[83]認為HD 中的N17 結構域可能是開發治療亨廷頓病的新治療策略的潛在治療靶點。 mHtt-ΔN17-97Q 轉基因斑馬魚是第一個概括HD 病理特征之一的轉基因斑馬魚[84],其顯示出快速進展的運動障礙[79]。
1.4 肌萎縮性脊髓側索硬化癥(amyotrophic lateral sclerosis,ALS)
ALS 是一種在脊髓、腦干和運動皮層中運動神經元選擇性丟失的神經退行性疾病。 ALS 的病理學特征是運動神經損傷,但運動神經元缺失的機制尚不清 楚。 β - N - 甲 氨 基- L - 丙 氨 酸(β-Nmethylamino-L-alanine,BMAA)和雙酚A(bisphenol A,BPA)等環境因素已被證實與ALS 的病因有關[85-87]。 但絕大多數家族性ALS 病例與基因改變有關,基因改變 主要 與SOD1、 TDP-43、 FUS 和C9ORF72 有關[87],通過研究ALS 相關致病基因,構建了ALS 斑馬魚模型,研究疾病發生的分子機制,并最終開發出具有治療前景的方案。
ALS 疾病多是由SOD1 突變引起的,Soll 等[88]使用SOD1-G93R 突變斑馬魚ALS 模型來評估1-Fe是否在體內顯示治療優點,結果表明1-Fe 通過特異性靶向SOD1 ALS 機制提高了幼魚的運動能力。 在斑馬魚中敲除TDP43 直系同源物TDP-43 會導致運動表型的早期缺陷和NMJ 的分解,降低AChE 的表達[89]。 FUS 是FUS 相關的ALS 和額顳葉癡呆的標志,Salam 等[90]證明了過表達突變FUS 改變了原始神經元和斑馬魚模型的突觸數量和神經元復雜性。C9orf72 基因內的六核苷酸重復擴張是ALS 最常見的遺傳原因。 Fortier 等[91]總結了斑馬魚模型已被用于研究C9orf72 相關ALS 的病理,探討它們在提供機制方面的價值和它們在藥物發現方面的潛在用途。
1.5 其他神經退行性病
多發性硬化(multiple sclerosis,MS)是一種慢性自身免疫性疾病,其組織學特征是中樞神經系統中出現脫髓鞘和再髓鞘斑塊。 Neely 等[92]為了確定成熟少突膠質細胞是否參與髓鞘再生,利用轉基因品系Tg(mbp:TRPV1-tagRFPt)和成年斑馬魚的視神經髓鞘再生模型,通過在成年斑馬魚中的實時體內成像研究了成熟少突膠質細胞增殖。
脊髓性肌萎縮癥(spinal Musclar Atrophy,SMA)是兒童最常見的遺傳性疾病,由生存運動神經元(survival Motor Neuron,SMN)蛋白缺失導致運動神經元丟失。 Koh 等[93]在轉基因hb9:mCherry-linker-Smn 斑馬魚胚胎中使用了一種體內熒光相關光譜方法來評估SMN 在運動神經元細胞體和軸突中的細胞動力學。
2 斑馬魚作為神經退行性疾病模型的局限性
動物模型與人類神經退行性疾病癥狀相似,但目前尚沒有一種模型能夠完全模擬人類神經退行性疾病的發病機制。 盡管但斑馬魚的神經傳導系統、神經元和神經膠質細胞類型及疾病相關基因同源性與人類都十分相似,但斑馬魚對人類來說仍然是一種不同的脊椎動物,所以斑馬魚神經退行性疾病模型存在一些局限性:第一,目前對斑馬魚腦組織的研究報道甚少[94]。 斑馬魚的端腦區功能與人類動物的海馬區功能相似,與學習記憶等行為有關,但由于斑馬魚體形較小,取材定位和制樣較困難。 此外,星形膠質細胞的一些生理、細胞和分子方面可能在斑馬魚和人類之間有所不同[95]。 第二,斑馬魚模型需要克服的重要的問題之一是控制和量化藥物暴露的挑戰,很難預測藥物吸收率[96]。 第三,作為模式動物,斑馬魚缺乏詳細的解剖和組織學參考。 斑馬魚除了能提供無特定病原體動物外,與機體重要組織臟器相關的形態標準亟需建立,斑馬魚的神經系統及其組織形態結構特征與人類相比,組織細胞學數據的匿乏,阻滯了斑馬魚作為模式動物的進一步應用[97]。
3 總結與展望
神經退行性疾病大部分是不可治愈的疾病,這給全世界造成了巨大的健康和社會負擔。 基于該現狀,在世界范圍內的掌握神經退行性疾病的發病機制及治療方法迫在眉睫。 近年來在神經退行性病變研究領域,斑馬魚的關注度越來越高,斑馬魚模型雖然與人類中樞神經系統有區別,但是斑馬魚在基本的神經傳導系統、神經元和神經膠質細胞類型以及與疾病相關基因同源性上與人類都很相似,所以目前斑馬魚模型在神經退行性疾病生理、病理以及相關藥物的研究中發揮著重要作用,并且選用斑馬魚可進行多方面的實驗,包括活體檢測、多靶點研究、藥物的代謝過程、藥物前期檢測、高通量篩選、行為檢測等,這些優點都可以為人類深入研究神經退行性疾病提供一個極具研究意義的方向。隨著未來科技的不斷發展,相信其不足之處將被人類妥善解決,并能發揮更為重要的作用。

