腸道微生物菌群與肥胖相關代謝性疾病的研究進展
蘇黑艷帕爾哈提,張姣姣,馬 壯,王俊人,李艷紅*
(1.新疆特殊環境物種多樣性應用與調控實驗室,新疆特殊環境物種保護與調控生物學實驗室,新疆師范大學生命科學學院,烏魯木齊 830054;2.新疆師范大學體育學院運動人體科學重點實驗室,烏魯木齊 830054)
近年來,諸多研究表明,腸道微生物菌群及其代謝物(特別是短鏈脂肪酸和膽汁酸)在肥胖及相關代謝性疾病的發生和發展中發揮著重要的作用[4-6]。 因此,充分了解腸道微生物菌群與代謝相關疾病的聯系,有助于對代謝性疾病的預防、診斷和治療。 本文梳理了腸道微生物菌群在肥胖相關代謝性疾病發生發展中的作用及機制研究。
1 腸道微生物的概念,組成及功能
腸道微生物(gut microbes,GM)指人類胃腸道內存在的所有微生物的遺傳組成,包括細菌、病毒、酵母、 原 生 動 物、 真 菌 和 古 菌[7]。 胃 腸 道(gastrointestinal tract,GIT)內的細菌細胞是宿主細胞的10 倍,而且在GIT 內的細菌基因組是宿主基因組的100 倍以上[8]。 Eckburg 等[9]對健康成年人的糞便進行分析發現,腸道微生物組在系統發育地位上基本分為厚壁菌門、擬桿菌門、變形菌門、放線菌門、疣微球菌門和梭桿菌門六大門,以厚壁菌門和擬桿菌門為主,占據了腸道微生物的80%~90%。厚壁菌門和擬桿菌門對人體的健康尤為重要,如厚壁菌門具有許多發酵膳食纖維的基因,并且還可以與腸粘膜相互作用,從而有助于體內平衡[10]。 桿菌門都具有多糖利用能力,可以為其他細菌提供營養,同時擬桿菌可加速腸粘膜中的血管生成,提高宿主免疫力,并維持腸道微生態平衡[11]。
GM 是宿主與微生物長期協同進化中相互選擇和適應的結果。 正常情況下,GM 與宿主機體處于共生關系,GM 參與機體的各種代謝,幫助人體將不可消化的食物成分發酵成可吸收的代謝物、合成必需維生素、去除有毒化合物、抵抗病原體、加強腸道屏障和刺激以及調節免疫系統[12-14]。 腸道微生物代謝產物短鏈脂肪酸(short chain fatty acid,SCFA)、膽汁酸(bile acids,BA)、吲哚衍生物等在維持宿主健康方面也發揮著重要作用。 SCFA 是由腸道微生物群發酵不溶性膳食纖維和難消化多糖產生的具有少于6 個碳原子數的代謝物,主要包括乙酸鹽、丙酸鹽、丁酸鹽、戊酸鹽、丙二酸鹽等[15]。 其中,乙酸鹽、丙酸鹽和丁酸鹽是三種主要SCFA,占腸道微生物產生SCFA 的90%左右[16]。 丁酸鹽主要由厚壁菌門產生,是結腸細胞的重要能量來源并維持腸道中的厭氧環境;丙酸鹽和乙酸鹽分別由黏蛋白-阿克曼菌、醋桿菌、葡糖桿菌等產生,在腸內穩態中也起重要作用,還增強腸屏障功能并有助于防御病原體[15,17]。 膽汁酸等其他代謝產物在調節炎癥反應,提高免疫力等方面發揮著作用。 因此,GM 失調會引起腸道微生物代謝產物的變化,進而導致各種代謝性疾病[18]。
2 腸道微生物與肥胖及相關代謝性疾病
代謝性疾病以肥胖為中心,會引發或加劇全身代謝穩態有關的組織和器官的炎癥反應,當炎癥持續存在時,導致局部脂肪沉積,降低胰島素敏感和增強全身性代謝異常,從而發展成代謝性疾病[19]。在多種代謝性疾病研究中發現,其腸道微生物菌群發生變化,參與代謝性疾病的發生和發展(表1)。

表1 肥胖及相關代謝性疾病中腸道微生物變化Table 1 Gut microbial changes in obesity and related metabolic diseases
2.1 腸道微生物與肥胖
肥胖已成為世界范圍內主要公共健康問題,是脂肪堆積過多導致的疾病,會提高患代謝性疾病的風險,如高血壓、癌癥等[29]。 越來越多的研究表明,肥胖與腸道微生物失調有關。 Rasmussen 等[30]發現,分別將正常小鼠和運動小鼠的GM 移植到高脂喂養的肥胖小鼠中,能有效降低肥胖小鼠的體重和脂肪含量。 Kulecka 等[20]發現,將正常小鼠的GM移植到肥胖小鼠后,肥胖小鼠體重明顯下降,并且腸道菌群的豐富度也上升。 Ley 等[31]對肥胖ob/ob小鼠、瘦ob/+小鼠和野生型同胞小鼠的盲腸微生物進行16 S rRNA 基因序列分析,發現肥胖小鼠的擬桿菌門豐度減少了50%,而厚壁菌門則成比例增加,認為厚壁菌門/擬桿菌門的增加可能導致肥胖。
2.2 腸道微生物與2 型糖尿病(diabetes mellitus type 2,T2DM)
肥胖狀態下,因機體的脂肪含量增多,容易導致胰島素抵抗,而胰島素抵抗是發展成為T2DM 的主要因素。 最近研究表明,腸道微生物群在T2DM發病機制中發揮重要作用[21]。 Almugadam 等[32]研究發現,T2DM 患者的腸道微生物群的豐富度(糞桿菌屬、梭桿菌屬、小類桿菌屬等)和多樣性與健康人相比均顯著下降。 最近一項研究顯示,T2DM 患者中豐富的變形桿菌(Proteobacteria)、厚壁菌/擬桿菌(Firmicutes/Bacteroidetes,F/B)之比均高于健康受試者[33]。 另有研究表明,T2DM 患者腸道內產生丁酸的羅氏菌屬(Roseburia) 豐度下降,而乳桿菌屬(Lactobacillus)富集,與血糖增量呈正相關[22]。
2.3 腸道微生物與高血壓(hypertension,HTN)
基于人群及動物模型的研究表明,HTN 與腸道菌群組成、豐富度、多樣性及代謝產物短鏈脂肪酸密切相關。 研究表明,短鏈脂肪酸(SCFA)影響宿主代謝和炎癥反應,同時SCFA 可以抑制血管擴張,從而降低HTN[34]。 另一項研究發現,自發性高血壓大鼠的腸道微生物豐富度,多樣性降低,F/B 比值有所提高產生乙酸鹽和丁酸鹽的細菌(放線菌和雙歧桿菌)減少,而產生乳酸的細菌增多[23]。 一項類似的研究表明,補充丙酸鹽可以有效地減少HTN,炎癥反應和心臟損傷[35]。
某些廠家窖泥制作原料土腐殖質含量較高[7],呈褐色,與老窖泥的顏色相近,如3年窖泥中2號和3號樣品雖然年份較短,卻無本色。
2.4 腸道微生物與非酒精性脂肪肝(nonalcoholicfatty liver disease,NAFLD)
許多動物模型實驗表明腸道微生物群及其代謝物在NAFLD 的發病中也起著重要的作用。 Le Roy 等[24]發現,將NAFLD 小鼠的糞便微生物群移植到野生型小鼠體內會導致NAFLD。 另一項研究發現,患有脂肪肝的肥胖小鼠糞便移植到無菌小鼠后,肝甘油三酯(triglyceride,TG)水平升高且與脂肪生成相關基因表達上調。 最近一項研究發現,肝脂肪變性小鼠盲腸內容物厚壁菌門(Firmicutes)和疣微菌(Verrucomicrobia) 增加,導致結合型膽汁酸(Conjugated bile acids,CBA)的增加,從而發展為肝脂肪 變 性[25]。 已 有 研 究 表 明, 腸 道 微 生 物 與NAFLD 密切相關,但哪種菌屬會引起NAFLD 還需進一步研究。
2.5 腸道微生物與高血脂
高血脂是代謝紊亂的常見癥狀,通常伴隨肥胖、高血壓、2 型糖尿病和非酒精性疾病。 高血脂是動脈粥樣硬化性心血管疾病的主要因素。 研究指出,高脂肪和高膽固醇飲食以各種方式改變腸道微生物菌群,如降低厚壁菌門(Firmicutes)與擬桿菌門(Bacteroidetes)的比例、減少α 多樣性、抑制產SCFA的細菌等。 推斷腸道微生物與高血脂有關。 Yan等[26]研究發現,對高脂血癥小鼠灌胃益生菌發酵米蕎麥,能降低厚壁菌門(Firmicutes) 與擬桿菌門(Bacteroidetes)的比例,增加產SCFA 的細菌,抑制肝膽固醇合成和脂肪生成并促進脂肪分解,從而改善高血脂。 An 等[36]研究表明,豆豉通過調節腸道菌群來調節脂質代謝,降低血清炎癥因子水平起到抗高血脂的作用。
2.6 腸道微生物與癌癥
癌癥是一種異常細胞無限增生的疾病,是全世界各種代謝性疾病中死亡率最高的疾病之一。 多項研究表明,胃癌、大腸癌等多種癌癥的發生、發展與腸道微生物菌群相關。 研究發現,幽門螺桿菌通過細胞毒素影響胃癌的進展[27]。 結直腸癌患者體內產生SCFA 的有益菌水平較低。 小鼠模型中膳食纖維以微生物和丁酸鹽依賴的方式預防結直腸腫瘤[28]。 最近一項研究顯示,與健康人相比,肺癌患者腸道中普拉梭菌、普雷沃氏菌、羅氏菌、罕見小球菌等產SCFA 和抗炎細菌的數量減少,而一些致病菌則更為富集[37]。
3 腸道微生物影響代謝性疾病的機制分析
3.1 影響能量平衡
影響能量平衡的機制主要包括以下幾個方面(圖1)。

圖1 腸道微生物及其代謝產物影響能量平衡Figure 1 Gut microbes and their metabolites affect energy balance
3.1.1 影響能量攝入
SCFA 被認為通過刺激腸道激素的釋放來調節食欲。 研究表明,中樞神經系統中的SCFA 對能量穩態有直接影響。 在中樞神經系統中,下丘腦的弓狀核(arcuate nucleus,ARC)是調節食欲信號的關鍵核,ARC 中有2 個神經元群體接收營養狀態信號:阿片促黑色素原和可卡因-安他非明轉錄調節肽( pro-opiomelanocortin/cocaine and amphetamine regulated transcript,POMC/CART)和刺鼠相關蛋白和神經肽Y(agouti aelated peptide/neuropeptide Y,AgRP/NPY)的神經元。 在下游的二級神經元中,POMC/CART 和AgRP/NPY 神經元釋放信號分子與相應的受體競爭性結合,從而調節食欲來影響能量攝入[38-40]。
SCFA 是G 蛋白偶聯受體(G protein-coupled receptors,GPCRs)的配體,在腸道內L 分泌細胞中表達。 有研究表明,SCFA 與結腸細胞中的特異性G蛋白偶聯受體GPR-41、GPR-43 結合,刺激腸激素釋放胰高血糖素樣肽-1(glucagon-like peptide-1,GLP-1)和肽YY(peptide YY,PYY),GLP-1 和PYY 穿過血腦屏障與中樞神經系統中的受體結合并調節POMC/CART 或AgRP/NPY 神經元狀態,從而作用于腸-腦軸來促進腸蠕動和營養吸收[38,41]。 另一項研究表明,SCFA 也可以通過迷走神經影響能量攝入。 SCFA 增加[Ca2+]i,鈣水平升高影響肌醇1,4,5-三磷酸受體(inositol 1,4,5-triphate recepto,IP3R)和蘭尼堿受體(ryanodine receptor,RyR),產生鈣波,將信號傳遞到中樞神經系統并促進神經遞質的釋放,從而影響能量攝入[38,42]。 最近的一項研究表明,調節腸道菌群及代謝產物能激活腸道AMPKa1,從而促進棕色脂肪組織的產熱[43]。
3.1.2 影響能量消耗
當機體內能量攝入超過能量消耗時促進各種代謝性疾病的發展。 研究表明,腸道微生物代謝產物SCFA 和BA 具有調節能量消耗的作用。 研究發現,BA 能夠通過法尼醇X 受體(farnesoid X receptor,FXR) 和G 蛋白偶聯膽汁酸受體1(G protein-coupled bile acid receptor, GPBAR1, 又 稱TGR5)調節脂質的積累[34,44]。 BA 與TGR5 結合導致cAMP 積累,cAMP 激活蛋白激酶A(protein kinase A,PKA),從而調節能量消 耗[34]。 Parséus等[44]研究發現,腸道微生物菌群以FXR 依賴的方式促進體重增加和肝脂肪變性。
此外,研究發現,從腸道吸收的SCFA 進入靜脈并轉到肝,激活AMPK 途徑,降低過氧化物酶體增殖物 激 活 受 體-γ (peroxisome proliferator-activated receptor γ,PPARγ)活性和增加過氧化物酶體增殖物 激 活 受 體-α ( peroxisome Proliferator-Activated Receptor-Alpha,PPARα)活性,導致解偶聯蛋白2(uncoupling protein,UCP2)的上調表達,從而增加能量 消 耗[45]。 Luo 等[46]發 現, 高 脂 飲 食 誘 導 的NAFLD 小鼠灌胃阿魏酸能通過激活PPARα,增加能量消耗并減少肝中TG 的積累來有效預防NAFLD。 說明,腸道微生物代謝產物SCFA 和BA在維持機體能量平衡中發揮著重要作用。
3.2 影響葡萄糖穩態
腸道微生物衍生的SCFA 和BA 以多種方式影響葡萄糖穩態,見圖2。 研究表明,SCFA 可作為底物前體參與糖異生。 例如:肝中,丙酸鹽可通過生物素轉化為琥珀酰輔酶a 參與TCA 循環,增加草酰乙酸,從而促進糖異生[38]。 研究發現,SCFA 可激活游離脂肪酸受體3(free fatty acid receptor 3,FFAR3)刺激內分泌細胞釋放腸激素PYY,增強肌肉和脂肪組織對葡萄糖的吸收[47]。 Barrera 等[48]研究發現,SCFA 能夠激活游離脂肪酸受體2(free fatty acid receptor 2,FFAR2),促進其分泌GLP-1,增加胰島素的釋放。 最近研究表明,膳食補充丁酸鹽或丙酸鹽可改善飲食誘導肥胖小鼠的葡萄糖耐量和胰島素敏感性[49]。 另一項研究發現,在遺傳性肥胖糖尿病db/db小鼠中補充丁酸鹽并沒有改善HFD 誘導的體重增加,但改善了血糖和胰島素[50]。 此外,葡萄糖穩態與AMPK 的激活有關。 Hardie 等[51]指出在骨骼肌中AMPK 激活,抑制糖原和蛋白質合成,促進葡萄糖轉運和脂肪酸氧化。 Sakakibara 等[52]發現在肝中,AMPK 激活降低了葡萄糖6 -磷酸酶(glucose-6-phosphatase,G6Pase)和磷酸烯醇丙酮酸羧 基 激 酶 ( phosphoenolpyruvate carboxykinase,PEPCK)基因表達。
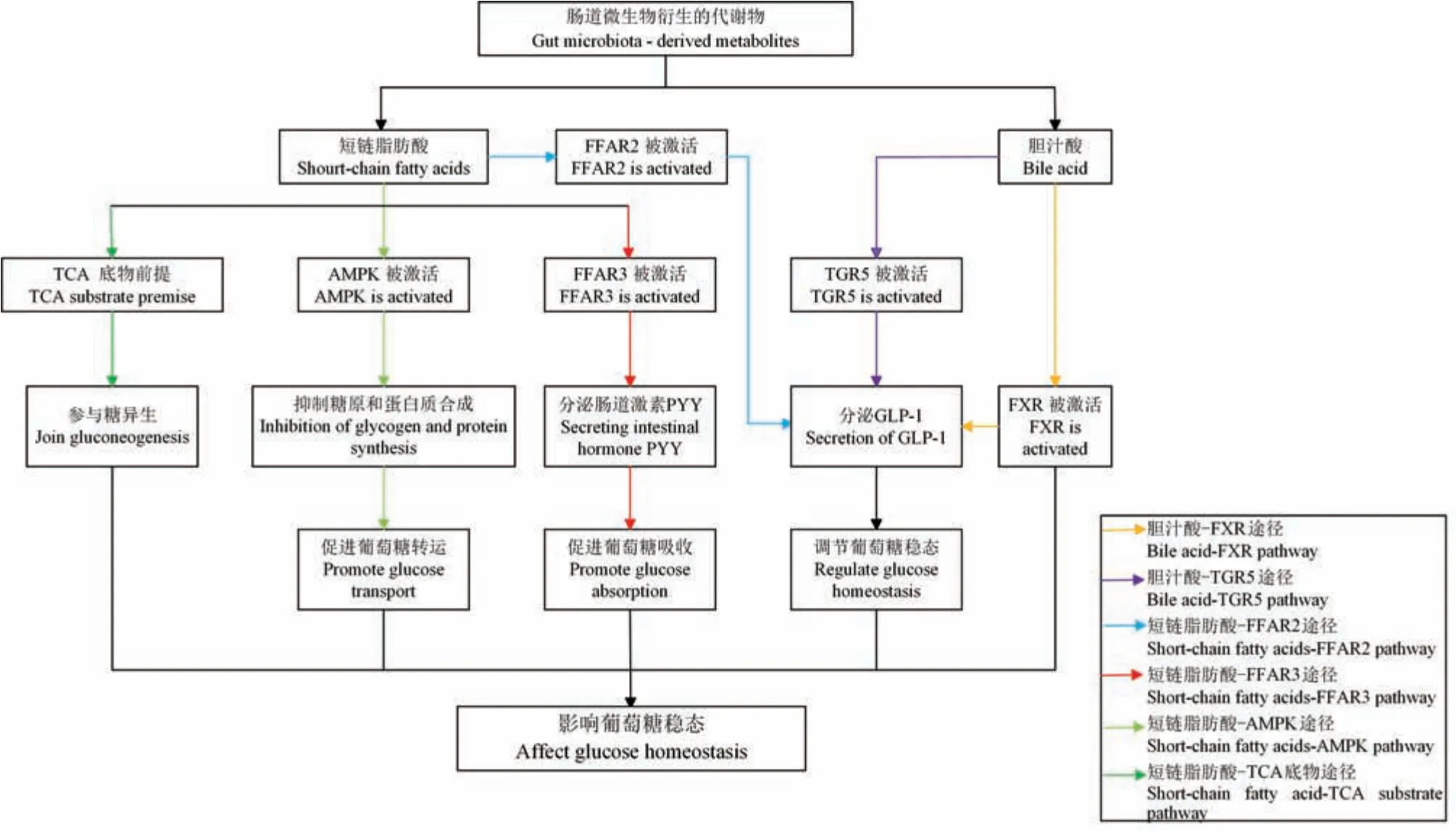
圖2 腸道微生物及其代謝物影響葡萄糖穩態的方式Figure 2 Ways in which gut microbes and their metabolites influence glucose homeostasis
此外,研究證明,BA 能夠通過激活TGR5 增加GLP-1 的合成,從而增加棕色脂肪和肌肉組織能量消耗,增加胰高血糖素樣肽來調節葡萄糖穩態[53]。繁殖或喂食高脂肪飲食的遺傳性肥胖小鼠中FXR缺陷可以預防,并改善葡萄糖平衡[44],表明FXR 能夠抑制GLP-1 合成[53]。 因此,目前研究表明TGR 5和FXR 對GLP-1 信號傳導具有相反作用。
3.3 增強腸道屏障功能
腸道微生物失調導致腸道屏障損壞和通透性增加。 研究表明,zonulin 家族作為調節腸道通透性的蛋白質,與多種自身免疫性和代謝性疾病相關[54]。 研究發現,產生丁酸鹽的腸道細菌能夠通過降低zonulin 水平和炎癥來改善腸道通透性[55]。 丁酸鹽能夠通過上調ZO1 和claudin-1 的表達改善腸膜 的 完 整 性[56]。 鞭 毛 蛋 白、 脂 多 糖(lipopolysaccharide,LPS)和肽聚糖能夠通過與腸細胞上的Toll 樣受體(toll-like receptors,TLR)結合并誘導抗菌蛋白的產生,進而加強腸道屏障[57]。SCFA 能夠抑制LPS 誘導的NLRP3 炎性體的激活和自噬來保護腸道屏障功能[58]。 最近研究表明,腸道微生物代謝產物吲哚-3-丙酸(3-Indolepropionic acid,IPA)能夠通過激活異生素傳感器孕烷X 受體(pregnane X receptor,PXR)調節腸屏障功能,進一步抑制TLR 4 信號通路[59]。 因此,腸道微生物及其代謝產物可以通過zonulin 家族或調節相關信號通路來改善腸道屏障通透性。
3.4 調節炎癥反應
慢性炎癥是引發各種代謝性疾病的關鍵因素。研究表明腸道微生物代謝產物SCFA、BA、IPA、吲哚-3 甲醛(indole-3-carboxaldehyde,I3A)等具有抗炎作用。 SCFA 可以通過游離脂肪酸受體(free fatty acid receptor,FFAR)和組蛋白去乙酰化酶(histone deacetylases,HDAC)抑制LPS 誘導的炎癥。 Masui等[60]研究發現醋酸鹽能夠通過激活FFAR 受體抑制LPS 誘導的小鼠和人類單核細胞分泌TNF-α。丁酸鹽和丙酸鹽抑制TNF-α 的分泌和NF-κB 的活性。 同時HDAC 能夠抑制因LPS 激活而上調的單核細胞和中性粒細胞中抗炎因子IL-10 的表達[47]。Biagioli 等[61]研究發現ACE2 以GPBAR1(也稱為TGR5)依賴的方式調節腸道炎癥,這種調節是由GPBAR1-GLP-1 軸介導的。 肝細胞在脂質負荷下,I3 A 能夠依賴芳香烴受體(Aryl hydrocarbon receptor,AhR)的方式減弱炎癥反應,同時降低脂肪酸合酶和固醇調節元件結合蛋白-1c (sterol regulatory element binding protein 1 c,SREBP-1c)的表達[62]。 此外,Zhao 等[63]研究發現IPA 能夠抑制NF-κB 信號傳導,降低促炎細胞因子TNFα、IL-1β和IL-6 的含量,從而抑制肝炎癥和肝損傷。
3.5 對免疫系統的影響
3.5.1 對Treg 和Th17 細胞的影響
正常情況下,宿主免疫反應與健康的腸道菌群保持平衡的穩態關系[64]。 腸道菌群的變化可導致慢性免疫應答和多種代謝疾病。 腸道微生物通過促進CD4+T 細胞不同亞群的生成(Th17 和Treg 細胞等),參與癌癥、2 型糖尿病及全身慢性炎癥等多種 疾 病 的 發 病[64]。 研 究 發 現, 炎 癥 性 腸 病(inflammatory bowel disease,IBD)患者的發炎腸粘膜和外周血CD4+T 細胞中G 蛋白偶聯受體65(G protein-coupled receptor 65,GPR65)的表達增加,會顯著促進CD4+T 細胞分化為Th1 和Th17 細胞,并提高Th17 的致病性并誘導T 細胞凋亡[65]。 此外,在肥胖人群和T2DM 患者的脂肪組織中觀察到Th17 細胞富集和Treg 細胞減少[66],Th17 細胞通過分泌IL-17、IL-22、IL-6 等細胞因子,介導促炎作用,而Treg 細胞具有抗炎作用,可以下調不同Th 細胞的激活和發展[66-67]。 因此,腸道中異常微生物的定植可以使不同類型的T 細胞之間產生不平衡,隨之發生免疫失調,促進各種疾病的發生和發展。
3.5.2 對分泌型免疫球蛋白 A ( secretory immunoglobulin A,SIgA)的影響
如圖3 所示,SIgA 是腸道粘膜表面的重要防御線,對腸毒素和外源入侵的病原微生物等都有抵抗作用[68]。 腸道微生物群、腸道細胞因子、營養素等多種因素參與腸道中SIgA 的產生[67]。 在小鼠和人類中,以SIgA 為靶標能共價靶向塑造腸道微生物群組成,調節細菌行為,并增強宿主-微生物穩態,從而影響疾病的發展[69]。 Zhou 等[70]研究發現四柱頭多糖通過增加回腸分泌的SIgA 和盲腸SCFA 的含量,改善微生物群落多樣性,同時恢復了腫瘤引起的腸道菌群紊亂。
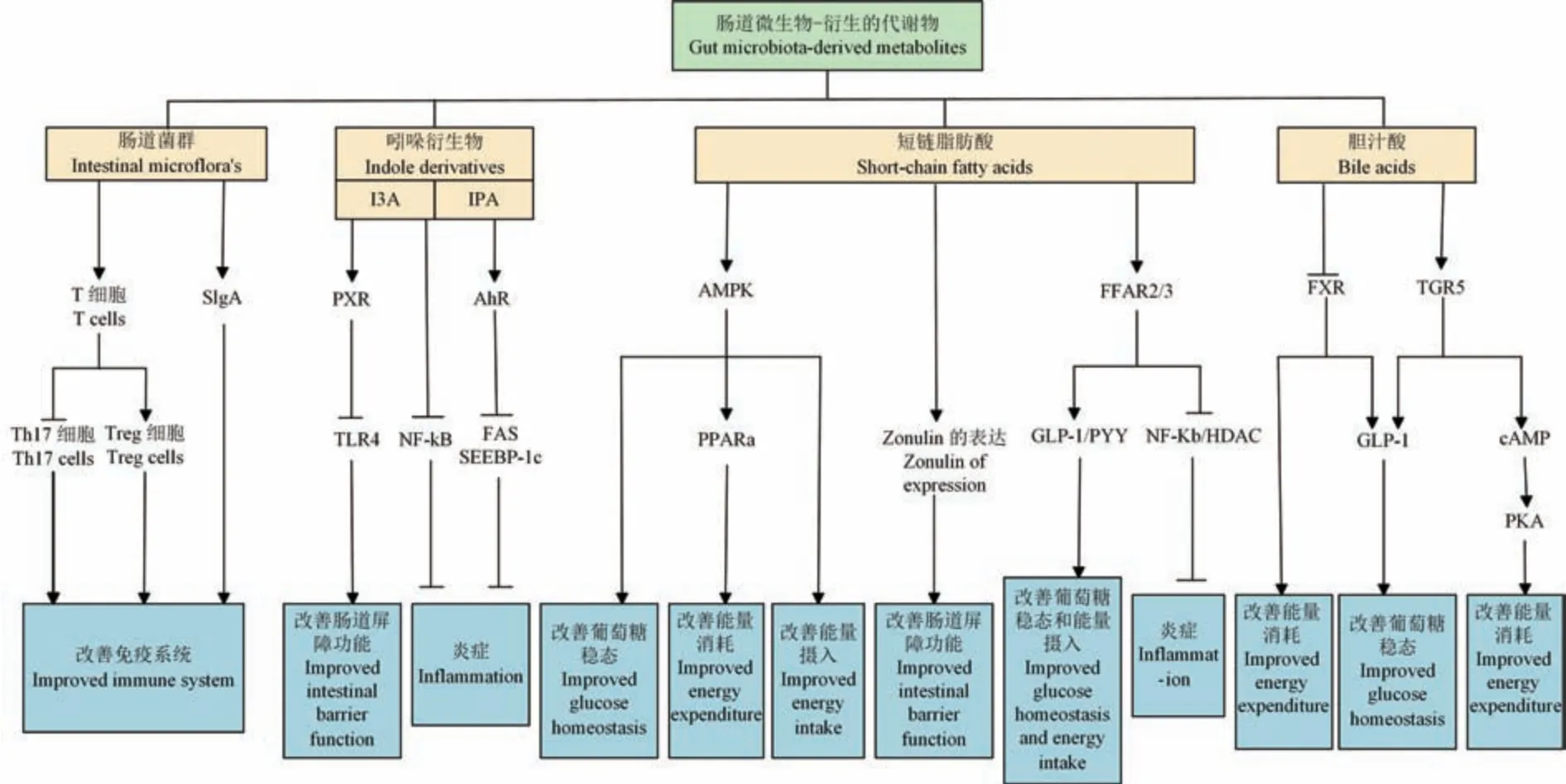
圖3 腸道微生物參與代謝性疾病的發展Figure 3 Gut microbes are involved in the development of metabolic diseases
綜上所述,腸道微生物群組成的變化改變了其代謝產物的特征,并最終導致肥胖相關代謝性疾病的發生和發展。 變化的腸道菌群以及代謝產物直接或間接與免疫細胞、腸上皮細胞、肝細胞等中的宿主信號分子相互作用,以調節炎癥、能量平衡、糖代謝、免疫系統以及增強腸道屏障功能。
4 總結與展望
腸道微生物菌群被稱為“特殊的人體器官”,在肥胖、高血壓、2 型糖尿病、癌癥等多種代謝性疾病中發揮著至關重要的作用。 一方面,腸道微生物及其代謝產物在個體內失衡會導致肥胖及相關代謝性疾病的發生;另一方面,腸道微生物及其代謝產物能夠通過調節慢性炎癥、改善腸道通透性、影響能量平衡、葡萄糖穩態和免疫系統等多種機制來發揮對代謝性疾病的調節作用。 因此,研究腸道微生物及其代謝產物與機體健康之間的關系可以為代謝性疾病的治療提供重要方向。 目前,雖然有大量動物實驗證明腸道微生物群在疾病發生發展中發揮著重要作用,但腸道微生物與各種代謝性疾病之間的因果關系仍需進一步進行大量臨床試驗來證明。 此外,各菌屬對宿主的具體作用機制尚不明確,還需進一步研究各菌屬在疾病中的各種代謝機制。

