基于RPA/CRISPR-Cas12a技術的單核細胞增生李斯特菌快速檢測方法建立
陳大偉 李兵兵 魏明月 李雙姝 楊鵬飛 劉靚

摘 要:建立基于RPA/CRISPR-Cas12a技術單核細胞增生李斯特菌的快速檢測方法。選取單增李斯特菌溶菌素毒力基因hly(GeneID:987033),設計重組酶聚合酶擴增(recombinase polymerase amplification,RPA)引物結合CRISPR-Cas12a蛋白研制兩步法單增李斯特菌快速檢測試劑盒,并對其靈敏度、特異性以及反應速率進行分析。結果表明:該法檢測速率快,30 min內可檢出單核細胞增生李斯特菌,同時具有較高的靈敏度,20 μL體系可檢測到最低0.0015 ng靶標核酸。將該試劑盒進一步用于檢測人工模擬污染食品三文魚肉片,檢測限可達10 CFU/mL。本方法檢測30 份實際樣本,結果均與熒光定量聚合酶鏈式反應法陽性檢出率一致。RPA/CRISPR-Cas12a技術是快速檢測食源性單增李斯特菌的可行方法。
關鍵詞:單核細胞增生李斯特菌;重組酶聚合酶擴增;CRISPR-Cas12a;快速檢測
Development of a Rapid Detection Method for Listeria monocytogenes Based on Recombinase Polymerase Amplification Combined with CRISPR-Cas12a Technology
CHEN Dawei, LI Bingbing, WEI Mingyue, LI Shuangshu, YANG Pengfei, LIU Liang*
(Huai’an Center for Disease Control and Prevention, Jiangsu Provincial Key Laboratory for Food Safety Risk Monitoring
(Pathogenic Bacteria), Huai’an 223003, China)
Abstract: Objective: To develop a rapid detection method for Listeria monocytogenes based on clustered regularly interspaced short palindromic repeats (CRISPR)/CRISPR associated protein 12a (Cas12a) combined with recombinase polymerase amplification (RPA). Methods: The virulence gene hly (GeneID: 987033) of L. monocytogenes was selected to design RPA primers, and a two-step rapid detection kit for L. monocytogenes was developed using RPA combined with CRISPR-Cas12a. The sensitivity, specificity, and reaction rate of the kit were analyzed. Results: This method was rapid and sensitive; it could detect L. monocytogenes within 30 minutes, and the minimum level of the target nucleic acid of 0.0015 ng
was detected using 20 μL of the system. Furthermore, when this kit was applied to detect artificially contaminated salmon fillets, the limit of detection was 10 CFU/mL, and the results for 30 actual samples were consistent with the positive detection rate obtained by fluorescence quantitative PCR. Conclusion: RPA combined with CRISPR-Cas12a is a feasible method for rapid detection of foodborne L. monocytogenes.
Keywords: L. monocytogenes; recombinase polymerase amplification; clustered regularly interspaced short palindromic repeats (CRISPR)-CRISPR associated protein 12a; fast detection
DOI:10.7506/rlyj1001-8123-20230710-066
中圖分類號:Q783.1? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼:A 文章編號:1001-8123(2023)09-0046-06
引文格式:
陳大偉, 李兵兵, 魏明月, 等. 基于RPA/CRISPR-Cas12a技術的單核細胞增生李斯特菌快速檢測方法建立[J]. 肉類研究,
2023, 37(9): 46-51. DOI:10.7506/rlyj1001-8123-20230710-066.? ? http://www.rlyj.net.cn
CHEN Dawei, LI Bingbing, WEI Mingyue, et al. Development of a rapid detection method for Listeria monocytogenes based on recombinase polymerase amplification combined with CRISPR-Cas12a technology[J]. Meat Research, 2023, 37(9): 46-51. (in Chinese with English abstract) DOI:10.7506/rlyj1001-8123-20230710-066.? ? http://www.rlyj.net.cn
李斯特菌屬是一種廣泛分布于食品和自然環境中的革蘭陽性菌。李斯特菌屬包含單核細胞增生李斯特菌(以下簡稱單增李斯特菌)、英諾克李斯特菌、伊氏李斯特菌、斯氏李斯特菌、威爾士李斯特菌、格氏李斯特菌等[1],其中單增李斯特菌和伊氏李斯特菌對人和動物具有致病性[2-3]。這類致病菌對易感人群可引起自然流產、新生兒敗血癥、腦膜腦炎等疾病[4]。李斯特菌分布廣泛,同時對極端環境的耐受性較強,因此在食品生產以及運輸的多個環節均可引起食品污染[5-6]。近年,國內外關于李斯特菌引起的食品污染事件也時有發生,因此,對李斯特菌進行有效監測對于保障人類健康、減少經濟損失、提高經濟效益具有重要的意義。
目前,用于李斯特菌的檢測方法主要有:1)培養法[7];2)免疫分析法,如酶聯免疫吸附和膠體金免疫層析法[8-9];3)基于聚合酶鏈式反應(polymerase chain reaction,PCR)技術的方法,如熒光定量PCR[10-11];
4)等溫擴增法,如環介導等溫擴增法[10]。培養法是“金標準”,準確度高但耗時費力,適用于對檢出速率要求低的場景。免疫法檢測速率相對較快,但是靈敏度相對較低,單克隆抗體的制備成本也較高,適用于實驗室內的快速篩查。PCR法以及等溫擴增法屬于核酸檢測方法,靈敏度高,但是PCR法需要特定的PCR儀器,等溫擴增法速率快不需要專門的PCR儀,但是等溫擴增由于擴增溫度相對較低,易產生非特異性擴增。規律成簇間隔短回文重復(clustered regularly interspaced shortpalindromic repeats,CRISPR)檢測是一種速率快、靈敏度高、不易產生非特異性,且不依賴于昂貴儀器的方法,更適用于現場的及時檢測。
CRISPR/CRISPR-associated protein(Cas)檢測技術是近年來發展迅速的核酸檢測技術,因其檢測速率快、特異性強、便捷性高,受到極大關注[12-14]。近年來,將CRISPR-Cas檢測技術與等溫擴增技術相結合用于各類細菌和病毒的檢測已有大量報道[15-16],兩種技術的結合既利用CRISPR-Cas檢測的高特異性和高靈敏度,又利用了等溫擴增的便捷性,非常適用于現場及時檢測。目前,將CRISPR-Cas檢測技術應用于單增李斯特菌的研究相對較少。李焓笑[17]以iap基因轉錄的RNA為靶標利用Cas13蛋白檢測單增李斯特菌;李凡[18]以LMOSLCC2755_0090基因為靶標進行重組酶聚合酶擴增(recombinase polymerase amplification,RPA)和CRISPR-Cas12a結合,利用電化學以及芯片等方法于一管內檢測單增李斯特菌。以RNA為靶標在實際應用中可能存在易降解的問題,且RNA的檢測環境要求較DNA高很多,不利于開展現場及時檢測。電化學以及芯片等方法是較前沿檢測方法,但也存在成本高、操作要求高等問題,用于現場及時檢測存在一定困難。
本研究基于CRISPR-Cas12a蛋白和RPA技術以單增李斯特菌特異性溶血酶毒素基因hly為靶標,建立二步法快速檢測單核細胞增生李斯特菌的檢測體系,將RPA和CRISPR檢測分開,結合可視化熒光報告探針,旨在提高檢測的靈敏度和節約成本,更合適于現場的快速檢測。
1 材料與方法
1.1 菌株與試劑
單增李斯特菌ATCC 19115、英諾克李斯特菌ATCC 33090、伊氏李斯特菌ATCC 19119、格氏李斯特菌ATCC 25401、威爾斯李斯特菌ATCC 35897、斯氏李斯特菌ATCC 35967、腸炎沙門氏菌ATCC 14028、金黃色葡萄球菌ATCC 29213、大腸桿菌MG1655均為本實驗室保存。
單增李斯特菌熒光定量檢測試劑盒(50 rxn)?上海伯杰醫療科技有限公司;TwistAmp Liquid Basic Kit(100 rxn) 英國TwistDx公司;轉錄試劑盒T7 High Yield RNA Transcription Kit(50 rxn) 南京諾唯贊生物科技股份有限公司;CRISPR-Cas12a蛋白(5 pmol/μL)? ?上海惠誠生物科技有限公司;NEB Buffer 3.1、NEB Buffer 4、NEB CutSmart Buffer、Buffer(均為10×)? ?New England Biolabs(北京)有限公司。
1.2 儀器與設備
3K15離心機 德國默克公司;ABIQ5實時熒光定量PCR儀、Qubit2.0熒光定量PCR儀 美國應用生物系統公司;DH209L電熱恒溫培養箱 天津泰斯特儀器有限公司;GelDoc XR Biorad凝膠成像系統 伯樂生命醫學產品(上海)有限公司;DK-320S三用恒溫水槽 上海精宏實驗設備有限公司。
1.3 方法
1.3.1 菌株活化和菌液制備
將凍存的單增李斯特菌菌種在常溫下解凍,并通過平板劃線法,在胰酪大豆胨瓊脂培養基上對其進行活化(37 ℃下恒溫培養18 h)。然后,選取單個典型菌落接種于胰蛋白胨大豆肉湯培養基中,在37 ℃下180 r/min恒溫振蕩培養24 h。吸取1 mL培養后的菌液于1.5 mL無菌離心管中,10 000 r/min離心3 min,除去上清液,用0.9%生理鹽水洗滌2 次并重懸,通過平板計數法確定菌落數。
1.3.2 引物合成
RPA引物用于擴增單增李斯特菌特異性毒力基因hly[19],轉錄引物用于將DNA轉錄成靶標crRNA,熒光探針ssDNA用于指示反應,引物均由生工生物工程(上海)股份有限公司合成。RPA引物和crRNA設計在https://ezassay.com/primer完成。轉錄引物合成后參照轉錄試劑盒T7 High Yield RNA Transcription Kit方法將DNA轉錄成crRNA備用。所用引物序列如表1所示。
1.3.3 RPA/CRISPR-Cas12a檢測體系的構建
利用水煮法提取單增李斯特菌的DNA,根據TwistAmp Liquid Basic Kit說明方法擴增單增李斯特菌DNA;擴增體系:5 μL 5×反應緩沖液、1.25 μL醋酸鎂溶液(280 mmol/L)、引物各1 μL、模板5 μL、11.75 μL RNase-free ddH2O2,于37 ℃恒溫擴增15 min,擴增產物備用。20 μL檢測體系[21]:1 μL CRISPR-Cas12蛋白溶液(5 pmol/μL)、2 μL crRNA (2 pmol/μL)、5 μL RPA擴增產物、2 μL NEB Buffer 4、2 μL ssDNA(10 pmol/μL)、8 μL RNase-free ddH2O2。根據實驗需求在此檢測體系基礎上進行優化。
1.3.4 人工污染樣品檢測
取10 g三文魚肉樣品切碎后與90 mL無菌生理鹽水(0.9 g/100 mL NaCl)混合,然后以中速均質15 min。在900 μL勻漿中加入不同濃度的單增李斯特菌,振蕩混勻,使其終濃度分別達到101、102、103、104 、105 CFU/mL。配制的加標樣品以500 r/min低速離心30 s,以去除大顆粒食品顆粒,上清液通過煮沸法提取核酸,用RPA/CRISPR-Cas12a檢測體系進行檢測,每個樣品設置3 個平行。
1.3.5 市售樣品的檢測
考慮到市售樣品檢出單增李斯特菌的可能性較小,設置加標樣。市售30 份三文魚樣品隨機抽取3 份分別接種一定量的單增李斯特菌、大腸桿菌和腸炎沙門氏菌。參照GB 4789.30—2016《食品安全國家標準 食品微生物學檢驗 單核細胞增生李斯特氏菌檢驗》[22]的方法進行增菌處理,然后按照1.3.3的方法提取核酸用于檢測,一組檢測的控溫過程在三控恒溫水浴鍋中完成進行PA/CRISPR-Cas12a檢測,另一組在熒光定量PCR儀內完成。
1.4 數據處理
使用Origin 8.0軟件作圖,使用SPSS 24.0軟件進行統計學分析。涉及熒光檢測實驗部分均重復3 次,使用配對χ2檢驗(McNemar檢驗),當雙尾P<0.05判定差異有統計學意義。
2 結果與分析
2.1 RPA引物特異性驗證
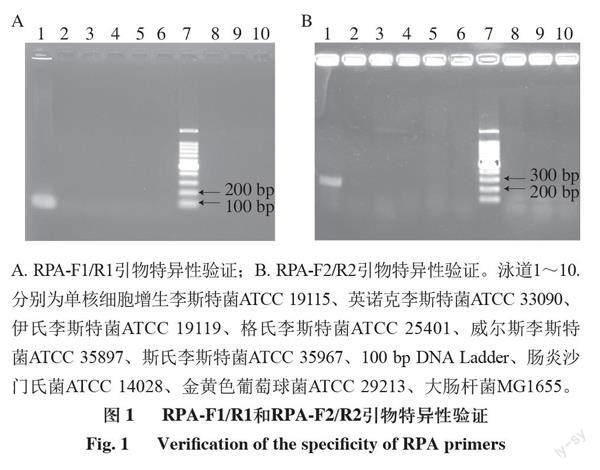
鑒于李斯特菌屬包含多種李斯特菌,而引起人類致病的只有單增李斯特菌,因此根據單增李斯特菌已報道的毒力基因hly序列和LMOSLCC2755_0090基因設計單增李斯特菌特異性擴增引物RPA-F1、RPA-R1和RPA-F2、RPA-R2。常見的食源性致病菌除單增李斯特菌,還有大腸桿菌、沙門氏菌、金黃色葡萄球等,所以選取單增李斯特菌ATCC 19115、英諾克李斯特菌ATCC 33090、伊氏李斯特菌ATCC 19119、格氏李斯特菌ATCC 25401、威爾斯李斯特菌ATCC 35897、斯氏李斯特菌ATCC 35967、腸炎沙門氏菌ATCC 14028、金黃色葡萄球菌ATCC 29213、大腸桿菌MG1655標準菌株作為檢測對象。由圖1A、B可知,當DNA模板為單增李斯特菌時,RPA-F1/R1引物對和RPA-F2/R2引物對才顯示出111 bp和247 bp DNA擴增條帶,同時其他李斯特菌以及大腸桿菌、沙門氏菌和金黃色葡萄球菌無擴增條帶,說明hly基因和LMOSLCC2755_0090基因是單增李斯特菌所特有,且引物特異性良好,可以用于富集單增李斯特菌特有DNA片段。鑒于hly基因擴增片段相對較短,等溫擴增時間較短,所以選用RPA-F1/R1引物用于后續實驗。
A. RPA-F1/R1引物特異性驗證;B. RPA-F2/R2引物特異性驗證。泳道1~10.分別為單核細胞增生李斯特菌ATCC 19115、英諾克李斯特菌ATCC 33090、伊氏李斯特菌ATCC 19119、格氏李斯特菌ATCC 25401、威爾斯李斯特菌ATCC 35897、斯氏李斯特菌ATCC 35967、100 bp DNA Ladder、腸炎沙門氏菌ATCC 14028、金黃色葡萄球菌ATCC 29213、大腸桿菌MG1655。
2.2 RPA/CRISPR-Cas12a檢測體系的優化
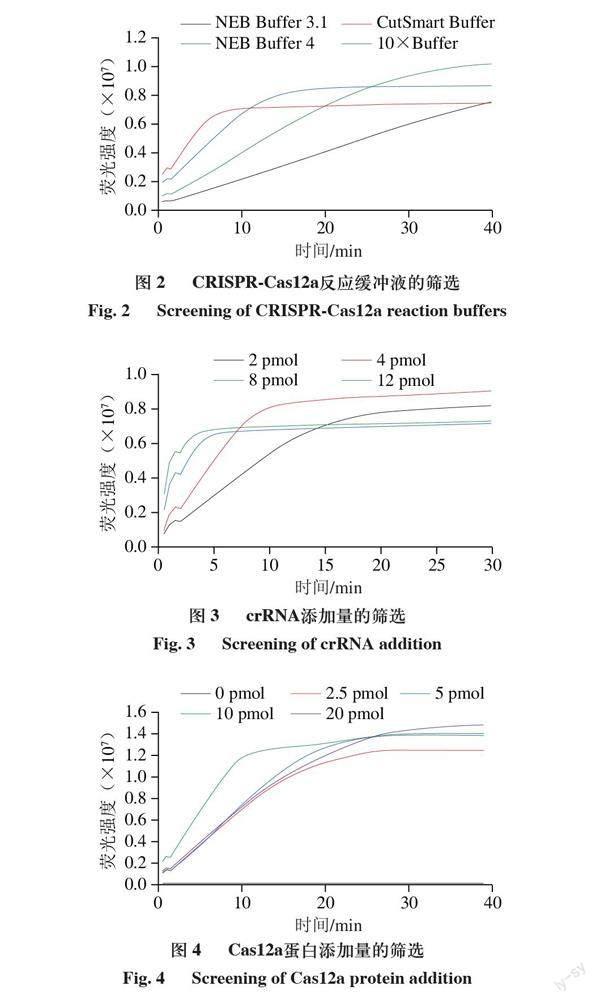
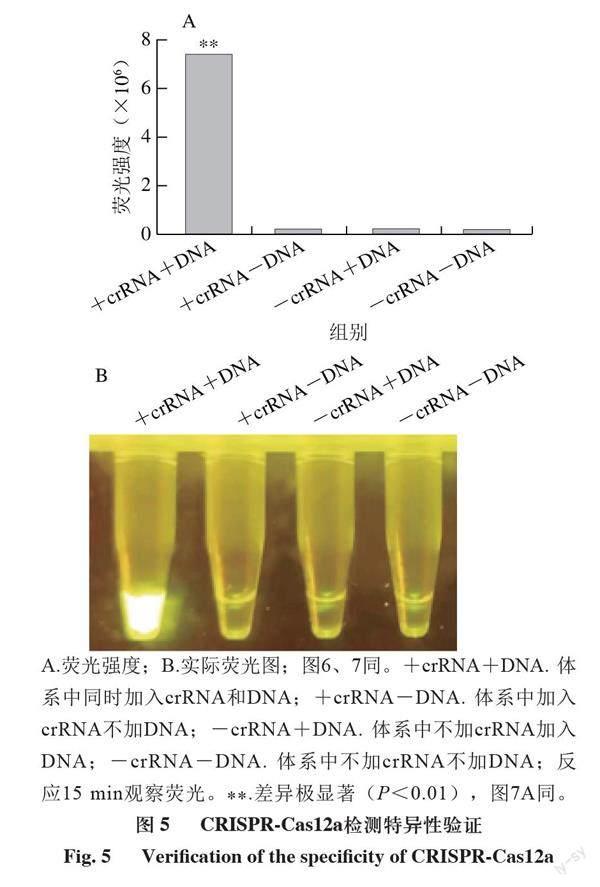
轉錄出crRNA對整個檢測體系的可行性進行驗證,取5 μL RPA擴增產物加入CRISPR-Cas12a檢測體系,通過預實驗發現該方法可以檢測單核細胞增生李斯特菌。在此基礎上對檢測體系的反應緩沖液、crRNA濃度、蛋白濃度作適當優化。由圖2可知,在NEB Buffer 3.1、NEB Buffer 4、NEB CutSmart Buffer、Cas12a酶自帶的反應緩沖液10×Buffer中,在NEB Buffer 4中反應速率較快,同時熒光信號強度也較高。由圖3可知,20 μL檢測體系中加入2、4、8、12 pmol的crRNA,觀察反應速率和信號強度,當Cas12a蛋白與crRNA的濃度比約為1∶1時,體系中加入4 pmol crRNA時反應速率和信號強度較好。由圖4可知,Cas12a蛋白濃度對檢測體系影響較小,選擇與crRNA濃度接近1∶1的添加量,即5 pmol/μL。由于體系在藍光下有肉眼可見的熒光,因此未對熒光探針量進行優化。實驗確定最佳的檢測體系為5 μL RPA產物、2 μL 10×NEB Buffer 4、4 pmol crRNA、5 pmol Cas12a蛋白、20 pmol熒光探針。
2.3 RPA/CRISPR-Cas12a檢測特異性和靈敏度驗證
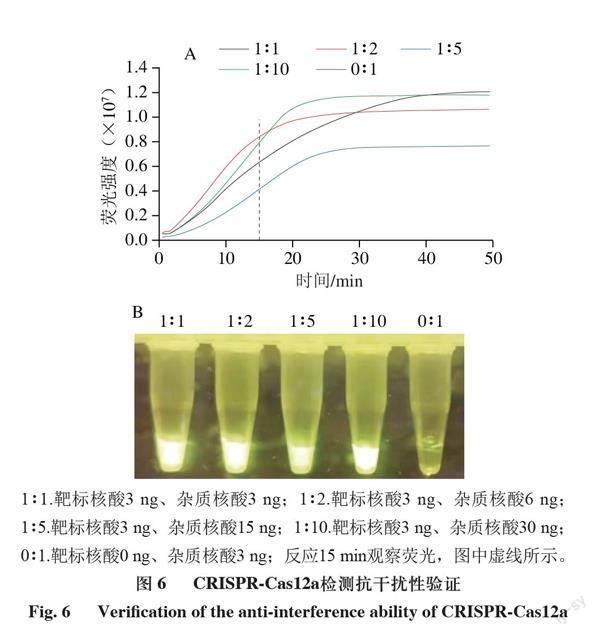
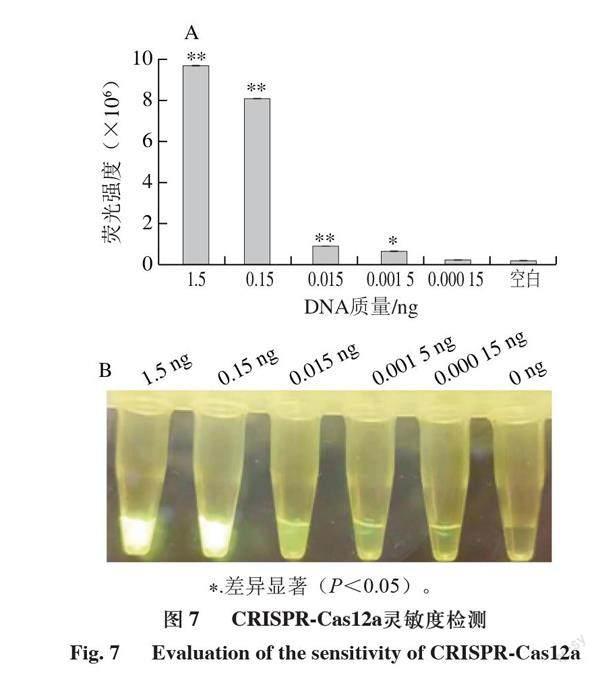
進一步測試該檢測體系的特異性和靈敏度。由圖5可知,只有當靶標DNA和crRNA同時存在時體系才能產生熒光,說明檢測體系特異性高;由圖6可知,在體系中加入不同濃度的干擾核酸不影響檢測體系識別靶標DNA,說明檢測體系抗干擾能力強。由圖7可知,向體系內加入最低0.0015 ng DNA時仍能檢測出熒光值的變化,說明該體系具有很高的靈敏度。
A.熒光強度;B.實際熒光圖;圖6、7同。+crRNA+DNA. 體系中同時加入crRNA和DNA;+crRNA-DNA. 體系中加入crRNA不加DNA;-crRNA+DNA. 體系中不加crRNA加入DNA;-crRNA-DNA. 體系中不加crRNA不加DNA;反應15 min觀察熒光。**.差異極顯著(P<0.01),圖7A同。
2.4 實際樣品的檢測
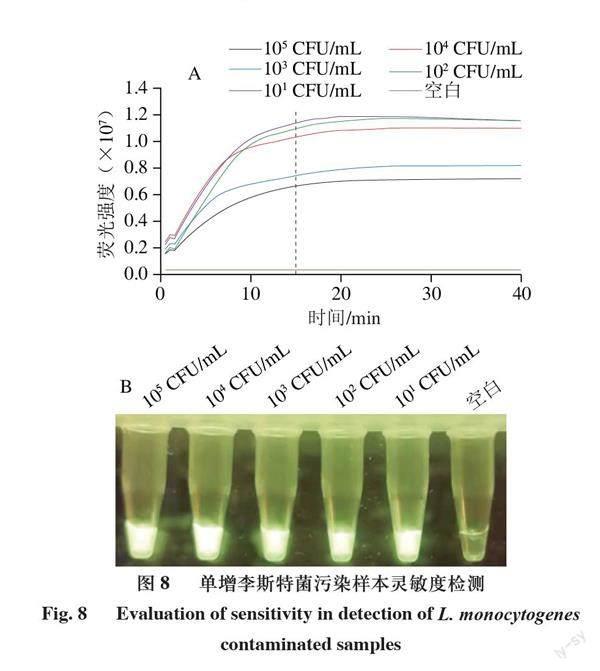
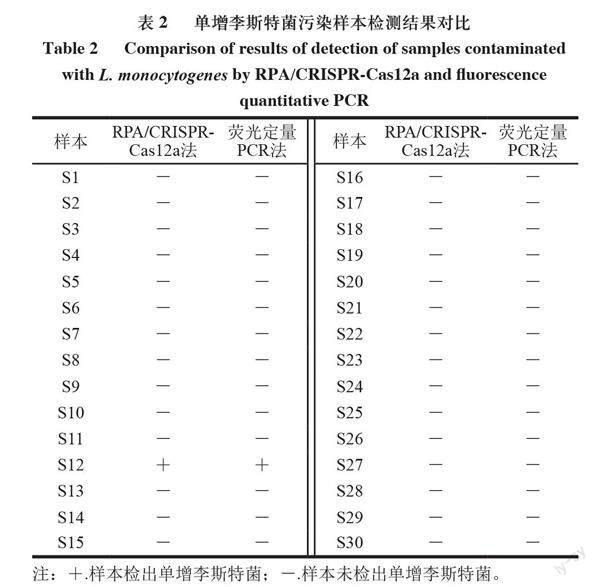
單增李斯特菌不耐高溫,生肉及肉制品較易污染。用已建立的單增李斯特菌RPA/CRISPR-Cas12a檢測體系檢測了人工模擬污染李斯特菌的生三文魚肉片,由圖8可知,污染105、104、103、102、10 CFU/mL單增李斯特菌的三文魚肉片在檢測體系中反應15 min時均顯示出肉眼可見的強熒光。說明該檢測體系可檢測低至10 CFU/ml單增李斯特菌污染的三文魚肉片。以熒光定量PCR為對照檢測30 份盲樣,結果如表2所示。RPA/CRISPR-Cas12a法檢出其中1 份陽性樣本,與熒光定量PCR方法檢出結果一致,添加了大腸桿菌和腸炎沙門菌的樣本兩種方法均沒有熒光信號,表明方法的檢測特異性很強。結果表明建立的單增李斯特菌檢測體系可以用于檢測實際污染單增李斯特菌樣本。
3 結 論
本研究建立一種基于RPA和CRISPR-Cas12a蛋白的單增李斯特菌檢測體系,只需在水浴鍋中RPA反應
15 min,然后取5 μL產物加入CRISPR-Cas12a檢測體系中反應15 min,富集擴增和檢測共需要30 min,非常適用于現場的快速檢測。人工污染樣本中,本研究建立的方法可檢測低至10 CFU/mL的樣本,能夠保證在污染初期即可檢出。在30 份盲樣檢測中,熒光定量法出現1 份較弱的非特異性擴增,而本研究方法沒有,可能是RPA擴增特異性和CRISPR-Cas12a檢測的特異性疊加更不易產生假陽性。添加大腸桿菌和沙門氏菌的盲樣兩種方法均未檢出,說明實際樣本檢測中兩種方法均不會受到其他食源性致病菌的影響。
RPA與CRISPR技術相結合的檢測方法由于其不需要昂貴的儀器、速率快、特異性強等特點近年來被廣泛研究[23-25]。RPA富集擴增靶標利用了其擴增的便捷性,CRISPR檢測技術特異性強,將兩種方法結合實現了檢測的便捷性和特異性。該方法雖具有很多優點,但仍存在需要改進的地方,如本研究中仍需借助擴增的方法富集核酸,核酸濃度過低時體系信號無法被足夠的放大,以及不能在一個體系中實現多重靶標的檢測等。目前關于該方法的一些問題,一些學者已嘗試改進,如不用核酸擴增富集,而是利用電化學方法[26-28]、數字PCR方法[29]、檢測信號放大等進行原位檢測[30-31]。這些方法在一定程度解決了上述問題,但在實際應用中還存在處理步驟繁瑣、成本過高等問題,還需進一步優化和研究。
參考文獻:
[1] Vitullo M, Grant K A, Sammarco M L, et al. Real-time PCRs assay for serogrouping Listeria monocytogenes and differentiation from other Listeria spp.[J]. Molecular and Cellular Probes, 2013, 27: 68-70. DOI:10.1016/j.mcp.2012.10.001.
[2] 郝歌, 錢映, 李蓉, 等. 單核細胞增生李斯特菌毒力基因及其致病機制的研究進展[J]. 中國食品衛生雜志, 2023, 35(3): 481-486. DOI:10.13590/j.cjfh.2023.03.026.
[3] 甘霖. 中國紅嘴鷗中單增李斯特菌及野生嚙齒動物中伊氏李斯特菌的研究[D]. 北京: 中國疾病預防控制中心, 2021: 78-90. DOI:10.27511/d.cnki.gzyyy.2020.000013.
[4] 焦穎, 張巍. 李斯特菌生物學特征與臨床相關性[J]. 中國感染與化療雜志, 2015, 15(5): 491-495. DOI:10.16718/j.1009-7708.2015.05.005.
[5] 楊超, 于濤, 姜曉冰. 綠色魏斯氏菌發酵液對單核細胞增生李斯特菌的抑制及其在冷卻豬肉保鮮中的應用[J]. 肉類研究, 2021, 35(4): 51-56. DOI:10.7506/rlyj1001-8123-20210323-079.
[6] 張園園, 周聰, 郭依萍, 等. 肉及肉制品中單核細胞增生李斯特菌交叉污染的研究進展[J]. 食品科學, 2022, 43(11): 293-300.DOI:10.7506/spkx1002-6630-20210505-026.
[7] 吳瑞英, 黃寶明, 梁均和. 單增李斯特菌選擇性增菌培養分離的初步探討[J]. 中國衛生檢驗雜志, 2007, 17(5): 854-855. DOI:10.3969/j.issn.1004-8685.2007.05.041.
[8] 黃偉華, 李倫, 陳超超, 等. 熒光免疫吸附法定量檢測單核細胞增生李斯特菌[J]. 衛生研究, 2019, 48(2): 279-283. DOI:CNKI:SUN:WSYJ.0.2019-02-018.
[9] 劉珊娜, 葛懷娜, 孟繁桐, 等. 李斯特菌免疫檢測用膠體金的制備及抗體標記[J]. 食品科技, 2016(1): 321-324. DOI:CNKI:SUN:SSPJ.0.2016-01-069.
[10] 林玉雙, 藍福勝, 廖燕萍, 等. 實時熒光PCR法和國標法檢測乳粉中單增李斯特菌的比較研究[J]. 食品安全質量檢測學報, 2020, 11(24): 9425-9429. DOI:10.19812/j.cnki.jfsq11-5956/ts.2020.24.061.
[11] 劉芳, 徐振娜, 洪偉彬, 等. 食品中單增李斯特菌熒光PCR檢測方法的建立[J]. 農村經濟與科技, 2017, 28(17): 84-85. DOI:CNKI:SUN:NCJI.0.2017-17-033.
[12] 陳歡, 王宇, 黃鈺, 等. 基于CRISPR/Cas系統的病原微生物檢測體系構建研究進展[J]. 微生物學報, 2022, 62(9): 3271-3288. DOI:10.13343/j.cnki.wsxb.20220023.
[13] GOOTENBERG J S, ABUDAYYEH O O, KELLNER M J, et al. Multiplexed and portable nucleic acid detection platform with Cas13, Cas12a, and Csm6[J]. Science, 2018, 360: 439-444. DOI:10.1126/science.aaq0179.
[14] 周旭, 王思文, 王秀榮. CRISPR-Cas12a在病原快速檢測中的應用[J]. 中國獸醫科學, 2022, 52(8): 1031-1037. DOI:10.16656/j.issn.1673-4696.2022.0145.
[15] 葛以躍, 蘇璇, 張倩, 等. CRISPR-Cas13a結合重組酶介導的擴增快速檢測副溶血性弧菌方法的建立[J]. 現代預防醫學, 2019, 46(20): 3777-3781. DOI:CNKI:SUN:XDYF.0.2019-20-030.
[16] LEI Rong, LI Limei, WU Pinshan. RPA/CRISPR/Cas12a-based on-site and rapid nucleic acid detection of Toxoplasma gondii in the environment[J]. ACS Synthetic Biology, 2022, 11(5): 1772-1781. DOI:10.1021/acssynbio.1c00620.
[17] 李焓笑. 基于CRISPR/Cas13a及RPA單增李斯特菌檢測方法的建立和應用[D]. 長春: 吉林大學, 2022: 40-60. DOI:10.27162/d.cnki.gjlin.2021.001736.
[18] 李凡. 致病性李斯特菌全基因組數據庫構建及基于CRISPR/Cas核酸檢測新技術研究[D]. 廣州: 華南理工大學, 2022: 140-180. DOI:10.27151/d.cnki.ghnlu.2021.003509.
[19] TANG Mengjun, ZHOU Sheng, ZHANG, Xiaoyan, et al. Rapid and sensitive detection of Listeria monocytogenes by loop-mediated isothermal amplification[J]. Current Microbiology, 2011, 63(6): 511-516. DOI:10.1007/s00284-011-0013-3.
[20] LI Fan, YE Qinghua, CHEN Moutong, et al. Multiplex PCR for the identification of pathogenic Listeria in Flammulina velutipes plant based on novel specific targets revealed by pan-genome analysis[J]. Frontiers in Microbiology, 2021, 11: 634255. DOI:10.3389/fmicb.2020.634255.
[21] Lü Hailong, WANG Jin, ZHANG Jian, et al. Definition of CRISPR Cas12a trans-cleavage units to facilitate CRISPR diagnostics[J]. Frontiers in Microbiology, 2021, 12: 766464. DOI:10.3389/fmicb.2021.766464.
[22] 國家食品藥品監督管理總局. 食品安全國家標準 食品微生物學檢驗 單核細胞增生李斯特氏菌檢驗: GB 4789.30—2016[S]. 北京: 中國標準出版社, 2016: 3-8.
[23] 張徐俞, 黃俊, 楊穩, 等. 重組酶聚合酶擴增結合CRISPR-Cas12a快速檢測十足目虹彩病毒1方法的建立[J]. 微生物學通報, 2021, 48(12): 4980-4988. DOI:10.13344/j.microbiol.china.210331.
[24] ZHI Shuai, SHEN Jinling, LI Xingang, et al. Development of recombinase-aided amplification (RAA)-exo-probe and RAA-CRISPR/Cas12a assays for rapid detection of Campylobacter jejuni in food samples[J]. Journal of Agricultural and Food Chemistry, 2022, 70(30): 9557-9566. DOI:10.1021/acs.jafc.2c02581.
[25] 雷榮, 孫夕雯, 江麗, 等. 丁香疫霉菌RPA/CRISPR-Cas12a快速檢測方法的建立[J]. 植物檢疫, 2022, 36(3): 31-38. DOI:10.19662/j.cnki.issn1005-2755.2022.03.006.
[26] 李凡, 韓堯, 李浩, 等. 基于CRISPR均相電化學生物傳感器檢測SARS-CoV-2和HIV-1方法的建立[J]. 軍事醫學, 2023, 47(5): 371-377. DOI:10.7644/j.issn.1674-9960.2023.05.009.
[27] 卜勝君. 新型電化學生物傳感器快速檢測大腸桿菌及沙門菌技術研究[D]. 北京: 軍事科學院, 2023: 48-60. DOI:10.27193/d.cnki.gjsky.2022.000025.
[28] SUEA-NGAM A, HOWES P D, DEMELLO A J. An amplification-free ultra-sensitive electrochemical CRISPR/Cas biosensor for drug-resistant bacteria detection[J]. Chemical Science, 2021, 12(38): 12733-12743. DOI:10.1039/d1sc02197d.
[29] SHINODA H, TAGUCHI Y, NAKAGAWA R, et al. Amplification-free RNA detection with CRISPR-Cas13[J].Communications Biology, 2021, 4(1): 476-482. DOI:10.1038/s42003-021-02001-8.
[30] HE Dalin, LIU Gang, YANG Jing, et al. Specific high-sensitivity enzymatic molecular detection system termed RPA-based CRISPR-Cas13a for duck Tembusu virus diagnostics[J]. Bioconjugate Chemistry, 2022, 33(6): 1232-1240. DOI:10.1021/acs.bioconjchem.2c00200.
[31] 馬馳虹. 基于界面信號增強策略的CRISPR電化學生物傳感器用于腫瘤生物標志物的檢測[D]. 鄭州: 鄭州大學, 2022: 14-30. DOI:10.27466/d.cnki.gzzdu.2022.004348.
收稿日期:2023-07-10
基金項目:淮安市衛生健康科研項目(HAWJ202122);江蘇省預防醫學科研課題(Y2018047)
第一作者簡介:陳大偉(1991—)(ORCID: 0009-0008-2869-3511),男,助理研究員,碩士,研究方向為微生物檢驗。
E-mail: 1832324965@qq.com
*通信作者簡介:劉靚(1982—)(ORCID: 0009-0004-5929-9040),女,副主任技師,碩士,研究方向為微生物檢驗。
E-mail: 410043363@qq.com

