腎小管HBV 抗原陽性表達與HBV 相關性腎炎預后的關系
羅志立 周紅梅 樂麗 林利容
乙型肝炎病毒相關性腎炎(hepatitis B virusassociated glomerulonephritis,HBV-GN)是由乙肝病毒(hepatitis B virus,HBV)直接或間接誘發腎小球損傷的疾病,在我國繼發性腎小球疾病中的發病率占16.6%~32.0%[1]。HBV-GN 的發病機制目前尚不清楚,臨床中部分患者腎檢可觀察到乙肝表面抗原(Hepatitis B surface antigen,HBsAg)、乙型肝炎e 抗原(hepatitis B e antigen,HBeAg)、乙型肝炎核心抗原(Hepatitis B core antigen,HBcAg)在腎組織的沉積[2]。HBV 抗原可沉積在腎小球,也可沉積在腎小管,持續沉積在腎小管會吸引炎癥細胞的浸潤,從而促使腎小管的重塑化和纖維化發展[3],并不利于患者預后。目前已有報道[4-5]顯示,HBV 抗原在腎小管沉積后陽性表達與患者部分臨床特征及預后有關,但仍需更多研究驗證。本研究將探討HBV 抗原陽性表達與HBV-GN 患者預后的關系,為臨床診療提供參考,報道如下。
1 資料與方法
1.1 研究對象
選取2019 年6 月至2022 年6 月重慶市忠縣人民醫院及重慶醫科大學附屬第三醫院收治的HBV-GN 患者96 例,男63 例,女33 例;年齡36~65(40.16±10.82)歲;病程2~76 個月,中位數8.2 個月。入選對象符合HBV-GN 診斷標準[6],根據腎小管中HBV 抗原表達分為陽性組51 例、陰性組45 例。納入標準:年齡18~65 歲;入組前未接受抗HBV、糖皮質激素治療。排除標準:有腎臟移植手術史;合并嚴重心腦血管疾病、惡性腫瘤、血液系統疾病等影響生存期的重疾;合并其他肝炎病毒感染。研究患者均簽署知情同意書,研究經本院醫學倫理委員會批準。
1.2 血液分析
采用全自動血液細胞分析儀(BC-6800,邁瑞醫療)檢測血常規,采用全自動生化分析儀檢測血脂指標、肝功能指標、腎功能指標(試劑盒:四川沃文特生物技術有限公司);采用酶聯免疫吸附法(試劑盒:上海實業科華生物技術有限公司)檢測血清HBsAg、HBcAg、HBeAg;采用熒光定量PCR 法(試劑盒:廣州藍星生物科技開發有限公司)測量HBVDNA 載量,<103拷貝/mL 為低度復制,103~105拷貝/mL 為中度復制,>105拷貝/mL 為高度復制[6]。
1.3 腎組織病理學檢查
經皮腎穿刺獲取患者腎組織進行檢查。光鏡:石蠟包埋,切片厚2 μm,常規HE 和PAS 及PASM染色,鏡下觀察腎組織形態、病變特點及程度;電鏡:腎活檢樣本都含有腎小球≥1 個,鏡下觀察腎組織超微結構變化;免疫熒光:間接免疫熒光法,冰凍切片,切片厚5.0 μm,常規干燥,4℃丙酮固定10 min,PBS 清洗,山羊血清封閉,室溫放置20 min,以濾紙從組織邊緣吸取封閉液,加未標記一抗,37℃孵育30 min,PBS 清洗,加熒光素標記二抗,37℃孵育30 min,PBS 清洗,甘油封片,熒光顯微鏡下觀察HBV 抗原、免疫球蛋白和補體等在腎臟中的沉積部位和HBV 抗原表達熒光強度。免疫熒光檢查中一抗、二抗購自北京中杉金橋生物技術有限公司。
1.4 治療方法
患者完成各項檢查后,予拉米夫定[吉斯凱(蘇州)制藥有限公司,國藥準字H20030581]100 mg 口服,1 次/d;阿德福韋酯膠囊(齊魯制藥有限公司,國藥準字H20080031)10 mg 口服,1 次/d。持續用藥12 個月以上。
1.5 預后判斷及相關指標界定
預后不良[7]:①主要終點事件:治療無效,標準為治療12 個月時24 h 尿蛋白排泄量較基線水平下降<50%;②次要終點事件:死亡;血肌酐翻倍;終末期腎臟病(End stage renal disease,ESRD),即腎小球濾過率估算值(estimated glomerular filtration rate,eGFR)<15 mL/(min·1.73 m2)或開始長期腎臟替代治療或行移植治療。腎功能損害:eGFR<60 mL/(min·1.73 m2)。根據患者是否發生主要終點事件和(或)次要終點事件判定預后,將患者分為預后不良組和預后良好組。
1.6 統計學方法
2 結果
2.1 患者腎小管HBV 抗原陽性表達情況
96 例患者HBV 抗原陽性表達以HBsAg 為主,陽性組患者腎小管中HBsAg 陽性表達,其中6例合并HBcAg 陽性;陰性組患者腎小管中HBV抗原陰性表達,在腎小球系膜區、腎間質或腎小管上皮細胞等部位HBV 抗原陽性表達,其中單純HBsAg 陽性38 例,單純HBcAg 陽性3 例,HBsAg合并HBcAg 陽性4 例。見圖1。
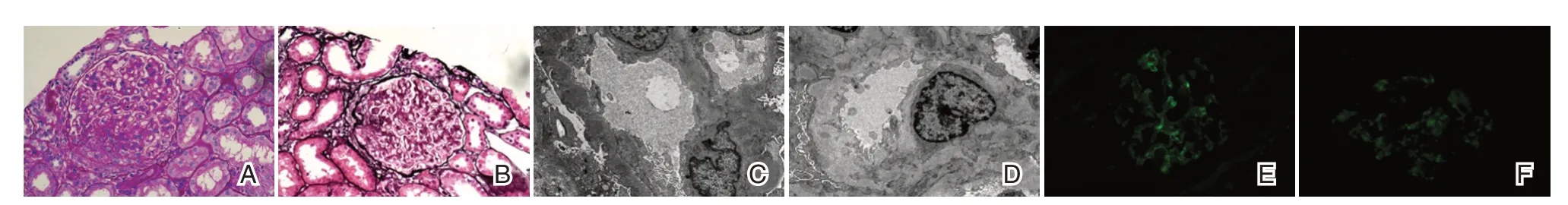
圖1 HBV-GN 患者腎組織病理學檢查圖示Table 1 Renal histopathological examination in patients with HBV-GN
2.2 兩組臨床資料比較
陽性組腎功能損害、血清HBsAg 及HBeAg 陽性比例均高于陰性組,差異有統計學意義(P<0.05)。見表1。
表1 兩組臨床資料比較[n(%),()]Table 1 Comparison of clinical data between the two groups[n(%),()]

表1 兩組臨床資料比較[n(%),()]Table 1 Comparison of clinical data between the two groups[n(%),()]
2.2 兩組預后不良率比較
96 例患者預后不良16 例,陽性組預后不良率高于陰性組,差異有統計學意義(P<0.05)。見表2。
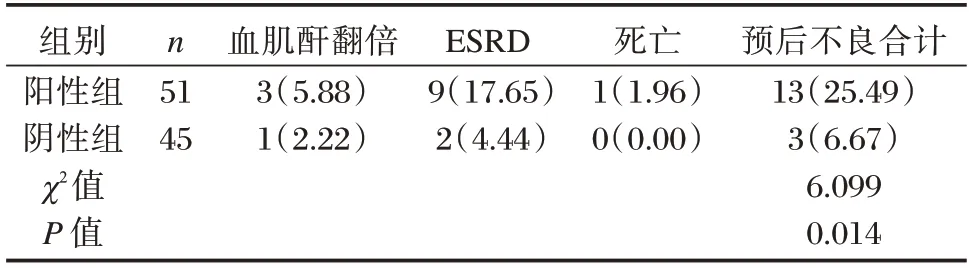
表2 兩組預后不良率比較[n(%)]Table 2 Comparison of poor prognosis rate between the two groups[n(%)]
2.3 不同預后患者臨床資料比較
預后不良者腎功能損害、HBsAg 陽性、HBeAg陽性比例及Scr 水平高于預后良好者,差異有統計學意義(P<0.05);預后不良者HBV-DNA 低度、中度和高度復制比例與預后良好者比較差異有統計學意義(P<0.05)。見表3。
表3 不同預后患者臨床資料比較[n(%),()]Table 3 Comparison of clinical data of patients with different prognoses[n(%),()]
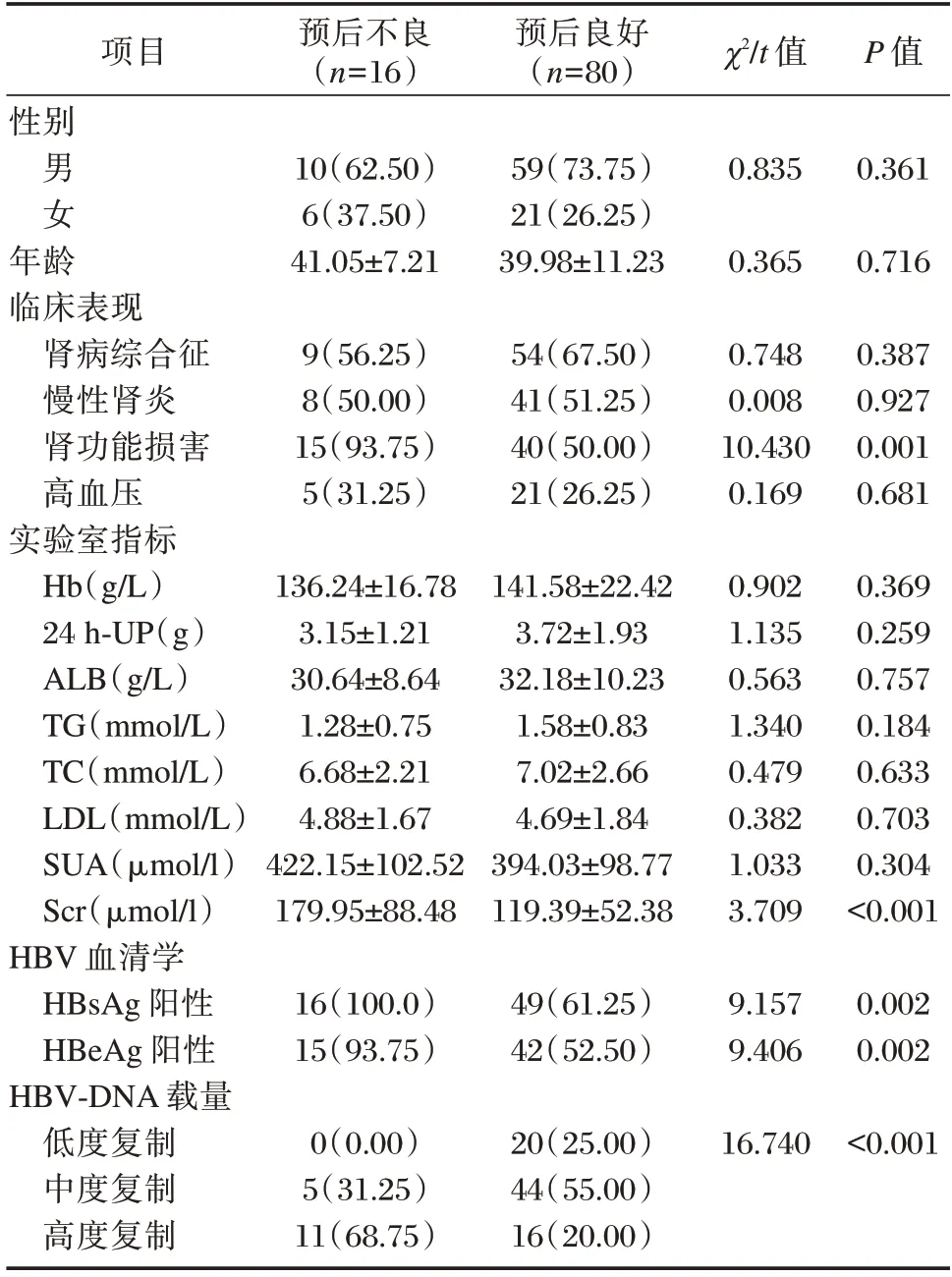
表3 不同預后患者臨床資料比較[n(%),()]Table 3 Comparison of clinical data of patients with different prognoses[n(%),()]
2.4 影響HBV-GN 患者預后的logistics 分析
存在腎功能損害、HBsAg 陽性、HBeAg 陽性、高水平Scr、腎小管HBV 抗原陽性、HBV-DNA 高度復制是HBV-GN 患者預后不良的獨立危險因素(P<0.05)。見表4。
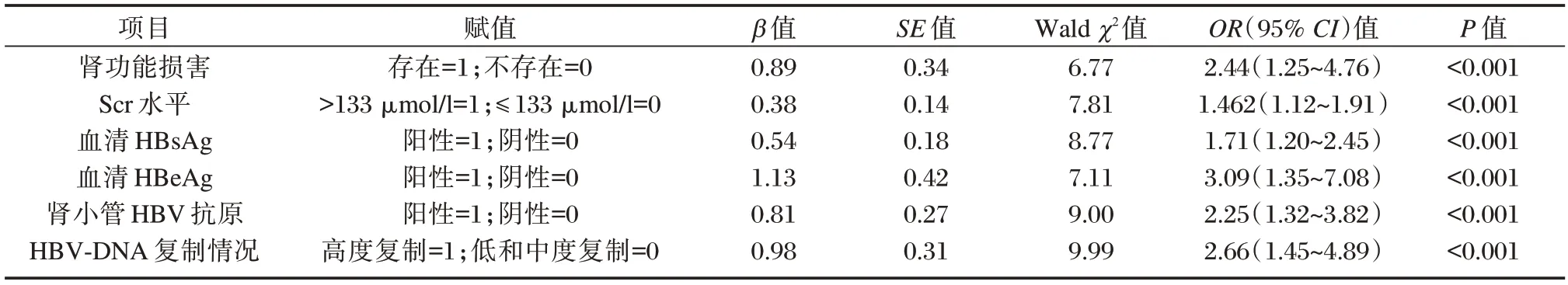
表4 影響HBV-GN 患者預后的logistics 分析Table 4 Logistics analysis of multiple factors affecting the prognosis of HBV-GN patients
3 討論
HBV-GN 是免疫介導為主并由遺傳、社會、環境等多種因素參與的腎實質性損傷,臨床多表現為進行性腎功能不全和腎病綜合征,病情輕重不一,治療以抗病毒治療和免疫抑制治療為主[8]。HBV-GN的發生發展與HBV 抗原密切相關,HBV 抗原可與相應抗體結合成為免疫復合物循環至腎小球或腎小管上沉積,進而直接攻擊腎組織、引起機體免疫功能失衡,導致HBV-GN 的發生與病情的加重[9]。已有研究[10]顯示,HBV 抗原持續在腎小管上皮細胞表達會增加腎病患者加速進展至ESRD 的風險,目前關于HBV 抗原在腎小管上表達情況的研究集中于分析陽性表達與陰性表達患者臨床特征、病理表現差異,也有部分研究探討其對于患者機體功能、預后的影響情況,但仍需更多研究驗證[11]。
HBV 攻擊損害腎臟可導致腎小球病變和腎小管病變。HBV 抗原可通過腎小管上皮細胞作為靶細胞,直接感染腎臟并沉積在腎小管原位感染復制,損害腎功能;并可通過免疫損傷機制,在機體通過固有免疫對抗HBV 時造成機體免疫損傷,影響機體免疫功能[12]。此外,HBV 抗原能以腎小管上皮細胞為主要宿主細胞進行原位轉錄、復制,誘導腎小管上皮細胞凋亡,引起腎小管免疫微環境紊亂,從而介導腎小管的損傷;還可通過腎小管上皮充質轉分化、腎小管上皮細胞凋亡等機制引起腎小管間質纖維化。腎臟病進展中,腎小管間質病變可獨立于腎小球病變,并可通過多種病理生理學機制加劇腎小球病變,促進病情發展最終導致ESRD,影響患者預后[13]。本研究結果顯示,陽性組患者腎功能損害、HBsAg 陽性、HBeAg 陽性的比例均高于陰性組,說明腎小管HBV 抗原陽性表達的HBV-GN 患者腎功能損害情況更為嚴重。血清HBsAg 陽性、HBeAg 陽性表達率增加,這是因為腎小管HBV 抗原陽性表達意味著HBV 抗原沉積于腎小管,導致腎小管損傷,加重了肝功能損害。也有研究[14]顯示,HBV-GN 患者中超過50%均存在腎小球HBsAg 和HBcAg 陽性表達,且腎功能損傷較陰性者更明顯,與本研究結果類似。本研究結果說明腎小管HBV 抗原陽性表達的HBV-GN 患者預后更差,與既往研究[15]結果類似。多因素logistics 回歸分析發現,存在腎功能損害、HBsAg 陽性、HBeAg 陽性、高水平Scr、腎小管HBV 抗原陽性、HBV-DNA 高度復制是HBV-GN患者預后不良的危險因素,提示若HBV-GN 患者存在腎功能損害,腎小管HBV 抗原陽性表達、高水平Scr 及HBV-DNA 高度復制,則其預后不良風險較高,應重點關注。國外研究[16]指出,腎小管HBV 抗原陽性表達影響HBV-GN 患者預后的原因可能是HBsAg 沉積于腎小球系膜、HBeAg 沉積于血管盤袢形成腎損傷,且HBV 抗原均可沉積于腎小管上皮細胞的胞膜、基膜及刷狀緣等位置,通過誘發免疫損傷、細胞凋亡、炎細胞浸潤等腎小管損傷機制引起腎臟疾病的進展,造成預后不良。
綜上所述,HBV-GN 腎小管HBV 抗原陽性表達是患者預后不良的獨立危險因素,HBV 抗原持續沉積于腎小管而損傷腎小管可能是導致患者腎功能惡化從而導致患者預后不良的重要原因,值得臨床進一步驗證。

